改良胰管逆行注射法制犬急性坏死性胰腺炎模型
2018-04-18薛新梅鲁梦婷林德贵
薛新梅, 鲁梦婷, 魏 娜, 林德贵
(1.新疆巴音郭楞蒙古自治州州动物疾病控制与诊断中心 , 新疆 巴音郭楞 841000; 2.西班牙海博莱生物大药厂股份公司北京代表处 , 北京 海淀 100086; 3.中国农业大学动物医学院 , 北京 海淀 100193)
急性胰腺炎(AP)是消化科的常见危急重症,发病初期血液中产生的大量抗炎细胞因子、炎症介质及氧自由基,炎症介质之间相互作用,引起“炎症介质瀑布样级联效应”[1-3]。临床上可分为轻症急性胰腺炎和重症急性胰腺炎,重症急性胰腺炎患犬的病死率较高,可达20%~30%[4]。临床以急性腹痛、呕吐、发热、血与尿淀粉酶增高为特点。急性胰腺炎又分水肿型和出血坏死型两种,而临床上多见水肿型[5]。急性胰腺炎由于发病机制复杂、临床表现多样、病死率高,因此动物模型实验在研究中运用广泛。从1856年第一个急性胰腺炎动物模型制作出来后,多种动物模型相继问世。大致可分为非侵入型(雨蛙素诱导法、L-精氨酸诱发法、无胆盐乙硫氨酸饲喂法等)和侵入型(结扎法、胰管逆行注射法等)。每种方法都各有优缺点,可根据实验动物的不同有所选择。胰管逆行注射法制胰腺炎操作复杂、易于感染、易形成不全梗阻,但存活率相对较高,模型最为稳定,是目前最常用的、最被认可的模型。本研究证实了用5%牛磺胆酸钠(0.1 mL/kg体重)和胰蛋白酶(3 500 U/kg体重)的混合溶液,通过改良后的胰管逆行注射法,能成功构建犬急性坏死性胰腺炎,且模型相对稳定。
1 材料与方法
1.1 实验动物 购自北京市沙河利通实验动物养殖中心的杂种健康犬6只,体重9±3 kg体重,年龄1~3岁,雌雄各半,所有动物按照标准免疫与驱虫程序进行防疫(六联苗、狂犬苗,荷兰英特威国际有限公司;汽巴杜虫丸,诺华动物保健公司)。实验犬饲养在相对独立的实验动物房中,有通风设施,室温在18 ℃~25 ℃之间,每日饲喂1次。试验开始前一天做生化血常规,正常者入选。
1.2 犬实验性急性胰腺炎模型构建 术前所有犬禁食24 h,正常饮水。肌肉注射舒泰50®(0.05 mL/kg体重)和846合剂(0.05 mL/kg体重)进行麻醉,待犬进入麻醉后,行常规剃毛手术准备,铺创巾。腹中线切口开腹,暴露十二指肠向后翻转,显示胰腺,紧贴十二指肠肠壁,呈粉红色、质软,呈扁平长带状(胰腺大小个体差异较大)。寻找胰腺右叶与十二指肠连接处,在其对侧肠壁切开长约2.0~2.5 cm的纵行切口,即可见到粉红色肠壁一个大小约1.0~1.5 mm略发白的脐样凹陷,这即为小乳头(副胰管开口于此),在小乳头上方大约1.5~3 cm处可见向肠腔突出的大小约3~4 mm的隆起为大乳头(胆总管和胰管开口于此),结扎胰管。在副胰管处向乳头部置入直径2.0 mm左右的塑料管材料,深度约1~1.5 cm,将微量注射泵连于管外,以8 Kpa的恒定压力将5%牛磺胆酸钠(0.1 mL/kg体重)和胰蛋白酶(3 500 U/kg体重)的混合液以27 mL/h的速度注入胰管内,留置 5 min后将塑料管拔出。缝合十二指肠壁,并逐层关腹。整个过程无菌操作。手术室环境温度控制在25 ℃±1 ℃。造模后7 d实验犬禁食禁水。
模型构建完成后0.5 h开始静脉滴注,之后每天8∶00和20∶00给实验犬输液,直到7 d后实施安乐死。每天按照0.1 mL/kg体重的剂量,皮下注射拜有利。
1.3 样品的采集及处理 实验犬在麻醉前,造模后0.5 h,造模后12 h,24 h,分别在每天第1次输液前采集静脉血,做血常规检验及生化指标检测;在造模前以及在实验后48 h及第7天应用B超检测胰腺在形态结构上的变化。
1.4 统计学分析 所用数据均采用GraphPad Prism 4 Project统计分析软件进行分析处理,实验结果用均数±标准差(x±SD)表示。
2 结果与分析
2.1 急性胰腺炎模型构建情况 向主胰管内注入牛磺胆酸钠和胰蛋白酶复合液15 min后可以看到胰腺充血、出血明显(见中插彩版图1);造模后1 d,患犬体温升高,呕吐,拉血红色稀便,腹痛,呈“祈祷”式(见中插彩版图2、3);在模型构建完成第1天,各模型组与造模前相比,血浆淀粉酶含量差异极显著(P<0.01),达到术前5倍以上(表1),血清脂肪酶含量也达到术前8倍左右,差异极显著(P<0.01)(表1);在模型构建完成48 h,各模型组与造模前相比,B超影像显示胰腺边缘不规则增大,回声增强且不均质,包膜不可见;围绕胰腺的肠系膜回声增强,水肿导致低回声的均一的网状结构中有产回声的小叶组织结构出现;有些犬出现少量腹水(图4~6)。
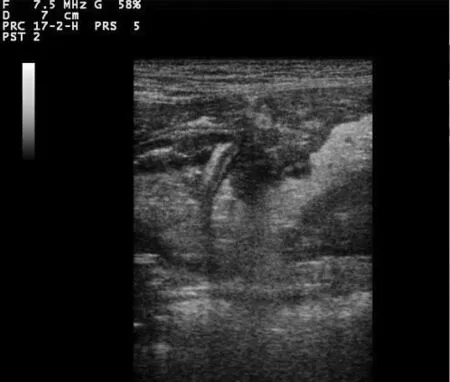
图4 胰腺纵切面

图5 胰腺纵切面

图6 肾脏部位超查出少量腹水
光镜下观察可见造模的实验犬胰腺,腺泡细胞细胞崩解、坏死,细胞界限不分明(见中插彩版图7)。以上结果表明,采用胰管逆行注射法构建急性胰腺炎模型成功,各模型组均构建成功说明了胰管逆行注射法构建的急性胰腺炎模型稳定。

表1 实验犬术前与术后12 h血清淀粉酶和脂肪酶水平对比 (U/L)
**:术前与术后12 h差异极显著(P<0.01)
2.2 实验犬血液学检测 白细胞总数、血清淀粉酶、血清脂肪酶变化(见表2)。
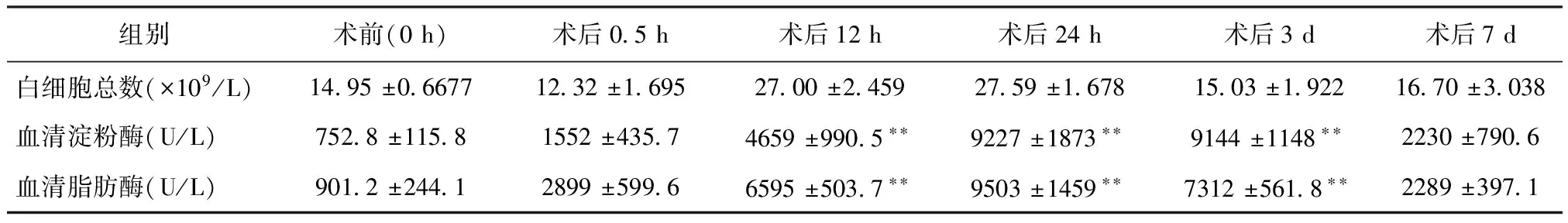
表2 实验犬白细胞总数、淀粉酶和脂肪酶变化情况
**:术前与术后差异极显著(P<0.01)
血清淀粉酶和血清脂肪酶的含量是检测急性胰腺炎的一个重要生化指标:(1)从表2可以看出,实验犬在术后的第1天到第3天的淀粉酶、脂肪酶含量变化差异显著(P<0.05),表明所有模型组的胰腺炎病理模型构建成功;(2)从淀粉酶变化图(图9)可以看出,急性胰腺炎发生之后,其血清淀粉酶含量是一个先升高后下降的变化过程,在第1天就可以达到峰值,其数值变化升高8倍左右,在第3天到第4天之间缓慢下降,于第7天下降到接近正常值水平;(3)从表2可以看出,术后的第1天到第3天的脂肪酶含量变化差异显著(P<0.05),表明所有模型组的胰腺炎病理模型构建成功;(4)从脂肪酶变化图(图9)可以看出,急性胰腺炎发生之后,其血清脂肪酶含量是一个先升高后下降的变化过程,在第一天就可以达到峰值,其数值变化升高10倍左右,在第2天到第4天之间缓慢下降,于第7天下降到接近正常值水平。
2.3 B超影像学观察 造模前,使用高频探头进行十二指肠段纵向定位扫查,可见正常胰腺右叶质地均匀,边缘清晰的胰腺,胰腺呈细粒状低回声,回声均匀(图8)。造模后2 d, 胰腺右叶包膜不可见,边缘不规则增大,实质回声显著不均(如图9)。造模后7 d,胰腺边缘分界不清、水肿,实质回声不均匀,有低回声甚至无回声区,也有强回声区并伴有后方声影,提示有局部坏死灶(如图10)。

图8 胰腺纵切面

图9 胰腺纵切面

图10 胰腺纵切面
3 讨论
利用动物模型来研究急性胰腺炎的发展最早可以追溯到1859年,Bernad用胆汁和橄榄油注入杂种犬的胰管内造成了急性胰腺炎。在此之后,通过不断的探索,成功地复制出了多种不同类型的急性胰腺炎动物模型,如雨蛙素诱发法、L—精氨酸诱发法、胆胰管逆行注射法和胆胰管结扎法等。由于实验动物不一样,选择合适的造模方式也是不一样的。
目前,诱发犬急性胰腺炎模型较常用的方法是胆胰管结扎法、胆胰管逆行注射法等。相对而言胆胰管结扎法成本低,但模型稳定性不高,不能控制急性胰腺炎造模的程度;胆胰管逆行注射法操作较复杂,但模型最稳定,也是目前最常用的而且最认可的造模方式。
本试验在预试验中,对多种造模方式进行摸索发现,胆胰管结扎法易造成胆汁淤积,在造成胰腺的损伤的同时,还能造成肝脏的严重损伤。这样不仅影响了生化指标的变化,还影响观察胰腺炎的发生发展,不能体现出胰腺炎继发肝脏的损伤。若改良使用胰管结扎法,由于胰管和总胆管共同开于十二指肠壶腹部,在十二指肠壁有一个公共通道,不易于胰管的单独结扎。而且,在单纯胰管结扎造成的胰腺炎模型中,由于犬个体差异,造出的急性胰腺炎模型也不稳定,经病理组织学观察,有的间质充血、水肿显著,出血不显著,表现出的是轻度水肿型胰腺炎;有的可见局灶性坏死,伴发出血,表现出的是重度坏死型胰腺炎。
有试验表明[6],胰酶释放入间质内有3种机制:(1)机械性或功能性的胰管系统闭塞使胰酶排出受阻;(2)细胞毒性因子(或物质)导致腺泡细胞和导管细胞的质膜完整性遭到破坏;(3)血管因素或溶酶体的影响而导致腺泡细胞胞质内的酶原活性早熟。采用胰管逆行注射法造急性胰腺炎模型,常采用牛磺胆酸钠和胰蛋白酶混合液通过胰管注入胰腺。由于异常的胰酶激活能导致胰腺自身消化,而牛磺胆酸钠则是一种细胞毒性物质,注入后能激活胰蛋白酶原,最终导致胰腺组织的损伤,启动胰腺自身的消化链锁。牛磺胆酸钠诱导胰腺损伤的程度与浓度有关。试验证明,逆行胆胰管注射诱发的急性胰腺炎模型中,5%牛磺胆酸钠造成的胰腺病变明显比3%牛磺胆酸钠诱发的严重[7]。
本试验通过临床症状、生化指标、B超影像学观察和病理学变化表明,在传统胰管逆行注射法的基础上,通过改良结扎主胰管后,再用5%牛磺胆酸钠(0.1 mL/kg体重)和胰蛋白酶(3 500 U/kg体重)的混合液以27 mL/h的速度注入副胰管内,保证混合物以恒定压强注入胰腺中。造出的实验犬急性胰腺炎模型稳定,均是急性坏死性胰腺炎;模型死亡率低。结果表明,本试验制备急性坏死性胰腺炎模型的方法是成功的,为进一步研究和探讨ASP的临床治疗和基础损伤机制提供了一种较为理想的实验手段。
参考文献:
[1] Lankisch P G,Apte M,Banks P A.Acute pancreatitis[J]. Lancet,2015,386(9988) :85-96.
[2] Mews P,Philips P,Fahmy R,etal.Pancreatic stellate cells respond to inflammatory cytokines:potential role in chronic pancreatitis[J].Gut,2002,50(4) :535-541.
[3] 刘大晟,吴先林,李接兴,等.三种不同造模方法建立大鼠记性胰腺炎模型的对比[J].中国老年学,2016,36(10):2 315-2 318.
[4] 下濑川澈.急性胰腺炎重症化的机序[J].日消志,2001,98:1 029-1 036.
[5] 王建华.家畜内科学[M].3版.中国农业出版社,2006:369-372.
[6] Evander A,Lundgulist I.Influence of hormonal stimulation by cerulein on acute experiment pancreatitis in the rat[J].Eur Surg Res,1981,13:857.
[7] Robert J,Greenstein M D,Lawrence R,etal.Activation of the renin systern in acute pancreatitis[J].Am J Med,1997,82(3):401-404.
