小麦秆锈病新抗源及抗病基因所在染色体特异分子标记
2018-04-18韩冉李天亚宫文萍李豪圣宋健民刘爱峰曹新有程敦公赵振东刘成刘建军
韩冉,李天亚,宫文萍,李豪圣,宋健民,刘爱峰,曹新有,程敦公,赵振东,刘成,刘建军
小麦秆锈病新抗源及抗病基因所在染色体特异分子标记
韩冉1,李天亚2,宫文萍1,李豪圣1,宋健民1,刘爱峰1,曹新有1,程敦公1,赵振东1,刘成1,刘建军1
(1山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,济南 250100;2沈阳农业大学植物保护学院,沈阳 110866)
【】小麦秆锈病是具潜在毁灭性的小麦病害之一,秆锈菌小种Ug99严重威胁全球小麦生产。本研究通过对165份小麦-近缘植物染色体系进行抗秆锈病鉴定,筛选小麦秆锈病新抗源并建立抗病基因所在染色体特异分子标记,以发掘小麦秆锈病新抗源,培育抗病品种,有效防御Ug99导致的秆锈病。【】将供试的165份小麦-近缘植物染色体系、3份六倍体小麦及感病对照小密穗分别播种于直径10 cm的瓦盆中,生长到一叶一心时,用中国小麦秆锈菌流行小种34MKGQM和21C3CTHSM进行接种,当感病品种小密穗充分发病时,按照0—4级标准调查记载侵染型,对供试材料的抗秆锈病级别进行统计。同时,提取免疫、近免疫、高抗秆锈病附加系/代换系及其对应的整套染色体系、中国春等材料的基因组DNA,利用101对PLUG引物进行PCR扩增,扩增产物经限制性内切酶酶切后进行电泳检测,筛选并建立抗秆锈基因所在染色体特异分子标记。【】在165份小麦-近缘植物染色体系中,中国春-卵穗山羊草7Mg#1附加系、中国春-卵穗山羊草7Mg#1(7A)和7Mg#1(7B)代换系、中国春-帝国黑麦1R附加系、中国春-中间偃麦草?Ai附加系(?表示外源染色体同源群未鉴定)、中国春-单芒山羊草6N附加系、中国春-易变山羊草6SvS端体附加系和中国春-智利大麦6Hch附加系9份材料对秆锈病表现为免疫或近免疫;ALCD-尾状山羊草7C#1附加系、中国春-卵穗山羊草7Mg#1(7D)代换系、中国春-帝国黑麦6R附加系、中国春-高大山羊草6Sl#3附加系、中国春-高大山羊草6Sl#2(6B)代换系、中国春-希尔斯山羊草3S#1附加系和中国春-拟斯卑尔脱山羊草2Sg#3附加系7份材料对秆锈病表现为高抗;其余材料均表现为中感或高感。抗秆锈性基因定位信息比较分析发现,高大山羊草6Sl#2和6Sl#3、帝国黑麦6R、智利大麦6Hch、卵穗山羊草7Mg#1、尾状山羊草7C、中间偃麦草?Ai染色体上可能含有抗秆锈新基因。分子标记筛选、定位及特异性验证研究共获得8个新的多态性标记,其中5个(TNAC1715、TNAC1718、TNAC1737、TNAC1739和TNAC1753)和3个(TNAC1740、TNAC1751和TNAC1756)分别被定位在6R和6Sl染色体上。【】筛选得到8份可能含有抗秆锈新基因的材料,建立了抗秆锈基因所在染色体特异新标记8个。
小麦近缘植物;染色体系;秆锈病;多态性
0 引言
【研究意义】小麦秆锈病由小麦秆锈菌(Pers. f. spEriks. and E. Henn)引起,是小麦的重要真菌病害之一。近30多年来,由于全球小麦普遍引入等抗秆锈病基因,小麦秆锈病得到了很好控制,基本上只在局部地区零星发生[1]。然而,1999年能够克服抗性的小麦秆锈菌小种Ug99的出现,使得世界小麦生产又重新处于秆锈病的威胁之下。Ug99除能克服的抗性外,还对其他多数重要抗秆锈病基因具有极罕见的联合致病力,全球90%以上的重要小麦生产品种都表现为高度感病[2]。2006年中国118份小麦品种送到肯尼亚进行Ug99抗性分析鉴定,其中只有2份材料表现抗性[3],由此可见中国小麦品种对Ug99的抗性较差。Singh等[4]对52个抗秆锈病基因的Ug99抗性鉴定,只有22(42.3%)个基因对Ug99表现一定抗性,因此,发掘新抗源是中国应对Ug99以及其变异小种的最关键的任务之一[5-7]。【前人研究进展】迄今为止,小麦抗秆锈病基因已被正式命名至,并且还有许多未命名的抗病基因。小麦抗秆锈病基因来源广泛,除来自普通小麦种之外,还有来自小麦属的其他种,如一粒小麦、二粒小麦、硬粒小麦、提莫菲维小麦、阿拉拉特小麦以及小麦近缘属。其中,、、和来自长穗偃麦草(),来自于顶芒山羊草(),来自偏凸山羊草(),、和来自拟斯卑尔脱山羊草(),、、和来自栽培黑麦(),来自中间偃麦草(),来自希尔斯山羊草(),来自簇毛麦(),来自卵穗山羊草()[1,8]。Singh等[4]鉴定的抗Ug99的基因中有19个来源于小麦亲缘种属。可见小麦近缘种属是小麦抗秆锈的重要基因源。【本研究切入点】小麦族含有300多个物种,其中小麦近缘物种250个以上[9],前人仅对小麦近缘种属的极少数物种进行了抗秆锈研究[1,8];另外,由于小麦与近缘种属之间的不亲和性等诸多因素,导致杂交成效较低,远缘种属的优异基因无法导入小麦,而小麦-近缘物种染色体系是向小麦转育近缘物种优异基因的良好载体和中间桥梁。因此,对较多的小麦-近缘植物染色体系进行抗秆锈鉴定,有利于筛选小麦秆锈病新抗源。【拟解决的关键问题】本研究利用中国小麦秆锈菌流行小种34MKGQM和21C3CTHSM对165份小麦-近缘植物染色体系进行苗期抗秆锈鉴定,与已报道的秆锈基因染色体定位信息比较,获得小麦秆锈病新抗源;筛选基于水稻EST序列设计的PLUG(PCR-base landmark unique gene)引物,建立抗病基因所在染色体的特异分子标记,为中国应对Ug99增加新的候选抗源,也为染色体工程诱导获得可用于小麦抗病育种的小麦-近缘植物染色体易位系奠定基础。
1 材料与方法
1.1 材料
供试材料为165份小麦-近缘植物染色体系(附加系、代换系和易位系)和3份六倍体小麦(对照)(电子附表1)。TA编号材料由美国堪萨斯州立大学植物病理系Jon Raupp博士提供;JIC编号材料、CSDA1N-CSDA4N、6N、7N和XX029由英国约翰英纳斯中心Reader S M教授提供;中国春(Chinese Spring,CS)由电子科技大学杨足君教授提供;感病对照小麦小密穗(little club,LC)和中国当前优势秆锈菌生理小种34MKGQM和21C3CTHSM(均采集于四川阿坝州)由沈阳农业大学植物保护学院植物病理教研室保存并提供。其中,34MKGQM的有效抗病基因包括、、、、、、、、、、、、、、、、、、、、、、、、、和;21C3CTHSM的有效抗病基因包括、、、、、、、、、、、、、、、、、和。作为分子标记筛选对照的济麦19(JM19)、济麦20(JM20)、济麦22(JM22)、济麦23(JM23)、济麦262(JM262)和济麦229(JM229)由山东省农业科学院作物研究所小麦育种团队育成。
1.2 秆锈病苗期抗性鉴定
试验于2016年10月至2017年3月在玻璃温室内进行,供试小麦材料按编号播种于直径10 cm的瓦盆中,以感病品种LC为对照,在温室中当幼苗长至一叶一心时(叶龄期在7 d左右),进行接种鉴定:将新鲜的按照1﹕1(v/v)混合的34MKGQM和21C3CTHSM用干燥滑石粉以1﹕10(v/v)稀释后喷粉接种于已喷雾(0.01%吐温20)的幼苗上,于16—18℃下保湿12—14 h后,置于18—20℃的温室中培养,待感病对照LC充分发病后进行抗病性鉴定。鉴定设3次重复,分别调查记载。侵染型按0—4级进行记载[9],其中,0为免疫,;为近免疫,1为高抗,2为中抗,3为中感,4为高感[7]。
1.3 DNA提取与PLUG-PCR
取供试材料的一叶一心期幼叶,利用SDS方法[10]提取其基因组DNA。PLUG引物序列参照文献[11],由成都瑞信生物公司合成。反应体系包含2.0 μL 10×PCR buffer(含Mg2+)、2.0 μL 2.5 mmol·L-1dNTP,上下游引物各1 μL(10 μmol·L-1)、0.2 μL5U·μL-1Taq酶、50—100 ng基因组DNA,加ddH2O补至20 μL。反应程序为94℃3 min;94℃45 s,57℃45 s,72℃2 min,35个循环;72℃10 min。PCR产物分别用限制性内切酶Ⅰ和Ⅲ进行酶切,酶切产物用2%琼脂糖凝胶电泳进行检测。
1.4 染色体特异PLUG标记的建立
利用免疫、近免疫和高抗小麦秆锈病的小麦-近缘植物染色体系和中国春为材料筛选染色体第6和7同源群的101对PLUG引物。相比中国春,选择能在小麦-近缘物种染色体系中扩增出多态性的引物。将上述引物用于扩增所涉及近缘物种的整套染色体系,确定相应扩增多态性片段为物种该染色体特异标记。
2 结果
2.1 小麦-近缘植物染色体系抗秆锈鉴定
用当前中国小麦秆锈菌流行小种34MKGQM和21C3CTHSM的混合菌种对供试的168份材料进行抗秆锈鉴定,结果显示,中国春-卵穗山羊草7Mg#1附加系、中国春-卵穗山羊草7Mg#1(7A)和7Mg#1(7B)代换系、中国春-帝国黑麦1R附加系、中国春-中间偃麦草?Ai附加系(TA3681和TA5566)(?表示未鉴定同源群)、中国春-单芒山羊草6N附加系、中国春-易变山羊草6SvS端体附加系和中国春-智利大麦6Hch附加系等9份材料对秆锈病表现为免疫或近免疫(电子附表1);ALCD-尾状山羊草7C#1附加系、中国春-卵穗山羊草7Mg#1(7D)代换系、中国春-帝国黑麦6R附加系、中国春-高大山羊草6Sl#3附加系、中国春-高大山羊草6Sl#2(6B)代换系、中国春-希尔斯山羊草3S#1附加系和中国春-拟斯卑尔脱山羊草2Sg#3附加系等7份材料对秆锈病表现为高抗;其余材料均表现为中感或高感(电子附表1)。
对照六倍体小麦ALCD和中国春对小麦秆锈病分别表现为中感和高感,ALCD-尾状山羊草2C—6C#1附加系、中国春-高大山羊草1Sl#3—5Sl#3、7Sl#3附加系、中国春-高大山羊草1Sl#2、3Sl#2、5Sl#2附加系、2Sl#2(2D)和4Sl#2(4D)代换系、中国春-卵穗山羊草1Mg-6Mg附加系和1Ug—7Ug附加系对小麦秆锈病均表现为中感和高感,而ALCD-尾状山羊草7C#1附加系、中国春-卵穗山羊草7Mg#1附加系、中国春-卵穗山羊草7Mg#1(7A)、7Mg#1(7B)、7Mg#1(7D)代换系、中国春-高大山羊草6Sl#3附加系和中国春-高大山羊草6Sl#2(6B)代换系对小麦秆锈病均表现为高抗(电子附表1),表明尾状山羊草7C染色体、卵穗山羊草7Mg#1染色体、高大山羊草6Sl#2和6Sl#3染色体上均含有抗秆锈基因。
中国春-希尔斯山羊草3Ss#1附加系、中国春-拟斯卑尔脱山羊草2S#3附加系和中国春-单芒山羊草6N附加系分别对小麦秆锈病表现为高抗和近免疫,而对照中国春、中国春-希尔斯山羊草1Ss#1、2Ss#1、4Ss#1—7Ss#1附加系、中国春-拟斯卑尔脱山羊草1Sg#3、3Sg#3—7Sg#3附加系、中国春-单芒山羊草1N—4N和7N附加系均中感或高感秆锈病(附表1),这表明,希尔斯山羊草3Ss#1染色体、拟斯卑尔脱山羊草2S#3染色体和单芒山羊草6N染色体上均含有抗小麦秆锈病基因。中国春-希尔斯山羊草3Ss#1附加系抗病可能是因为在希尔斯山羊草3Ss上存在抗秆锈基因的缘故;中国春-拟斯卑尔脱山羊草2S#3附加系抗病可能是因为拟斯卑尔脱山羊草2S上存在有抗病基因、和的原因。因为单芒山羊草N染色体是偏凸山羊草Nv染色体组的供体[12],而偏凸山羊草6Nv染色体含有抗小麦秆锈基因,因此,中国春-单芒山羊草6N附加系近免疫小麦秆锈病,可能是6N染色体上含有的缘故。
对照小麦中国春、中国春-帝国黑麦2R—5R和7R附加系高感秆锈病,中国春-帝国黑麦1R和6R附加系分别对小麦秆锈病表现为免疫和高抗(电子附表1),说明帝国黑麦1R和6R含有抗秆锈病基因,前者抗秆锈病可能是因为1R染色体上存在抗秆锈基因和。中国春-智利大麦1Hch+1HchS、4Hch—5Hch附加系高感小麦秆锈病,但中国春-智利大麦6Hch附加系表现为高抗(电子附表1),说明智利大麦6Hch含有抗2个小种的基因。2份中国春-中间偃麦草?Ai附加系(TA3681和TA5566)均近免疫小麦秆锈病(电子附表1),说明中间偃麦草?Ai染色体上含有抗秆锈基因。
2.2 含抗秆锈基因材料中外源染色体多态性引物筛选
为了建立秆锈病抗性较好材料中外源染色体特异的标记,利用中国春-高大山羊草6Sl#3附加系、中国春-高大山羊草6Sl#2(6B)代换系、中国春-帝国黑麦6R附加系、中国春-单芒山羊草6N附加系、中国春-易变山羊草6SvS端体附加系、中国春-智利大麦6Hch附加系、中国春和济麦系列小麦品种对染色体第6同源群的53对PLUG引物进行筛选。结果发现,相比小麦对照,共有13对引物可在相应附加/代换系中扩增出额外的多态性片段(表1),其中,TNAC1740、TNAC1751和TNAC1756能够同时在中国春-高大山羊草6Sl#3附加系和6Sl#2(6B)代换系中扩增出多态性片段。TNAC1715、TNAC1718和TNAC1676等10对引物可在中国春-帝国黑麦6R附加系中扩增出多态性片段,其中TNAC1676等5对引物已被文献[13-14]报道,因此,TNAC1715等5对引物扩增的多态性片段是黑麦6R染色体的新标记。利用含卵穗山羊草7Mg#1染色体的材料与小麦对照筛选第7同源群的48对PLUG引物,未获得多态性。TNAC1740、TNAC1751、TNAC1715、TNAC1718、TNAC1753和TNAC1748引物的扩增结果如图1所示。
2.3 抗秆锈基因所在染色体特异分子标记的建立
为了确定上述多态性片段是相应外源物种染色体特异标记,利用引物TNAC1740、TNAC1751和TNAC1756对中国春-高大山羊草1Sl#3—7Sl#3附加系、中国春-高大山羊草1Sl#2、3Sl#2和5Sl#2附加系、中国春-高大山羊草2Sl#2(2D)、4Sl#2(4D)和6Sl#2 (6B)代换系进行扩增(图2),发现6Sl#3附加系和6Sl#2(6B)代换系均能扩增出多态性片段,说明3对引物扩增出的多态性片段是高大山羊草6Sl染色体特异标记。
利用TNAC1715等10对PLUG引物对中国春-帝国黑麦1R—7R附加系进行扩增(图2),发现这10对引物仅在中国春-帝国黑麦6R附加系中扩增出多态性片段,说明这10对引物扩增的多态性片段是帝国黑麦6R染色体的特异标记。

图1 引物TNAC1740(A)、TNAC1751(B)、TNAC1715(C)、TNAC1718(D)TNAC1753(E)和TNAC1748(F)的扩增
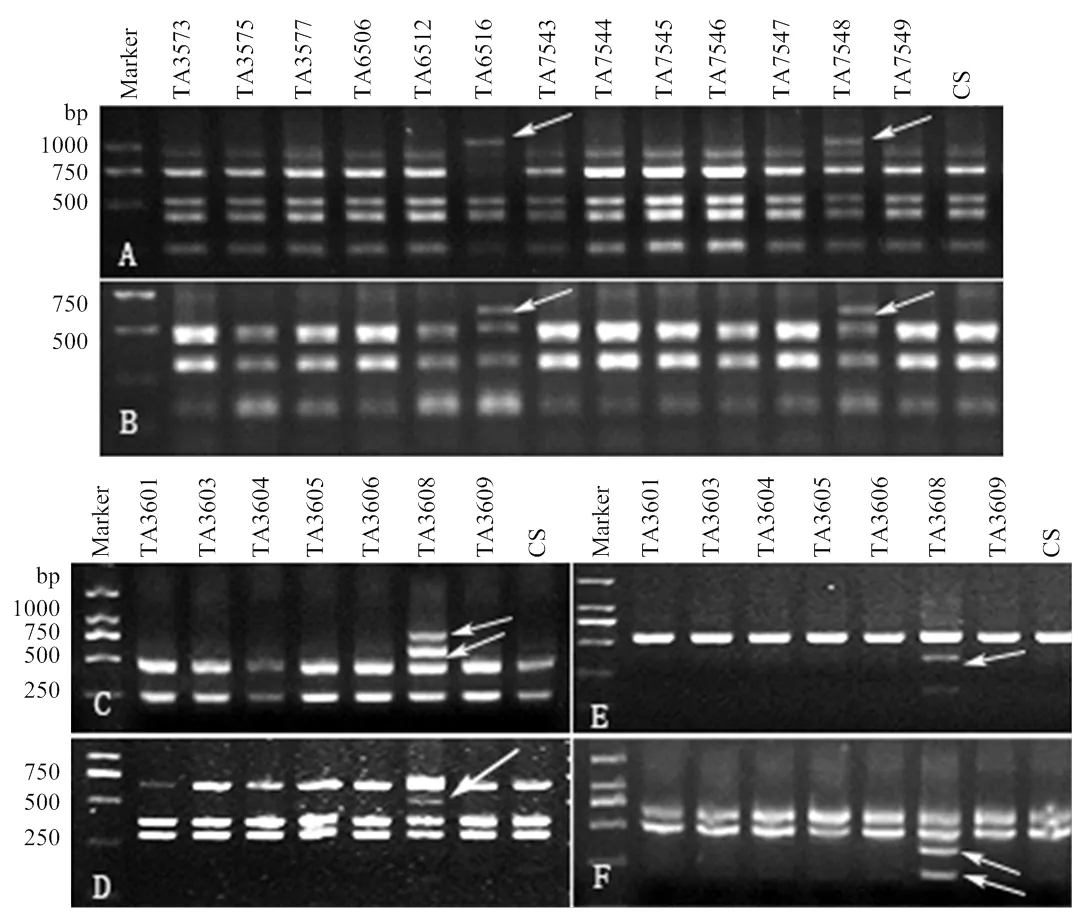
图2 引物TNAC1740(A)、TNAC1751(B)、TNAC1715(C)、TNAC1718(D)TNAC1753(E)和TNAC1748(F)所获多态性条带的染色体定位
Fig 2 Chromosome localization of polymorphism bands that primer pairs TNAC1740 (A), TNAC1751 (B),TNAC1715 (C), TNAC1718 (D), TNAC1753 (E) and TNAC1748 (F) amplified
3 讨论
3.1 高大山羊草6Sl染色体抗秆锈病新基因
高大山羊草()染色体组为SlSl,高抗小麦白粉病、叶锈病、麦二叉蚜和眼斑病,抗干旱胁迫和盐胁迫[15-16],并能够显著提高小麦籽粒Fe和Zn元素含量。Wang等[17]和Garg等[18]发现高大山羊草1Sl染色体导入小麦可显著提高小麦品质;Neelam等[19]和Sharma等[20]先后从小麦-高大山羊草杂交后代中选育出了籽粒微量元素含量高的后代材料。Cenci等[21]发现高大山羊草3Sl染色体短臂上含有抗白粉病基因;Sheng等[22]发现高大山羊草1Sl、3Sl和5Sl上含有抗眼斑病基因;然而,未见高大山羊草染色体上存在抗秆锈基因的报道。

表1 13个特异PLUG标记信息
※代表已报道的多态性引物[13-14]
※indicate the polymorphism primer pairs have been reported[13-14]
本研究发现中国春-高大山羊草6Sl#3附加系和中国春-高大山羊草6Sl#2(6B)代换系均高抗两个秆锈生理小种34MKGQM和21C3CTHSM,说明高大山羊草6Sl上含有抗秆锈新基因。
3.2 黑麦6R染色体抗秆锈病新基因
黑麦是最早也是最成功地用于改良小麦的近缘植物之一,具有诸多优良性状,如抗病虫、抗逆、抗倒伏、分孽力强等。黑麦基因组中的抗白粉病基因~、、和抗锈基因、、、、、、已被导入小麦被广泛应用[23-26],其中的抗秆锈基因、、和分别位于黑麦3R、1RS、1RS和2RL染色体上。本研究发现中国春-帝国黑麦1R和6R附加系分别免疫和高抗小麦秆锈病,而2R—5R和7R附加系高感秆锈病。小麦-帝国黑麦1R附加系表现为免疫的原因可能是1R染色体上含有的是2个生理小种的有效抗病基因。迄今为止,未发现黑麦6R染色体上抗小麦秆锈病的报道,而本研究发现帝国黑麦6R染色体导入中国春之后导致该附加系对秆锈病表现为高抗,因此,6R染色体上含有未被报道的抗秆锈新基因,值得利用染色体工程的方法将其抗病基因通过小片段易位的形式转移到栽培小麦中。本研究中小麦-帝国黑麦2R和3R附加系均高感秆锈病,可能是和对中国当前流行的秆锈菌生理小种34MKGQM和21C3CTHSM失去了抗性。韩建东[27]对中国优势秆锈小种的致病性进行研究的结果也支持已经对中国当前流行的秆锈菌生理小种34MKGQM和21C3CTHSM失去了抗性的结论(文献[27]发表时,还未被报道)。
3.3 卵穗山羊草染色体抗秆锈病新基因
卵穗山羊草()染色体组为UgUgMgMg,是山羊草属中的一个异源四倍体种,高抗白粉病、叶锈病和条锈病[28-31]。来自该物种的抗白粉病基因被定位在卵穗山羊草第七同源群染色体上[32],抗叶锈基因和抗条锈病基因被定位在卵穗山羊草5Mg染色体上[31]。迄今,未见有关于卵穗山羊草基因组上存在秆锈基因的报道。本研究发现对照中国春高感秆锈病,而含卵穗山羊草7Mg#1染色体的附加系/代换系均对秆锈菌生理小种34MKGQM和21C3CTHSM均表现为高抗以上抗性,这表明卵穗山羊草7Mg#1染色体上含有抗秆锈基因。由于卵穗山羊草Mg染色体组来源于顶芒山羊草(),然而,在本研究的供试材料中中国春-顶芒山羊草7M附加系中感秆锈病,这可能是由于用于本研究的中国春-顶芒山羊草7M附加系中的顶芒山羊草不是中国春-卵穗山羊草7Mg附加系中卵穗山羊草的染色体组直接供体造成的。
3.4 智利大麦6Hch染色体上的抗秆锈病新基因
智利大麦()染色体组HchHch,是一个主要分布于智利和阿根廷的二倍体物种。具有高抗叶锈病、白粉病、全蚀病、颖枯病、腥黑穗病、麦二叉蚜、麦双尾蚜和禾谷孢囊线虫等优良性状[33]。研究发现,智利大麦4Hch染色体上含有小麦叶枯病抗性基因,7Hch上含有腥黑穗病抗病基因[34]和控制类胡萝卜素含量的基因[35],1Hch、4Hch和5Hch上含有抗盐基因,1Hch上还含有禾谷孢囊线虫抗性基因[36]。迄今,未见有关于智利大麦染色体上存在秆锈基因的报道。本研究发现中国春智利大麦6Hch附加系对秆锈菌生理小种34MKGQM和21C3CTHSM表现为免疫,说明智利大麦6Hch染色体上含有新的抗秆锈基因。
3.5 尾状山羊草7C染色体上的抗秆锈病新基因
尾状山羊草(L.)染色体组成为CC,是山羊草属的一个重要二倍体种,高抗白粉病[37]、叶锈病[38]、小麦瘿蚊病和蚜虫[37]。Friebe等[39]鉴定出了一套小麦-尾状山羊草附加系B#-F#1和5C(5A)、5C(5D)代换系,因此,可以用这套材料来定位抗性基因所在染色体和作为桥梁进一步向小麦转育其抗性。尾状山羊草抗小麦叶锈基因已成功转移到小麦中[38]。迄今,未见有关于尾状山羊草染色体上存在秆锈基因的报道。本研究发现ALCD感秆锈病,但ALCD-尾状山羊草7C#1附加系却高抗秆锈病,说明尾状山羊草7C染色体上存在有抗秆锈新基因。
3.6 长穗偃麦草染色体上的抗秆锈基因
长穗偃麦草()是偃麦草属多年生野生草本植物,具有二倍体(2n=2x=14,EE或EeEe或E1E1)、四倍体(2n=4x=28,EeEeEbEb或E1E1E2E2)和十倍体(2n=10x=70,EeEeEbEbExExStStStSt或EEE1E1E2E2E4E4E5E5)之分[40],具有抗寒、耐旱、耐盐、抗病和抗虫等优异性状[40-41]。分别位于长穗偃麦草3AeL、7AeL、6AeL和7el2染色体上的、、和已经被导入到小麦中。但在本研究中中国春-长穗偃麦草1E—7E附加系均高感或中感秆锈,这可能是由于(1)本研究中长穗偃麦草与其他研究的长穗偃麦草的来源不同;(2)和对于本研究所用到的2个秆锈生理小种34MKGQM和21C3CTHSM已经失去抗性[ 42]。
3.5 抗秆锈基因所在染色体特异分子标记
高大山羊草染色体标记建立方面,刘晓明等[16]建立了高大山羊草1Sl染色体特异分子标记9个;覃碧等[43]建立2SlL染色体EST-STS标记5个;Cenci等[21]建立了3SlS染色体上与抗白粉病基因连锁的分子标记。本研究发现引物TNAC1740、TNAC1751和TNAC1756在中国春-高大山羊草6Sl#3附加系和中国春-高大山羊草6Sl#2(6B)代换系均能扩增出1 100、700和700 bp的多态性片段,而在中国春-高大山羊草的其他几个附加系和小麦对照中扩增不出相应多态性片段,说明3对引物所扩增的多态性片段是高大山羊草6Sl染色体所特有的片段。
黑麦染色体分子标记方面,刘成等[10]建立了黑麦基因组SCAR标记用于小麦背景中黑麦染色质的鉴定。Koebner等[44]合成了黑麦1R染色体的特异引物,能够鉴定小麦背景下1RS染色质的存在。Kofler等[45]通过构建BCA文库开发了74个黑麦1RS特异的分子标记。王春梅等[46]检测到5个EST-STS标记定位到黑麦1RS染色体上。唐宗祥等[47]筛选到黑麦的6R染色体的SSR标记。本研究建立了黑麦6R染色体PLUG标记10个,其中5个标记与前人报道相同[13-14],引物TNAC1715、TNAC1718、TNAC1737、TNAC1739和TNAC1753所扩增的多态性片段为被报道过的新标记,增加了黑麦6R染色体标记信息。
4 结论
高大山羊草6Sl#2和6Sl#3、帝国黑麦6R、智利大麦6Hch、卵穗山羊草7Mg#1、尾状山羊草7C、中间偃麦草?Ai染色体(同源群未鉴定)上含有抗秆锈新基因,值得利用染色体工程创制相应抗秆锈病小片段易位系;获得的8个新的多态性标记丰富了黑麦6R和高大山羊草6Sl染色体标记信息。
[1] 李伟华. 我国小麦秆锈菌兼Ug99监测新体系建立及其品种抗病基因分析[D]. 沈阳: 沈阳农业大学, 2012.
LI W H. Establishment of new surveillance stem for chinese races and Ug99 off.sp.,resistant genes defection in commercial wheat varieties and distinct proteins display analysis of complementary host minn2761[D]. Shenyang: Shenyang agriculture university, 2012. (in Chinese)
[2] JIN Y, SINGH R P. Resistance in US wheat to recent Eastern African isolates off .sp.with virulence to resistance gene., 2006, 90: 476-480
[3] 何中虎, 夏先春, 陈万权. 小麦对秆锈菌新小种Ug99的抗性研究进展. 麦类作物学报, 2008, 28(1): 170-173.He Z H, Xia X C, Chen W Q. Breeding for resistance to new raceUg99 of stem rust pathogen., 2008, 28(1): 170-173. (in Chinese)
[4] SINGH R P, HODSON D P, JIN Y,HUERTA-ESPINO J, KINYUA M G, WANYERA R, NJAN P, WARD R W. Current status, likely migration and strategies to mitigate the threat to wheat production from raceUG99 (TTKS) of stem rust pathogen., 2006(54): 1-13.
[5] 曹远银, 陈万权. 小麦秆锈菌生理小种鉴别寄主及命名方法的演变. 麦类作物学报, 2010, 30(1): 167-172.
CAO Y Y, CHEN W Q. Stepwise shift of differential hosts and racial designation off. sp., 2010, 30(1): 167-172. (in Chinese)
[6] 韩建东, 曹远银, 孙仲桂. 2007-2008年我国小麦秆锈菌小种种群结构及其对Ug99抗性新种质的毒性分析.麦类作物学报, 2010, 30(1): 163-166.
HAN J D, CAO Y Y, SUN Z G. Race dynamics off.sp.in china and the virulence of CIMMYT wheat germplasm resistant to Ug99., 2010, 30(1): 163-166. (in Chinese)
[7] 吴限鑫, 李天亚, 陈思, 王冠钦, 曹远银, 马世良, 李明菊. 139份小麦品种(系)抗秆锈性测定及其Ug99抗病基因分子检测. 中国农业科学, 2014, 47(23): 4618-4626.
WU X X, LI T Y, CHEN S, WANG G Q, CAO Y Y, MA S L, LI M J. Stem rust resistance evaluation and Ug99-resistance gene detection of 139 wheat cultivars., 2014, 47(23): 4618-4626.
[8] 尹静, 王广金, 张宏纪, 马凤鸣, 孙岩, 肖佳雷. 小麦秆锈抗性遗传及抗性基因研究进展. 植物遗传资源学报, 2007, 8(1): 106-112.
YI J, WANG G J, ZHANG H J, MA F M, SUN Y, XIAO J L. Advances in resistance heredity and resistance stem rust genes of wheat., 2007, 8(1): 106-112. (in Chinese)
[9] SHARMA H C. how wide can a wide cross be., 1995, 82:43-64.
[10] 刘成, 李光蓉, 杨足君, 冯娟, 周建平, 任正隆. 黑麦基因组特异DNA片段的分离与SCAR标记的建立. 西北植物学报, 2016, 26(12): 2434-2438.
LIU C, LI G R, YANG Z J, FENG J, ZHOU J P, REN Z L. Specific DNA band isolation and SCAR marker construction of Rye genome.,2016, 26(12): 2434-2438. (in Chinese)
[11] ISHIKAWA G, YONEMARU J, SAITO M, NAKAMURA T. PCR-based landmark unique gene (PLUG) markers effectively assign homoeologous wheat genes to A, B and D genomes., 2007, 8(1): 135.
[12] TANGUY A M, CORITON O, ABELARD P, DEDRYVER F, JAHIER J. Structure ofchromosome 6Nv, the donor of wheat genes,,, and., 2005, 48(3): 541.
[13] LI J, ENDO T R, SAITO M, ISHIKAWA G, NAKAMURA T, NASUDA S. Homoeologous relationship of rye chromosome arms as detected with wheat PLUG markers., 2013, 122: 555-564.
[14] 雷孟平, 李光蓉, 刘成, 杨足君. 抗条锈病的小麦-非洲黑麦异代换系的分子细胞学鉴定. 农业生物技术学报, 2013, 21(3): 263-271.
LEI M P, LI G R, LIU C, YANG Z J. Molecular cytogenetic characterization of a-substitution line for resistance to stripe rust (. f. sp.)., 2013, 21(3): 263-271. (in Chinese)
[15] MONIKA G, HIROYUKI T, NAOYUKI I, KANENORI T, MIKIKO Y, HISASHI T. A novel pair of HMW glutenin subunits fromimproves quality of hexaploid wheat., 2009, 86: 26-32.
[16] 刘晓明, 张姝倩, 宫文英, 唐海田, 王灿国, 程敦公, 刘成,, 刘建军. 高大山羊草1S1染色体特异分子标记的建立与应用. 湖北农业科学, 2015, 54(20): 4937-4940.
LIU X M, ZHANG Z Q, GONG W Y, TANG H T, WANG C G, CHENG D G, LIU C, LIU J J. Construction of 1Slchromosome specific molecular markers inand its application.,2015, 54(20): 4937-4940. (in Chinese)
[17] WANG S, YU Z, CAO M, SHEN X, LI N, LI X, MA W, WEI GERBER H, ZELLER F, HSAM S. Molecular mechanisms of HMW glutenin subunits from 1S(l) genome ofpositively affecting wheat breadmaking quality., 2013, 8(4): e58947.
[18] GARG M, KUMAR R, SINGH R P, TSUJIMOTO H. Development of ansubstitution line with improved bread-making quality., 2014, 60(2): 389-396.
[19] RAWAT N, NEELAM K, TIWARI V K, RANDHAWA G S, FRIEBE B, GILL B S, DHALIWAL H S. Development and molecular characterization of wheat-addition and substitution lines with high grain protein, iron and zinc contents., 2011, 54(11): 943-953.
[20] MENA M, ORELLANA J, LOPEZ-BRA A I, GARC A-OLMEDO F, DELIBES A. Biochemical and cytological characterization of wheat/addition and transfer lines carrying chromosome 4MV., 1989, 77(2): 184-188.
[21] CENCI A, D’OVIDIO R, TANZARELLA O A, CEOLONI C, PORCEDDU E. Identification of molecular markers linked to, angene conferring resistance to powdery mildew in wheat., 1999, 98(3): 448-454.
[22] SHENG H, SEE DR, MURRAY T D. Mapping resistance genes forin., 2014, 127(10): 2085-2093.
[23] KERBER E R, DYCK P L. Transfer to hexaploid wheat of linked genes for adult plant leaf rust and seedling stem rust resistance from an amphiploid of×., 1990, 33(4): 530-537.
[24] 吴金华, 吉万全, 李凤珍. 黑麦在小麦改良中的应用研究进展. 麦类作物学报, 2005, 25(1): 115-119.
WU J H, JI W Q, LI F Z. Advanees of study on the application ofin the improvement of wheat., 2005, 25(1): 115-119. (in Chinese)
[25] 刘成, 闫红飞, 宫文萍, 李光蓉, 刘大群, 杨足君. 小麦叶锈病新抗源筛选. 植物遗传资源学报, 2013, 14(5): 936-944.
LIU C, YAN H F, GONG W P, LI G R, LIU D Q, YANG Z J. Screening of new resistance sources of wheat leaf rust., 2013, 14(5): 936-944. (in Chinese)
[26] RAHMATOV M, ROUSE M N, NIRMALA J, DANILOVA T, FRIEBE B, STEFFENSON B J, JOHANSSON E. A new 2DS·2RL Robertsonian translocation transfers stem rust resistance geneinto wheat., 2016, 129: 1-10.
[27] 韩建东. 小麦秆锈菌小种Ug99入侵的基因防控及相关机理研究[D]. 沈阳: 沈阳农业大学, 2009.
HAN J D. Resistant gene control and related mechanism to the invasion of race Ug99 off.sp.[D]. Shenyang: Shenyang agriculture university, 2009. (in Chinese)
[28] AGHAEE-SARBARZEH M, FERRAHI M, SINGH S, SINGH H, FRIEBE B, GILL B S, DHALIWAL H S.-induced transfer of leaf and stripe rust-resistance genes fromandto bread wheat., 2002, 127(3): 377-382.
[29] ZAHARIEVA M, MONNEVEUX P, HENRY M, RIVOAL R, VALKOUN J, NACHIT M M. Evaluation of a collection of wild wheat relativeRoth and identification of potential sources for useful traits., 2001, 119(1): 33-38.
[30] HSAM S L K, LAPOCHKINA I F, ZELLER F J. Chromosomal location of genes for resistance to powdery mildew in common wheat (L. em Thell.) 8 genein a wheat-translocation line., 2003, 133(3): 367-370.
[31] KURAPARTHY V, CHHUNEJA P, DHALIWAL H S, KAUR S, BOWDEN R L, GILL B S. Characterization and mapping of cryptic alien introgression fromwith new leaf rust and stripe rust resistance genesandin wheat., 2007, 114(8): 1379-1389.
[32] ZELLER F J, KONG L, HARTL L, MOHLER V, HSAM S L K. Chromosomal location of genes for resistance to powdery mildew in common wheat (L. em Thell.) 7. genein line Pova., 2002, 123(2): 187-194.
[33] NEVO E, CHEN G. Drought and salt tolerances in wild relatives for wheat and barley improvement., 2010, 33(4): 670-685.
[34] HU C J, HOLE D J, ALBRECHTSEN R S. Barley chromosome location and expression of dwarf bunt resistance in wheat addition lines., 1996, 80(11): 1273-1276.
[35] MATTERA M G, ÁVILA C M, ATIENZA S G, CABRERA A. Cytological and molecular characterization of wheat-chromosome 7Hchintrogression lines., 2015, 203(1): 165-176.
[36] CASTILLO A, ATIENZA S G, MART N A C. Fertility of CMS wheat is restored by twoloci located on a recombined acrocentric chromosome., 2014, 65(22): 6667-6677.
[37] GILL B S, SHARMA H C, RAUPP W J. Evaluation ofspecies for resistance to wheat powdery mildew, wheat leaf rust, hessian fly, and greenbug., 1985, 69: 314-316.
[38] RIIAR A K, KAUR S, DHALIWAL H S, SINGH K, CHHUNEJA P. Introgression of a leaf rust resistance gene fromto bread wheat., 2012, 91(2): 155-161.
[39] FRIEBE B, SCHUBERT V, B L THNER W D, HAMMER K. C-banding pattern and polymorphism ofand chromosomal constitutions of the amphiploid-and six derived chromosome addition lines., 1992, 83(5): 589-596.
[40] 张超. 长穗偃麦草E组染色体特异PCR标记开发[D]. 扬州: 扬州大学, 2009.
ZHANG C. Development of E-chromosome specific PCR markers for[D]. Yangzhou: Yangzhou University, 2009. (in Chinese)
[41] 陈士强, 秦树文, 黄泽峰, 戴毅, 张璐璐, 高营营, 高勇, 陈建民. 基于SLAF-seq技术开发长穗偃麦草染色体特异分子标记. 作物学报, 2013, 39(4): 727-734.
CHEN S Q, QIN S W, HUANG Z F, DAI Y, ZHANG L L, GAO Y Y, GAO Y, CHEN J M. Development of specific molecular markers forchromosome using SLAF-seq technique., 2013, 39(4): 727-734. (in Chinese)
[42] 李天亚. 中国小(燕)麦秆锈病及Ug99遗传防控技术研究[D]. 沈阳: 沈阳农业大学, 2014.
LI T Y. Genetic control approaches to wheat (Oat) stem rusts and Ug99 in china[D]. Shenyang: Shenyang agriculture university, 2014. (in Chinese)
[43] 覃碧, 王海燕, 纪剑辉, 曹爱忠, 黄倬, 王秀娥. 基于EST的普通小麦近缘物种第二部分同源群染色体特异分子标记. 南京农业大学学报, 2011, 34(2): 8-12.
QIN B, WANG H Y, JI J H, CAO A Z, HUANG Z, WANG X E. EST-based specific markers for homoeologous group 2 chromosomes of wheat relative species., 2011, 34(2): 8-12. (in Chinese)
[44] KOEBNER R M D. Generation of PCR-based markers for the detection of rye chromatin in a wheat background., 1995, 90(5): 740-745.
[45] KOFLER R, BARTOŠ J, GONG L, STIFT G, SUCH NKOV P, ŠIMKOV H, BERENYI M, BURG K, DOLEŽEL J, LELLEY T. Development of microsatellite markers specific for the short arm of rye (L.) chromosome 1., 2008, 117(6): 915-926.
[46] 王春梅, 冯祎高, 庄丽芳, 曹亚萍, 亓增军, 别同德, 曹爱忠, 陈佩度. 普通小麦近缘物种黑麦1R、簇毛麦1V及鹅观草1Rk#1染色体特异分子标记的筛选. 作物学报, 2007, 33(11): 1741-1747.
WANG C M, FENG Y G, ZHUANG L F, CAO Y P, QI Z J, BIE T D, CAO A Z, CHEN P D. Screening of chromosome-specific markers for chromosome 1R of, 1V ofand 1Rk#1of, 2007, 33(11): 1741-1747. (in Chinese)
[47] 唐宗祥, 符书兰, 张怀琼, 晏本菊, 任正隆. 小麦SSR引物扩增黑麦及附加系6R染色体特异DNA片段的克隆. 麦类作物学报, 2008, 28(5): 728-732.
TANG Z X, FU S L, ZHANG H Q, YAN B J, REN Z L. Amplification of wheat SSR prime rs in Rye and cloning of 6R chromosome-specific DNA fragment., 2008, 28(5): 728-732. (in Chinese)
(责任编辑 李莉)
附表1 供试168份种质的小麦感锈病苗期反应型
Table S1 Wheat stem rust infection types of seedling stage of 168 germplasm

编号Accession No.材料Material侵染型Infection type编号Accession No.材料Material侵染型Infection type 中国春中国春T. aestivum CV. Chinese Spring (CS)4TA3601中国春-帝国黑麦1R附加系CS-Imperial rye 1R addition0 TA4072小麦-顶芒山羊草易位系wheat-Ae. comosa translocation3TA3603中国春-帝国黑麦2R附加系CS-Imperial rye 2R addition4 ALCD小麦品种AlcedoWheat variety Alcedo3TA3604中国春-帝国黑麦3R附加系CS-Imperial rye 3R addition4 TA3558ALCD-尾状山羊草2C#1附加系ALCD-Ae. caudata 2C#1 addition4TA3605中国春-帝国黑麦4R附加系CS-Imperial rye 4R addition4 TA3559ALCD-尾状山羊草5C#1附加系ALCD-Ae. caudata 5C#1 addition3-TA3606中国春-帝国黑麦5R附加系CS-Imperial rye 5R addition4 TA3560ALCD-尾状山羊草6C#1附加系ALCD-Ae. caudata 6C#1 addition3-TA3608中国春-帝国黑麦6R附加系CS-Imperial rye 6R addition1 TA3562ALCD-尾状山羊草7C#1附加系ALCD-Ae. caudata 7C#1 addition1+TA3609中国春-帝国黑麦7R附加系CS-Imperial rye 7R addition4 TA3561ALCD-尾状山羊草3C#1附加系ALCD-Ae. caudata3C#1 addition4TA3681中国春-中间偃麦草?Ai附加系CS- Th. intermedium?Ai addition0 TA3563ALCD-尾状山羊草4C#1附加系ALCD-Ae. caudata4C#1 addition4TA5566中国春-中间偃麦草?Ai附加系CS- Th. intermedium?Ai addition0 JIC-46小麦品种Hobbit 'sib'Wheat variety Hobbit 'sib'4 TA5567国春-中间偃麦草?Ai附加系CS- Th. intermedium?Ai addition4 JIC-10Hobbit 'sib'-顶芒山羊草2M附加系Hobbit 'sib'-Ae. comosa 2M addition4TA3664中国春-长穗偃麦草1E附加系CS-A. elongatum 1E addition4 JIC-11Hobbit 'sib'-顶芒山羊草2M(2D)代换系Hobbit 'sib'-Ae. comosa 2M(2D) substitution4TA3665中国春-长穗偃麦草2E附加系CS-A. elongatum 2E addition3 JIC-12Hobbit 'sib'-顶芒山羊草2M/2A易位系Hobbit 'sib'-Ae. comosa 2M/2A translocation4TA3666中国春-长穗偃麦草3E附加系CS-A. elongatum 3E addition4 JIC-17Hobbit 'sib'-顶芒山羊草2M/2D易位系Hobbit 'sib'-Ae.comosa 2M/2D translocation4TA3667中国春-长穗偃麦草4E附加系CS-A. elongatum 4E addition4 JIC-38Holdfast-二角山羊草3Sb附加系Holdfast -Ae. bicornis 3Sb addition4TA3704中国春-长穗偃麦草5E附加系CS-A. elongatum 5E addition3 JIC-40Holdfast-二角山羊草3Sb(3A )代换系Holdfast -Ae.bicornis 3Sb(3A) substitution4TA3668中国春-长穗偃麦草6E附加系CS-A. elongatum 6E addition4 JIC-41Holdfast-二角山羊草3Sb(3B)代换系Holdfast -Ae.bicornis 3Sb(3B) substitution4TA3706中国春-长穗偃麦草7E附加系CS-A. elongatum 7E addition3 JIC-42Holdfast-二角山羊草3Sb(3D)代换系Holdfast -Ae.bicornis 3Sb(3D) substitution4TA3698中国春-大麦2H附加系CS-Barley 2H addition4 JIC-44Holdfast-二角山羊草7Sb(7B)代换系Holdfast -Ae. bicornis 7Sb(7B)substitution4TA3699中国春-大麦3H附加系CS-Barley 3H addition4 TA7552中国春-粗穗披碱草1Ht附加系CS-E. trachycaulus 1Ht addition4TA3700中国春-大麦4H附加系CS-Barley 4H addition4 TA7557中国春-粗穗披碱草5Ht附加系CS-E. trachycaulus 5Ht addition4TA3701中国春-大麦5H附加系CS-Barley 5H addition4 TA7558中国春-粗穗披碱草6Ht附加系CS-E. trachycaulus 6Ht addition4TA3702中国春-大麦6H附加系CS-Barley 6H addition3 TA7559中国春-粗穗披碱草7Ht附加系CS-E. trachycaulus 7Ht addition4TA3697中国春-大麦7H单体附加系CS-Barley 2H monosomic addition4 TA7556中国春-粗穗披碱草1St附加系CS-E. trachycaulus 1St addition4TA7562中国春-小伞山羊草1U#1附加系CS-Ae. umbellulata1U#1addition4 续附表1 Continued table S1 编号Accession No.材料Material侵染型Infection type编号Accession No.材料Material侵染型Infection type TA5532中国春-粗穗披碱草T2HtS.5HtL附加系CS-E. trachycaulus T2HtS.5HtLaddition4TA7564中国春-小伞山羊草4U#1单体附加系CS-Ae.umbellulata 4U#1monosomicaddition4 TA7580中国春-粗穗披碱草5St单体附加系CS-E. trachycaulus 5St monosomic addition4TA7565中国春-小伞山羊草5U#1附加系CS-Ae. umbellulata 5U#1addition4 TA5072中国春-粗穗披碱草1HtS.1BL罗伯逊易位系CS-E. trachycaulus 1HtS.1BLRobertsonian translocation4TA7566中国春-小伞山羊草6U#1附加系CS-Ae. umbellulata 6U#1addition4 TA7543中国春-高大山羊草1Sl#3附加系CS- Ae. longissima 1Sl#3 addition4TA7567中国春-小伞山羊草7U#1附加系CS-Ae. umbellulata 7U#1addition4 TA7544中国春-高大山羊草2Sl#3附加系CS- Ae. longissima 2Sl#3 addition4TA7643中国春-大赖草2Lr#1附加系CS- L. racemosus 2Lr#1 addition4 TA7545中国春-高大山羊草3Sl#3附加系CS- Ae. longissima 3Sl#3 addition4TA7648中国春-大赖草7Lr#1附加系CS- L. racemosus7Lr#1 addition4 TA7546中国春-高大山羊草4Sl#3附加系CS- Ae. longissima 4Sl#3 addition4TA7649中国春-大赖草7Lr#1S端体附加系CS- L. racemosus 7Lr#1S monosomic addition4 TA7547中国春-高大山羊草5Sl#3附加系CS- Ae. longissima 5Sl#3 addition4CSDA1N中国春-单芒山羊草1N附加系CS- Ae. uniaristata 1N addition4 TA7548中国春-高大山羊草6Sl#3附加系CS- Ae. longissima 6Sl#3 addition1CSDA2N中国春-单芒山羊草2N附加系CS- Ae. uniaristata 2N addition3 TA7549中国春-高大山羊草7Sl#3单体附加系CS- Ae. longissima 7Sl#3 addition4CSDA3N中国春-单芒山羊草3N附加系CS- Ae. uniaristata 3N addition4 TA3573中国春-高大山羊草1Sl#2附加系CS- Ae. longissima 1Sl#2 addition4CSDA4N中国春-单芒山羊草4N附加系CS- Ae. uniaristata 4N addition4 TA3575中国春-高大山羊草3Sl#2附加系CS- Ae. longissima 3Sl#2 addition46N中国春-单芒山羊草6N附加系CS- Ae. uniaristata 6N addition0 TA3577中国春-高大山羊草5Sl#2附加系CS- Ae. longissima 5Sl#2 addition47N中国春-单芒山羊草7N附加系CS- Ae. uniaristata 7N addition4 TA 6506中国春-高大山羊草2Sl#2(2D)代换系CS- Ae. longissima 2Sl#2(2D) substitution4TA7594中国春-易变山羊草1Sv#1附加系CS-Ae. variabilis 1Sv#1 addition4 TA 6512中国春-高大山羊草4Sl#2(4D)代换系CS- Ae.longissima 4Sl#2(4D)substitution4TA7595中国春-易变山羊草2Sv#1附加系CS-Ae. variabilis 2Sv#1 addition4 TA6516中国春-高大山羊草6Sl#2(6B)代换系CS- Ae. longissima 6Sl#2(6B)substitution1+TA7596中国春-易变山羊草3Sv#1附加系CS-Ae. variabilis 3Sv#1 addition4 TA3580中国春-希尔斯山羊草1Ss#1附加系CS-Ae. searsii 1Ss#1 addition4TA7597中国春-易变山羊草4Sv#1附加系CS-Ae. variabilis 4Sv#1 addition4 TA3581中国春-希尔斯山羊草2Ss#1附加系CS-Ae. searsii 2Ss#1 addition4TA7598中国春-易变山羊草5Sv#1附加系CS-Ae. variabilis 5Sv#1 addition4 TA3582中国春-希尔斯山羊草3Ss#1附加系CS-Ae. searsii 3Ss#1 addition1-TA7599中国春-易变山羊草6SvS端体附加系CS-Ae. variabilis 6SvS telosomic addition0 TA3583中国春-希尔斯山羊草4Ss#1附加系CS-Ae. searsii 4Ss#1 addition4TA7600中国春-易变山羊草7Sv#1附加系CS-Ae. variabilis 7Sv#1 addition4 TA3584中国春-希尔斯山羊草5Ss#1附加系CS-Ae. searsii 5Ss#1 addition3+TA7614中国春-易变山羊草1Uv#1附加系CS-Ae. variabilis 1Uv#1 addition4 TA3585中国春-希尔斯山羊草6Ss#1附加系CS-Ae. searsii 6Ss#1 addition4TA7615中国春-易变山羊草2Uv#1附加系CS-Ae. variabilis 2Uv#1 addition4 TA3586中国春-希尔斯山羊草7Ss#1附加系CS-Ae. searsii 7Ss#1 addition4TA7616中国春-易变山羊草3Uv#1附加系CS-Ae. variabilis 3Uv#1 addition4 续附表1 Continued table S1 编号Accession No.材料Material侵染型Infection type编号Accession No.材料Material侵染型Infection type TA7718中国春-沙融山羊草4Ssh#8附加系CS-Ae. sharonensis 4Ssh#8 addition4TA7617中国春-易变山羊草4Uv#1附加系CS-Ae. variabilis4Uv#1 addition4 JIC-32中国春-沙融山羊草2Ssh附加系CS-Ae. sharonensis 2Ssh addition4TA7618中国春-易变山羊草5Uv#1附加系CS-Ae. variabilis 5Uv#1 addition4 JIC-33中国春-沙融山羊草4Ssh附加系CS-Ae. sharonensis 4Ssh addition4TA7619中国春-易变山羊草6Uv1附加系CS-Ae. variabilis6Uv#1 addition4 JIC-36中国春-沙融山羊草6Ssh附加系CS-Ae. sharonensis 6Ssh addition4TA7705中国春-纤毛披碱草2Sc附加系CS-El.ciliaris 2Sc addition4 JIC-37中国春-沙融山羊草7Ssh附加系CS-Ae. sharonensis 7Ssh addition4TA7706中国春-纤毛披碱草3Sc附加系CS-El.ciliaris 3Sc addition4 TA7689中国春-拟斯卑尔脱山羊草1S#3附加系CS- Ae. speltoides 1S#3 addition4TA7707中国春-纤毛披碱草7Sc附加系CS-El.ciliaris 7Sc addition4 TA7690中国春-拟斯卑尔脱山羊草2S#3附加系CS- Ae. speltoides 2S#3 addition1+TA7584中国春-纤毛披碱草1Yc附加系CS-El.ciliaris 1Yc addition4 TA7691中国春-拟斯卑尔脱山羊草3S#3附加系CS- Ae. speltoides 3S#3 addition4TA7708中国春-纤毛披碱草5Yc附加系CS-El.ciliaris 5Yc addition4 TA7692中国春-拟斯卑尔脱山羊草4S#3附加系CS- Ae. speltoides 4S#3 addition4TA7709中国春-纤毛披碱草7Yc附加系CS-El.ciliaris 7Yc addition4 TA7693中国春-拟斯卑尔脱山羊草5S#3附加系CS- Ae. speltoides 5S#3 addition3TA7684中国春-筑紫披碱草1Ets#1附加系CS-E.tsukushienis 1Ets#1 addition4 TA7694中国春-拟斯卑尔脱山羊草6S#3附加系CS- Ae. speltoides6S#3 addition4TA7685中国春-筑紫披碱草3Ets#1附加系CS- E. tsukushienis 3Ets#1 addition4 TA7695中国春-拟斯卑尔脱山羊草7S#3附加系CS- Ae. speltoides 7S#3 addition4TA7687中国春-筑紫披碱草5Ets#1单体附加系CS- E. tsukushienis 5Ets#1 monosomic addition4 TA7655中国春-卵穗山羊草1Mg#1附加系CS- Ae. geniculata 1Mg#1 addition4TA5660中国春-筑紫披碱草T1AL.1AS-1Ets#1S易位系CS- E. tsukushienis T1AL.1AS-1Ets#1S translocation4 TA7656中国春-卵穗山羊草2Mg#1附加系CS- Ae. geniculata 2Mg#1 addition4TA5661中国春-筑紫披碱草TiWL-1Ets#1S-WS易位系CS-E. tsukushienis TiWL-1Ets#1S-WS translocation4 TA7657中国春-卵穗山羊草3Mg#1附加系CS- Ae. geniculata 3Mg#1 addition4TA6664中国春-提莫菲维2G(2B)代换系CS-T. timopheevii 2G(2B)substitution3 TA7658中国春-卵穗山羊草4Mg#1附加系CS- Ae. geniculata 4Mg#1 addition4TA6666中国春-提莫菲维4G(4B)代换系CS-T. timopheevii 4G(4B)substitution3 TA7659中国春-卵穗山羊草5Mg#1附加系CS- Ae. geniculata 5Mg#1 addition3-TA6667中国春-提莫菲维5G(5B)代换系CS-T. timopheevii 5G(5B)substitution4 TA7660中国春-卵穗山羊草6Mg#1附加系CS- Ae. geniculata 6Mg#1 addition4JIC-2中国春-顶芒山羊草2/7M附加系CS- Ae. comosa 2/7M addition4 TA7661中国春-卵穗山羊草7Mg#1附加系CS- Ae. geniculata 7Mg#1 addition0JIC-3中国春-顶芒山羊草 2M附加系CS- Ae. comosa 2M addition3 TA7662中国春-卵穗山羊草1Ug#1附加系CS- Ae. geniculate 1Ug#1 addition3JIC-4中国春-顶芒山羊草3M附加系CS- Ae. comosa 3M addition4 TA7663中国春-卵穗山羊草2Ug#1附加系CS- Ae. geniculata 2Ug #1 addition3+JIC-5中国春-顶芒山羊草4M附加系CS- Ae. comosa 4M addition4 TA7688中国春-卵穗山羊草3Ug#1单体附加系CS- Ae. geniculata 3Ug #1 monosomic addition4JIC-6中国春-顶芒山羊草5M附加系CS- Ae. comosa 5M addition3 续附表1 Continued table S1 编号Accession No.材料Material侵染型Infection type编号Accession No.材料Material侵染型Infection type TA7664中国春-卵穗山羊草4Ug#1附加系CS- Ae. geniculate 4Ug#1 addition4JIC-7中国春-顶芒山羊草6M附加系CS- Ae. comosa 6M addition4 TA7665中国春-卵穗山羊草5Ug#1附加系CS- Ae. geniculata 5Ug#1 addition4JIC-8中国春-顶芒山羊草7M附加系CS- Ae. comosa 7M addition3 TA7666中国春-卵穗山羊草6Ug#1附加系CS- Ae. geniculata 6Ug #1 addition4JIC-21中国春-无芒山羊草2T?附加系CS- Ae. mutica 2T? addition4 TA6647中国春-卵穗山羊草7Mg#1(7B)代换系CS- Ae. geniculata 7Mg#1(7B) addition0JIC-25中国春-无芒山羊草7T附加系CS- Ae. mutica 7T addition4 TA6648中国春-卵穗山羊草7Mg#1(7D)代换系CS- Ae. geniculata 7Mg#1(7D) addition1JIC-27中国春-无芒山羊草7T?附加系CS- Ae. mutica 7T?addition3 TA7725中国春-两芒山羊草1Ubi#1附加系CS-Ae. biuncialis 1Ubi#1 addition4JIC-29中国春-无芒山羊草2T?附加系CS- Ae. mutica 2T? addition4 TA7726中国春-两芒山羊草2Ubi#1附加系CS-Ae. biuncialis 2Ubi#1 addition4XX029中国春-智利大麦1Hch+1HchS附加系CS-Chile barley 1Hch+1HchS addition4 TA7729中国春-两芒山羊草5Ubi#1附加系CS-Ae. biuncialis 5Ubi#1 addition4TA7588中国春-智利大麦4Hch附加系CS-Chile barley 4Hch addition4 TA7733中国春-两芒山羊草2Mbi#1附加系CS-Ae. biuncialis 2Mbi#1 addition4TA7589中国春-智利大麦5Hch附加系CS-Chile barley 5Hch addition4 TA7734中国春-两芒山羊草3Mbi#1附加系CS-Ae. biuncialis 3Mbi#1 addition3+TA7590中国春-智利大麦6Hch附加系CS-Chile barley 6Hch addition0 TA7735中国春-两芒山羊草4Mbi#1单体附加系CS-Ae. biuncialis 4Mbi#1 monosomic addition4TA7591中国春-智利大麦7Hch附加系CS-Chile barley 7Hch addition4
?表示外源染色体同源群归属未鉴定或不确定
?indicates homologous group of the alien chromosomes have not been identified or determined
“0”免疫;“;”近免疫;“1”高抗;“2”中抗;“3”中感;“4”高感;“+”比预想的孢子堆大;“-”比预想的孢子堆小
“0” Immune; “;” Nearly immune; “1” Highly resistance; “2” Moderate resistance; “3” Medium susceptible; “4” Highly susceptible; “+” Uredinia are larger than expected; “-” Uredinia are smaller then expected
New Resistance Sources of Wheat Stem Rust and Molecular Markers Specific for Relative Chromosomes that the Resistance Genes are Located on
HAN Ran1, LI Tianya2, GONG Wenping1, LI Haosheng1, SONG Jianmin1, LIU Aifeng1, CAO Xinyou1, CHENG Dungong1, ZHAO Zhendong1, LIU Cheng1, LIU Jianjun1
(1Crop Research Institute, Shandong Academy of Agricultural Sciences/Key Laboratory of Wheat Biology and Genetic Improvement in the North Yellow & Huai River Valley, Ministry of Agriculture/National Engineering Laboratory for Wheat & Maize, Ji’nan 250100;2College of Plant protection, Shenyang Agricultural University, Shenyang 110866)
【】Wheat stem rust, caused byPers. f. sp.Eriks. and E. Henn () is one of the most potentially destructive wheat diseases, seriously threatening world wheat production. The emergence of new races Ug99 of stem rust caused the global wheat to be under the threat.Exploring new resistant source of wheat stem rust is one of the effective measures against Ug99. In order to explore stem rust new resistant source, the mixed dominant stem rust physiological races in China were inoculated to 165 wheat-alien species chromosome lines at the seeding stages. 【】All of the 165 wheat-alien species chromosome lines, 3 hexaploid wheat and the susceptible control Little Club (LC), were sown in the 10 cm diameter clay pots. When the primary leaves were fully expanded, they were inoculated using talcurediospore powder mixture of the common races 34MKGQM and 21C3CTHSM. The Infection Types (ITs) of the material tested was recorded according to the standard ‘0-4’. Meanwhile, genomic DNA was extracted from stem rust immune, nearly immune, or highly resistant additions/substitutions and their corresponding whole set of chromosome lines and Chinese Spring (CS). PCR was performed on these materials by screening 101 pairs of PLUG primer. PCR products were firstly digested by DNA restricted enzymesI andeⅢ, and then were detected through 2.0% agarose gel electrophoresis to screen and establish chromosome-specific molecular marker where the stem rust resistance gene was located on.【】Among the 165 wheat-alien species chromosome lines, CS-7Mg#1 addition, CS-7Mg#1(7A) and 7Mg#1 (7B) substitutions, CS-Imperial rye 1R addition, CS-?Ai addition (? indicates homoeologous group of the alien chromosomes in wheat background was not identified), CS-6N addition, CS-6SvS telosomic addition, CS-Chile barley 6Hchaddition are immune or nearly immune to stem rust. ALCD-7C#1 addition, CS-7Mg#1(7D) substitution, CS-Imperial rye 6R addition, CS-6Sl#3 addition, CS-6Sl#2(6B) substitution, CS-3Ss#1 addition, CS-2S#3 addition are highly resistant to stem rust. Comparative analysis of chromosomal locations of stem rust resistant genes indicates that chromosomes 6Sl#2 and 6Sl#3 of, chromosome 6R of Imperial rye, chromosome 6Hchof Chile barley, chromosome 7Mg#1 of, chromosome7C ofand ?Ai ofmay harbor new stem rust resistance gene (s). Molecular marker screening, localization, specificity verification showed that 8 new molecular markers have been developed. Among them, 5 (TNAC1715, TNAC1718, TNAC1737, TNAC1739 and TNAC1753) and 3 (TNAC1740, TNAC1751, and TNAC1756) have been assigned to chromosomes 6R and 6Sl, respectively. 【】Eight materials which probably contain new gene(s) against stem rust were obtained, and eight new chromosome specific molecular markers for stem rust resistance gene(s) were established.
wheat alien species; chromosome lines; stem rust; molecular marker
2017-10-12;
2017-11-29
国家重点研发计划(2017YFD0100600)、山东省自然科学基金(ZR2017MC004)、山东农科院青年拔尖人才计划(1-18-024)、现代农业产业技术体系(CARS-03)
韩冉,E-mail:hr022cn@aliyun.com;李天亚,E-mail:litianya11@163.com。韩冉与李天亚为同等贡献作者。
刘成,E-mail:lch6688407@163.com。通信作者刘建军,E-mail:ljjsaas@163.com
