过量表达RdreB1BI对草莓果实品质及相关基因的影响
2018-04-18阎依超万春雁古咸彬郭成宝陈月红高志红
阎依超,万春雁,古咸彬,郭成宝,陈月红,高志红
过量表达对草莓果实品质及相关基因的影响
阎依超1,万春雁2,古咸彬1,郭成宝3,陈月红3,高志红1
(1南京农业大学,南京 210095;2江苏丘陵地区镇江农业科学研究所,江苏镇江 212400;3南京市农业科学研究所,南京 210000)
【】研究外源基因转入对‘红颊’草莓果实品质及相关基因表达的影响,揭示在草莓果实品质调控中的作用及分子机理。【】以5个转株系及非转基因‘红颊’草莓全红期果实为材料,测定果实纵横径、单果重、可溶性糖、可溶性蛋白、抗坏血酸等风味物质及花青苷、总黄酮、总酚等着色物质的含量。应用BLASTn、GENEFINDER和PlantCARE等生物信息学方法分析外源基因和7个次生代谢产物合成途径相关基因(、、、、、、和)的结构,并预测基因启动子作用元件。采用qRT-PCR定量法检测相关基因表达量,应用7300 system软件和2-△△Ct法分析数据。对生理生化及分子数据进行方差及相关性分析,综合讨论的转入对‘红颊’草莓果实品质及相关基因表达的影响。【】转基因‘红颊’草莓株系与野生型果实单果重的范围为11.75—15.42 g,纵径和横径的范围分别为35.12—40.42 mm及28.73—32.6 mm,仅株系8果实纵径显著大于株系7,其余指标间差异不显著。其中转基因株系1和7的花青苷含量显著高于野生型;转基因株系1、7及8总黄酮含量显著高于野生型;各转基因株系的总酚含量均显著高于野生型。转基因株系1、7和8果实的可溶性糖含量显著高于野生型(21.70 mg·g-1FW),分别为野生型的2.87、3.39和3.35倍。可溶性固形物含量与可溶性糖含量呈正相关(=0.811*),但样品果实的可溶性固形物含量间不存在显著性差异。转基因株系草莓成熟果实果肉中氨基酸含量为0.2580—0.3950 g/100 g FW,野生型果实的氨基酸含量为0.5151 g/100 g FW,显著高于各转基因株系草莓果实;转基因株系1和7的可滴定酸含量显著高于野生型;转基因株系1果实的抗坏血酸含量为168.35 mg/100 g FW,显著高于野生型(92.50 mg/100 g FW)。转基因株系9及10果实的可溶性蛋白含量分别为25.97和25.86 mg·g-1FW,显著高于野生型(22.93 mg·g-1FW)。(cinnamoyl-CoA reductase 2-like)和(myb-related protein 306)在各转基因株系中表达量显著高于野生型。分析发现差异表达基因启动子区域包含多种高等植物顺势调控元件,主要有对真核生物起增强基因转录效率的CAAT-box和核心启动子元件TATA-box。同时还包含G-Box、G-box、MBS、ARE、5UTR Py-rich stretch等能影响各基因对光的响应、在苯丙烷代谢途径中起调节作用的顺式作用元件。【】调控相关基因参与转化体果实发育和成熟,提高光的有效性,活化黄酮类生物合成通路关键基因,差异基因中均包含大量光诱导响应元件,及的表达促进了总黄酮、酚类物质及花青苷等次生代谢物的合成。转入使草莓果实的多项营养成分和着色物质含量显著增加,改善了草莓的果实品质。
草莓;;过量表达;果实品质;启动子
0 引言
【研究意义】草莓(Duch)为蔷薇科(Rosaceae)草莓属()多年生草本植物,分布范围较广,果实营养价值和经济价值较高。在温度较低的冬春季节,低温是制约其产量和品质的主要因素,草莓能否安全越冬及培育耐寒品种是生产上急需解决的问题[1]。转拟南芥的研究中,成功培育出具抗寒特性的转基因株系[2]。但耐寒品种除了要增强其抗寒性外,还需要保持果实原有的品质。果实色泽,是外观品质重要指标之一,且着色程度与果实风味品质密切相关。影响着色的物质主要有花青苷、黄酮类化合物和酚类物质,色素的积累是色泽形成的基础。其中花青苷的积累水平能够评价果实品质及成熟度,还能提供有益健康的元素,具有营养药理价值[3]。【前人研究进展】CBF/DREB转录因子属于AP2/EREBP转录因子家族,通常认为其能识别并结合顺式作用元件,参与对低温、高盐和干旱等的分子应答。近年来也有研究指出,番茄中的过量表达能够诱导果实成熟相关基因的表达,如、、等果实软化相关基因、和等色素合成相关基因,并且调控果实发育和植物生长代谢[4]。将HB柚中的在番茄()中超表达后发现,35S-line5和35S-line19果实大小及单果重显著小于野生型,且转基因株系果实中有机酸、糖类和脂肪酸含量显著高于野生型番茄的含量,表明在果实成熟过程中起调控初生代谢物含量的重要作用[5]。研究香蕉()后发现,、、及在香蕉果实成熟过程中起调控作用,在乙烯诱导成熟香蕉中、、及的表达量都随着乙烯量的增加、果实成熟而不断升高[6]。甜瓜中的能与识别并结合GCCGAC序列,意味着DREB转录因子能够通过调节乙烯生物合成来调控乙烯形成[7]。将油椰子()中转入番茄中发现,果实中该基因的表达与乙烯、脱落酸合成及果实成熟相关[8]。【本研究切入点】大量研究表明,DREB转录因子能够提高植物对非生物逆境的抗性,但其转入后对转基因草莓果实的影响鲜有研究。【拟解决的关键问题】本研究以草莓品种‘红颊’及其转株系为试材,对全红期的成熟果实中酚类物质、总黄酮、花青苷含量等着色物质及可溶性固形物、可溶性糖、维生素C含量、可滴定酸等风味物质进行分析,并对转录水平下差异基因的表达及差异基因的启动子进行初步研究,为调控草莓果实品质提供理论基础。
1 材料与方法
试验于2017年1—4月在南京农业大学果树生物技术实验室进行。
1.1 试验材料
试验材料为通过潮霉素抗性筛选及分子检测的转水稻草莓株系[9]及‘红颊’草莓。采收全红期(转红着色面积达到100%)转株系及‘红颊’草莓果实各10个,去除果皮及种子,取65 g混合均匀的皮下2 mm厚果肉,根据各试验用量分装后液氮速冻,置于-80℃冰箱中保存备用(图1)。

图1 野生型及转RdreB1BI‘红颊’草莓全红期果实
1.2 果实大小及单果重的测定
随机选取10个全红期草莓果实,用天平称单果重,用手持式游标卡尺测出纵、横径,并记录数据。
1.3 花青苷含量的测定
参照Wrolstadde[10]的方法,用pH差示法测定花青苷含量,取5 g速冻样品,重复取样3次,分别加入10 mL 1% HCl研磨,冲洗研钵并定容至25 mL,12 000 r/min离心20 min,取上清至25 mL容量瓶,浸提至无色过滤后取滤液,定容至25 mL避光待测。分别用缓冲溶液和一水柠檬酸及十二水合磷酸氢二钠缓冲溶液混匀反应完全后,在510 nm波长下测定光密度值,重复测定3次。
1.4 氨基酸含量的测定
参照杨远帆等[11]的方法并稍作修改,用茚三酮法测定氨基酸含量,取1 g速冻样品,重复取样3次,分别加入5 mL 80%乙醇研磨,80℃水浴浸提30 min,冷却后10 000 r/min离心30 min,沉淀加入80%乙醇重复上述操作,提取液用80%乙醇定容至25 mL。取1 mL于10 mL刻度试管中,加2 mL含茚三酮的柠檬酸-柠檬酸钠缓冲液及7 mL蒸馏水混匀,80℃水浴30 min,冷却后用蒸馏水定容至15 mL,以蒸馏水为对照,在570 nm波长下测定光密度值。
1.5 总酚含量的测定
参考DJERIDANE等[12]的方法并稍作修改,取1.5 g速冻样品,重复取样3次,分别加入10 mL 80%乙醇及1 mL 10%三氯酸研磨,匀浆转入15 mL容量瓶,用80%乙醇定容静置30 min。过滤后吸取1 mL滤液,加5 mL蒸馏水试剂,1 mL FC显色剂及3 mL 7.5%碳酸钠溶液,混匀,常温静置2 h后,以蒸馏水为对照,在765 nm波长下测定光密度值,以没食子酸作标准曲线,计算其含量,单位为mg∙g-1。
1.6 总黄酮含量的测定
参照药典[13]的方法并改进,取2 g速冻样品,重复取样3次,分别加入16 mL 95%乙醇研磨,浸提后过滤,取1 mL滤液置10 mL试管,用70%乙醇补至5 mL,然后分别加入5%亚硝酸钠溶液0.3 mL,混匀放置6 min,加入10%硝酸铝溶液0.3 mL,混匀放置6 min,再加4% NaOH溶液2 mL,混匀放置10 min后,以蒸馏水为对照,在510 nm波长下测定光密度值。以芦丁标准品作标准曲线,计算其含量,单位为mg∙g-1。
1.7 可溶性糖、可溶性蛋白及可溶性固形物含量的测定
蒽酮比色法测定可溶性糖含量[14],考马斯亮蓝G-250法测定可溶性蛋白质含量[14],阿贝折射仪测定果实可溶性固形物含量。
1.8 总酸及抗坏血酸含量的测定
采用2,6-二氯酚靛酚滴定法测定抗坏血酸含量,采用NaOH滴定法测定总酸含量[14]。
1.9 转录水平差异表达基因分析
1.9.1 总RNA的提取及cDNA的合成 取全红期转株系及‘红颊’草莓果实,采用改良CTAB法[14]提取草莓果实RNA。cDNA合成根据qPCR RT试剂盒(TaKaRa)说明书进行。将合成的cDNA用TE缓冲液稀释到统一浓度后,保存至-20℃冰箱备用。
1.9.2 转录水平差异基因实时荧光定量PCR分析 在对转基因株系果实及野生型‘红颊’草莓果实进行转录组数据分析后,得到6个差异表达基因[9]。以转基因草莓株系及未转基因草莓果实cDNA为模板,以草莓保守作为内参基因[15],为目的基因,转录水平差异基因为待测基因,分别设计引物。外源及内参基因的荧光定量引物见表1。
采用荧光定量PCR法测定基因表达量,PCR反应体系为:cDNA模板(50 ng∙µL-1)1 μL,SYBR® Premix Ex Taq™(TaKaRa)10 μL,上、下游引物(10 mmol∙µL-1)各0.2 μL,RNase Free ddH2O加至20 μL。每个样品设3次重复。PCR反应程序为:94℃预变性3 min;94℃变性30 s,60℃退火20 s,72℃延伸40 s,40个循环。反应结束后,在60℃进行荧光信号采集,绘制溶解曲线。数据分析采用7300 system软件和2-△△Ct方法。
1.10 数据处理
采用Microsoft Excel 2016计算试验数据标准曲线及平均值,并用SPSS 22.0统计软件,在<0.05水平及<0.01水平对试验结果进行方差分析,Tukey HSD多重比较和相关性分析,所有试验设3次重复。
1.11 启动子序列分析
根据已知的差异表达基因,在草莓数据库中通过BLAST找到该基因ATG前约2 000 bp左右的片段,再利用GENEFINDER、PlantCARE等网站对序列进行预测分析,预测该片段是否为启动子区域,以及启动子可能包含的顺式作用元件。

表1 荧光定量引物设计
2 结果
2.1 RdreB1BI表达对果实大小的影响
如表2所示,各转基因‘红颊’草莓株系与野生型果实单果重的范围为11.75—15.42 g,纵径和横径的范围分别为35.12—40.42 mm及28.73—32.6 mm,仅株系8果实纵经显著大于株系7,其余指标间差异不显著。

表2 野生型与转基因各株系草莓果实大小指标
同列中不同字母表示处理间差异显著(<0.05)。下同
Different letters in the same column are significantly different at<0.05. The same as below
2.2 RdreB1BI表达对着色物质的积累
如表3所示,株系1及7全红期果实果肉的花青苷含量分别为100.74、104.09 µg∙g-1,显著高于野生型;株系1、7及8总黄酮含量分别为788.30、921.97和1 040.22 µg∙g-1,显著高于野生型;各株系的总酚含量显著或极显著高于野生型,分别为10.87、8.66、9.17、5.26及5.38 mg∙g-1(<0.05及<0.01)。
随着果实的生长发育,在全红期时,花青苷累积至一定程度后,其合成速率下降,并且底物开始转化合成酚类物质和总黄酮,而总黄酮同时也在酶的催化下作用,不断转化形成花青苷。较高的酚类物质及总黄酮含量,能够延缓果实的衰老。
2.3 RdreB1BI表达对风味物质的积累
如表4所示,各转基因株系草莓成熟果实果肉中可溶性固形物、可溶性糖含量的范围分别为7.53%—11.53%和17.51—73.6 mg∙g-1FW,转基因株系1和7的可溶性固形物含量显著高于株系10,转基因株系1、7及8可溶性糖含量为62.35、73.6和72.8 mg∙g-1FW,显著高于野生型的21.70 mg∙g-1FW,为野生型的2.87、3.39和3.35倍,其中转基因株系7可溶性糖的含量最高(<0.05)。可溶性固形物含量与可溶性糖含量之间的相关系数为0.811,且其在双侧显著性0.05上显著,因此可溶性固形物含量与可溶性糖含量之间存在显著正相关性。

表3 野生型和转基因株系草莓果实中色素含量
同列中不同大写字母表示处理间差异极显著(<0.01)
Different capital letters in the same column are extremely significant difference at<0.01
各转基因株系草莓成熟果实果肉的氨基酸含量为0.2580—0.3950 g/100 g FW,野生型果实的氨基酸含量为0.5151 g/100 g FW,显著高于各转基因株系草莓果实,分别为其1.3、1.43、1.33、1.82和2倍;样品果肉的可滴定酸及抗坏血酸含量分别在0.7595%—1.1333%和92.50—168.35 mg/100 g FW,转基因株系1、7的可滴定酸含量为1.1333%和1.0664%,显著高于野生型的0.8147%;转基因株系1的抗坏血酸含量为168.35 mg/100 g FW,显著高于野生型的92.50 mg/100 g FW,且各转基因株系果实的抗坏血酸含量分别为野生型的1.82、1.26、1.23、1.21和1.35倍,其中转基因株系1的可滴定酸及抗坏血酸含量最高(<0.05)。
进一步对供试样品中可溶性蛋白含量进行检测,分析后发现各转基因株系草莓成熟果实果肉 中可溶性蛋白含量在转基因株系9及10果实的含量分别为25.97和25.86 mg∙g-1FW,显著高于野生型(<0.05)。

表4 野生型和转基因株系草莓果实中营养成分含量
2.4 RdreB1BI及转录差异基因表达分析
利用qRT-PCR技术对及转录差异基因在全红期果实中的表达情况进行分析(图2)。结果表明,与野生型相比,在各株系转基因草莓果实中的表达量显著高于野生型,分别为野生型的263.9、233.3、386.9、153.3和58.53倍(图2-Ⅰ)。
研究发现,外源的转入,调控了一系列与成熟、代谢、色素合成、花芽分化等相关的基因表达。为进一步分析转入‘红颊’草莓后,对其果实发育的调控作用,对转录组分析差异表达基因进行分析。(cinnamoyl-CoA reductase 2-like)在各转基因株系中表达量分别为野生型的8.798、3.305、5.071、1.557和2.522倍,株系1及8与野生型存在显著差异(图2-Ⅱ)。(myb- related protein 306)在株系1、8、9及10的表达量显著高于野生型,表达量分别为野生型的1.674、1.862、4.279、1.735倍(图2-Ⅲ)。转基因株系8的全红期果实中(cinnamate-4- hydroxylase)表达为野生型的2.127倍,差异显著(图2-Ⅳ)。(dihydroflavonol 4-reductase)在野生型果实中的表达显著高于株系1、9及10(图2-Ⅴ);(WD repeat-containing protein LWD1-like)、(naringenin, 2-oxoglutarate 3-dioxygenase)和(probable glutathione S-transferase)在野生型果实中的表达显著高于各株系(图2-Ⅵ、Ⅶ、Ⅷ)。
2.5 转录差异表达基因启动子初步分析
根据二倍体草莓参考基因组数据库,预测差异表达基因的启动子序列,运用PlantCARE(http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)对差异表达基因启动子区域调控元件进行分析。如表5所示,发现其启动子区域包含多种高等植物顺势调控元件,主要有对真核生物起增强基因转录效率的CAAT-box和核心启动子元件TATA-box。同时还包含在基因转录过程中起重要调节作用的顺式作用元件G-Box、G-box、MBS、ARE、5UTR Py-rich stretch,影响各基因对光的响应,在苯丙烷代谢途径中起调节作用。
运用Plant CARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)对起始密码子上游长度为1 500 bp的启动子区域进行分析,结果表明,除含有核心启动子元件CAAT-box和TATA-box元件外,还包含3个ARE抗氧化反应元件、1个AT-rich element ATBP-1结合相关元件、1个CAT-box分生组织特异性元件、1个CGTCA-motif茉莉酸响应有关的顺式调节元件、2个GARE-motif 赤霉素响应元件、1个GC-motif厌氧反应顺式作用元件、3个MBS干旱诱导响应元件,MYB结合位点、1个Skn-1_motif胚乳表达所需元件、1个TC-rich repeats防御与胁迫响应元件、1个TGA-element生长素响应元件、1个TGACG-motif茉莉酸甲酯响应及大量光响应元件等多种顺式作用元件。对启动子序列进行分析后发现,其包含大量与相同的元件外,还存在1个RY-element种子特异性表达元件、1个5UTR Py-rich stretch高水平转录调控因子及Box 4、Box I、I-box、as-2-box等保守光调控及光感应顺式作用元件(表5)。
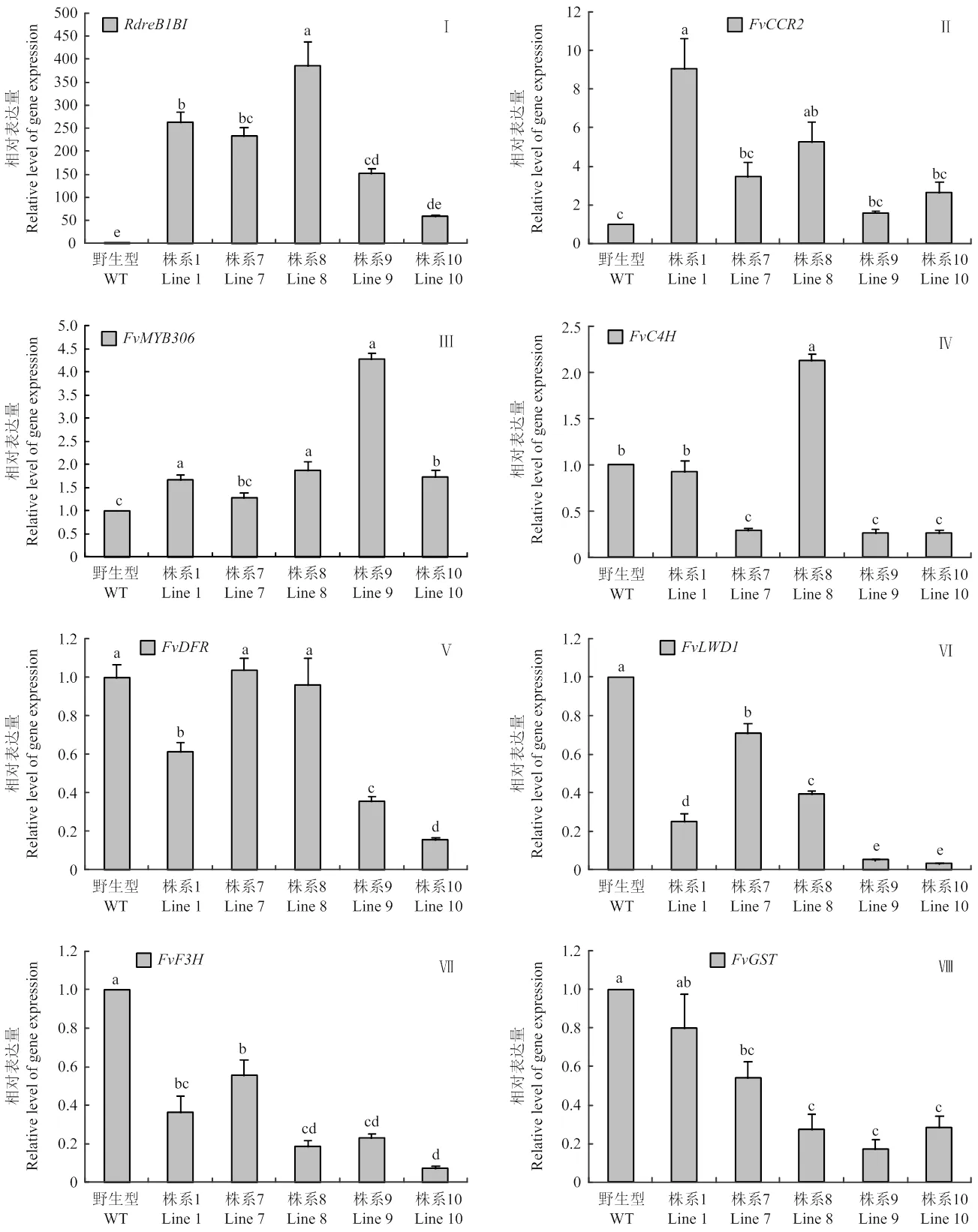
图2 RdreB1BI及转录差异基因的相对表达量
3 讨论
极低的乙烯释放量能够催化草莓果实中花青苷的合成,增加总糖含量,并调控果实成熟进程中风味、质地、色泽等果实品质[16-17]。已有研究表明,DREB转录因子能够调节乙烯生物合成来调控乙烯形成。本研究结果表明,表达量和总黄酮、总酚、花青苷、可溶性固形物及可溶性糖含量呈正相关,说明在转化体中的表达能够调控果实品质,与前人研究结果一致。
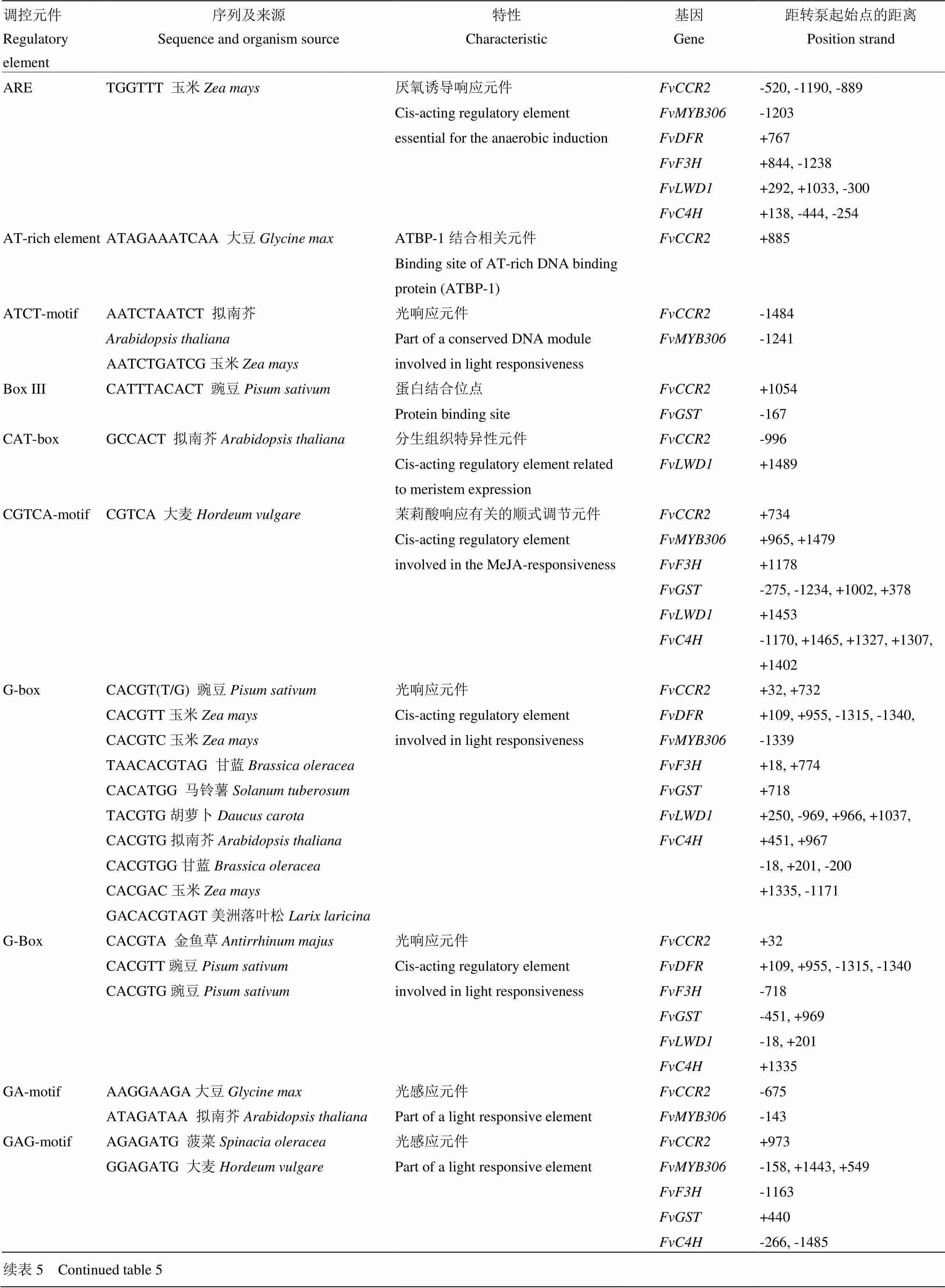
表5 差异表达基因启动子区的顺式作用元件序列、来源、特性及分布
的表达可能促进植物体内酚类物质和木质素的合成,增强植物抵御生物与非生物胁迫的能力[18-20]。转基因杨树中下调能够通过调控可发酵糖的含量来促进木质生长[21]。高粱中比更能激活对香豆酰-辅酶A产生木质素以抵御病菌胁迫,提高植株对生物逆境的抗性[22]。玉米突变体中木质素单体与阿魏酸结合形成木质素,并提供生物燃料底物[23]。在拟南芥[24]、三叶草[25]、洋葱[26]、苹果[27]等植物的研究中发现,R2R3-MYB蛋白中的Sg6亚家族能够激活花青苷结构基因,调控合成并积累花青苷[28-29]。转大豆烟草中的类黄酮含量显著增加[30-31]。R2R3-MYB蛋白中的Sg4亚家族中,超表达苹果烟草中花青苷及总黄酮的合成受到催化,花色变深[32]。草莓中研究较少,烟草的表达与程序性细胞死亡相关,其可能阻止程序性细胞死亡并协调植株对非生物逆境的抗性[33]。金鱼草中能够激活、和启动子的转录[34]。有研究指出,的表达参与调控了诸如花青苷合成等生理代谢[35]。是木质素合成途径的上游基因,是木质素合成途径的下游基因[36]。和在成熟期‘丽江山荆子’果肉中表达量最低[37]。由本研究可知,转草莓全红期果实中、及表达量显著低于野生型,与总黄酮、总酚类及花青苷含量存在相关性;和的表达显著高于野生型,且分别与总黄酮、总酚类及花青苷含量呈正相关(=0.584,0.921*,0.704;=0.310,0.585,0.314)。花青苷合成相关的结构基因在野生型、转基因株系7和8全红期果实中的表达量显著高于株系1、9和10,但株系1的花青苷含量却显著高于株系8及野生型。在苹果果皮[38]和荔枝果皮[39]的研究中发现,活性与花青苷的积累趋势不一致。本研究相关性分析发现,在转草莓株系中的表达量与花青苷含量呈正相关(=0.249),但不存在显著性,说明果实花青苷的含量与活性没有密切关系。花青苷合成相关结构基因在野生型全红期果实中的表达量显著高于转基因株系,但野生型的花青苷含量却显著低于转基因株系。猕猴桃中的表达变化与果皮着色趋势不具有一致性,的表达与着色存在对应关系,可见在花青素合成途径中同一催化酶可能存在不同转录本[40]。本研究中的表达量与总黄酮、总酚和花青苷含量呈负相关。这些调控差异说明,次生代谢物合成过程具有复杂的机制,同家族不同基因在功能上存在差异,具体影响有待进一步研究,由此推测转基因植株中的花青素苷的合成与和不存在显著相关性。
从本研究可知,转基因株系中包含大量光诱导响应元件的及上调表达,促进了碳水化合物的吸收,提高了果实中可溶性糖含量。黄酮类生物合成和光合作用通路是果实着色过程中主要的影响因子[41],含大量光诱导响应元件基因的表达促进相关物质合成,使转草莓果实的风味物质含量及色泽品质优于野生型。说明外源的转入能够提高光的有效性,活化及的表达,以促进着色物质在果实中的形成及积累,与前人研究一致。已有研究表明DREB转录因子能够调控乙烯形成,催化初生及次生代谢物的合成,并且光照还能进一步影响可溶性蛋白、糖、抗坏血酸等初生代谢物合成。乙烯可能与光一同调控增加了转果实中可溶性糖、花青苷等风味、色泽物质含量。调控相关基因参与转化体发育和成熟的进程,为深入揭示功能及草莓果实成熟调控的因子及分子机理提供了理论参考。
4 结论
转株系与野生型草莓果实的花青苷、总黄酮及总酚含量存在显著差异。可溶性固形物含量与可溶性糖含量成正比,转基因株系果实的可溶性糖含量显著高于野生型。转基因株系草莓成熟果实果肉的氨基酸含量显著高于转基因株系;转基因株系1和7果实的可滴定酸含量、转基因株系1果实的抗坏血酸含量、转基因株系9及10果实的可溶性蛋白含量显著高于野生型。在转基因株系草莓果实中的表达量显著高于野生型;和在转基因株系中表达显著高于野生型。差异表达基因启动子区域包含多种高等植物顺势调控元件,主要有对真核生物起到增强基因转录效率的CAAT-box和核心启动子元件TATA-box。同时还包含G-Box、G-box、MBS、ARE、5UTR Py-rich stretch等能影响各基因对光的响应及在苯丙烷代谢途径中起调节作用的顺式作用元件。调控相关基因参与转化体果实发育和成熟,提高光的有效性,活化黄酮类生物合成通路关键基因,差异基因中均包含大量光诱导响应元件,及的表达促进了总黄酮、酚类物质及花青苷等次生代谢物的合成。外源的转入促进着色物质在果实中的形成与积累。
[1] 张勇, 汤浩茹, 罗娅, 王小蓉, 陈清, 刘泽静. 草莓基因的克隆及表达分析. 园艺学报, 2014, 41(2): 240-248.
ZHANG Y, TANG H R, LUO Y, WANG X R, CHEN Q, LIU Z J. Isolation and expression analysis of a CRT/DRE-binding factor genefrom., 2014, 41(2): 240-248. (in Chinese)
[2] Bajwa V S, Shukla M R, Sherif S M, Susan J M, Praveen K S. Role of melatonin in alleviating cold stress in., 2014, 56(3): 238-245.
[3] 赵佳, 刘荣, 杨帆, 李鑫, 刘厚生, 严倩, 肖月华. 月季花青素苷相关R2R3-MYB蛋白基因的克隆和表达分析. 中国农业科学, 2015, 48(7): 1392-1404.
ZHAO J, LIU R, YANG F, LI X, LIU H S, YAN Q, XIAO Y H. Cloning and expression analysis of R2R3-MYB genes related to anthocyanin biosynthesis in rose., 2015, 48(7): 1392-1404. (in Chinese)
[4] 李辰, 范意娟, 纪文龙, 魏灵芝, 姜金铸, 李冰冰, 贾文锁.过量表达可促进番茄果实发育及成熟. 中国农业大学学报, 2014, 19(3): 73-79.
LI C, FAN Y J, JI W L, WEI L Z, JIANG J Z, LI B B, JIA W S. Over-expression ofpromotes fruit development and ripening in ‘Micro-Tom’ plant., 2014, 19(3): 73-79. (in Chinese)
[5] Nishawy E, Sun X, Ewas M, Ziaf K, Xu R, Wang D, Amar M, Zeng Y, Cheng Y. Overexpression ofDREB gene in tomato affects fruit size and accumulation of primary metabolites., 2015, 192: 460-467.
[6] KUANG J F, CHEN J Y, LIU X C, HAN Y C, XIAO Y Y, SHAN W, TANG Y, WU K Q, HE J X, LU W J. The transcriptional regulatory network mediated by banana () dehydration- responsive element binding () transcription factors in fruit ripening., 2017, 214(2): 762-781.
[7] MIZUNO S, HIRASAWA Y, SONODA M, NAKAGAWA H, SATO T. Isolation and characterization of three DREB/ERF-type transcription factors from melon ()., 2006. 170(6): 1156-1163.
[8] EBRAHIMI M, ABDULLAH S N, ABDUL AZIZ M, NAMASIVAYAM P. Oil palmconferred stress tolerance in transgenic tomato plants through modulation of the ethylene signaling pathway., 2016, 202: 107-120.
[9] GU X, CHEN Y, GAO Z, QIAO Y, WANG X. Transcription factors and anthocyanin genes related to low-temperature tolerance intransgenic strawberry., 2015, 89: 31-43.
[10] WROLSTAD R E, CULBERTSON J D, CORNWELL C J, MATTICK L R. Detection of adulteration in blackberry juice concentrates and wines., 1982, 65(6): 1417-1423.
[11] 杨远帆, 倪辉, 吴黎明. 茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量. 中国食品学报, 2013, 13(2): 171-176.
YANG Y F, NI H, WU L M. Determination of Amino ACID in honey and high fructose corn syruo (HFCS) by the method of ninhydrin colorization., 2013, 13(2): 171-176. (in Chinese)
[12] DJERIDANE A, YOUSFI M, NADJEMI B, BOUTASSOUNA D, STOCKER P, VIDAL N. Antioxidant activity of some Algerian medicinal plants extracts containing phenolic compounds., 2006, 97(4): 654-660.
[13] 国家药典委员会. 中华人民共和国药典(一部).北京: 中国医药科技出版社, 2010.
Chinese Pharmacopoeia Commission.. Beijing: China Medical Science Press, 2010. (in Chinese)
[14] 蔡庆生. 植物生理学实验. 北京: 中国农业大学出版社, 2013.
CAI Q S.. Beijing: China Agricultural University Press, 2013. (in Chinese)
[15] BLANCH M, ROSALES R, PALMA F, SANCHEZ-BALLESTA M T, ESCRIBANO M I, MERODIO C. CO2-driven changes in energy and fermentative metabolism in harvested strawberries., 2015, 110: 33-39.
[16] VILLARREAL N M, BUSTAMANTE C A, CIVELLO P M, MARTÍNEZ G A. Effect of ethylene and 1-MCP treatments on strawberry fruit ripening., 2010, 90(4): 683-689.
[17] TRAINOTTI L, PAVANELLO A, CASADORO G. Different ethylene receptors show an increased expression during the ripening of strawberries: Does such an increment imply a role for ethylene in the ripening of these non-climacteric fruits?, 2005, 56(418): 2037-2046.
[18] LAUVERGEAT V, LACOMME C, LACOMBE E, LASSERRE E, ROBY D, GRIMA-PETTENATI J. Two cinnamoyl-CoA reductase (CCR) genes fromare differentially expressed during development and in response to infection with pathogenic bacteria., 2001, 57(7): 1187-1195.
[19] DERIKVAND M M, SIERRA J B, RUEL K, POLLET B, DO C T, THÉVENIN J, BUFFARD D, JOUANIN L, LAPIERRE C. Redirection of the phenylpropanoid pathway to feruloyl malate inmutants deficient for cinnamoyl-CoA reductase 1., 2008, 227(5): 943-956.
[20] ZHOU R, JACKSON L, SHADLE G, NAKASHIMA J, TEMPLE S, CHEN F, DIXON R A. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in., 2010, 107(41): 17803-17808.
[21] VAN ACKER R, LEPLE J C, AERTS D, STORME V, GOEMINNE G, IVENS B, LEGEE F, LAPIERRE C, PIENS K, VAN MONTAGU M C E, SANTORO N, FOSTER C E, RALPH J, SOETAERT W, PILATE G, BOERJAN W. Improved saccharification and ethanol yield from field-grown transgenic poplar deficient in cinnamoyl-CoA reductase., 2014, 111(2): 845-850.
[22] SATTLER S A, WALKER A M, VERMERRIS W, SATTLER S E, KANG C. Structural and biochemical characterization of cinnamoyl- CoA reductases., 2017, 173(2): 1031-1044.
[23] SMITH R A, CASS C L, MAZAHERI M, SEKHON R S, HECKWOLF M, KAEPPLER H, LEON N, MANSFIELD S D, KAEPPLER S M, SEDBROOK J C. Suppression ofincreases the level of monolignol ferulates incorporated into maize lignins., 2017, 10(1): 109.
[24] TOHGE T, NISHIYAMA Y, HIRAI M Y, YANO M, NAKAJIMA J, AWAZUHARA M, INOUE E, TAKAHASHI H, GOODENOWE D B, KITAYAMA M. Functional genomics by integrated analysis of metabolome and transcriptome ofplants over-expressing an MYB transcription factor., 2005, 42(2): 218-235.
[25] ALBERT N W, GRIFFITHS A G, COUSINS G R, VERRY I M, WILLIAMS W M.Anthocyanin leaf markings are regulated by a family ofgenes in the genus., 2015, 205(2): 882-893.
[26] Kathy E S, Hanh N, Fernand K, David A B, Nick W A, John A M, Meeghan P J, Ross N C, Colin E, Kevin M D. The onion (L.)generegulates anthocyanin biosynthesis., 2016, 7: 1865.
[27] WANG N, XU H, JIANG S, ZHANG Z, LU N, QIU H, QU C, WANG Y, WU S, CHEN X. MYB12 and MYB22 play essential roles in proanthocyanidin and flavonol synthesis in red-fleshed apple (f.)., 2017, 90(2): 276-292.
[28] BUER C S, IMIN N, DJORDJEVIC M A. Flavonoids: New roles for old molecules., 2010, 52(1): 98-111.
[29] KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways., 2005, 10(5): 236-242.
[30] 杨文杰, 杜海, 方芳, 杨婉身, 吴燕民, 唐益雄. 大豆两个MYB 转录因子基因的克隆及表达分析. 中国农业科学, 2008, 41(4): 961-970.
YANG W J, DU H, WAN F, YANG W S, WU Y M, TANG Y X. Cloning and characterization of two new MYB transcription factor genes from soybean., 2008, 41(4): 961-970. (in Chinese)
[31] 杨文杰, 吴燕民, 唐益雄. 大豆转录因子基因的表达及功能分析. 遗传, 2009, 31(6): 645-653.
YANG W J, WU Y M, TANG Y X. Expressing and functional analysis offrom soybean., 2009, 31(6): 645-653. (in Chinese)
[32] Vimolmangkang S, Han Y, Wei G, KORBAN S S. An apple MYB transcription factor,, is involved in regulation of anthocyanin biosynthesis and flower development., 2013, 13(1): 176.
[33] BAHIELDIN A, ATEF A, EDRIS S, GADALIA N O, ALI H M. Ethylene responsive transcription factor ERF109 retards PCD and improves salt tolerance in plant., 2016, 16(1): 216.
[34] MOYANO E, MARTINEZ-GARCIA J F, MARTIN C. Apparent redundancy in MYB gene function provides gearing for the control of flavonoid biosynthesis in antirrhinum flowers., 1996, 8(9): 1519-1532.
[35] Jackson D, Martin C. Expression patterns of MYB genes fromflowers., 1991, 3(2): 115-125.
[36] 黄杰恒, 李威, 曲存民, 刘列钊, 徐新福, 王瑞, 李加纳. 甘蓝型油菜不同抗倒性材料中木质素代谢途径关键基因表达特点. 作物学报, 2013, 39(8): 1339-1344.
HUANG J H, LI W, QU C M, LIU L Z, XU X F, WANG R, LI J N. Expression characteristics of key genes in lignin pathway among different lodging resistance lines ofL., 2013, 39(8): 1339-1344. (in Chinese)
[37] 周兰. 苹果果实发育中类黄酮含量变化及相关基因的研究[D]. 北京: 中国农业科学院, 2013.
ZHOU L. Study on the concentration changes and related genes of flavonoids in apple [D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese)
[38] JU Z G, YUAN Y B, LIU C L, WANG Y Z, TIAN X P. Dihydroflavonol reductase activity and anthocyanin accumulation in ‘Delicious’, ‘Golden Delicious’ and ‘Indo’ apples., 1997, 70(1): 31-43.
[39] 王惠聪, 黄旭明, 胡桂兵, 黄辉白. 荔枝果皮花青苷合成与相关酶的关系研究. 中国农业科学, 2004, 37(12): 2028-2032.
WANG H C, HUANG X M, HU G B, HUANG H B. Studies on the relationship between anthocyanin biosynthesis and related enzymes in litchi pericarp., 2004, 37(12): 2028-2032. (in Chinese)
[40] Montefiori M, Espley R V, Stevenson D, Cooney J, Datson P M, Saiz A, Atkinson R G, Hellens R P, Allan A C.Identification and characterisation ofand, two glycosyltransferases responsible for anthocyanin biosynthesis in red-fleshed kiwifruit ()., 2011, 65(1): 106-118.
[41] 何平, 李林光, 王海波, 常源升, 李慧峰. 遮光性套袋对桃果实转录组的影响. 中国农业科学, 2017, 50(6): 1088-1097.
HE P, LI L G, WANG H B, CHANG Y S, LI H F. Effects of shading fruit with opaque paper bag on transcriptome in peach., 2017, 50(6): 1088-1097. (in Chinese)
(责任编辑 赵伶俐)
Effect ofGene Overexpression on Fruit Quality and Related Gene Expression in Strawberry
YAN YiChao1, WAN ChunYan2, GU XianBin1, GUO ChengBao3, CHEN YueHong3, GAO ZhiHong1
(1Nanjing Agricultural University, Nanjing 210095;2Zhenjiang Institute of Agricultural Science, Zhenjiang 212400, Jiangsu;3Nanjing Institute of Agricultural Science, Nanjing 210000)
【】The effect of exogenoustransformation to the fruit quality and related gene expression in ‘Benihoppe’ strawberry were analyzed to reveal the function and molecular mechanism of quality regulation in transgenic strawberry fruit.【】The edible organs on fivetransgenic strawberry lines and non-transgenic ‘Benihoppe’ strawberries (fruits in full red stage) were used as material to test and determine the vertical diameter, transverse diameter, weight, contents of flavor substance (soluble sugar, soluble protein, ascorbic acid) and coloring materials (anthocyanin, flavonoids and total phenol). The structure of the exogenous gene and seven secondary metabolites synthesis pathway-related genes (,,,,,,and) and the elements of gene promoter were analyzed and were predicted by bioinformatics methods such as BLASTn, GENEFINDER, and PlantCARE. The expression of related genes was detected by qRT-PCR. The data were analyzed by 7300 system software and 2-△△Ctmethod. The variance and correlation analysis of physiological, biochemical and molecular data were analyzed. The effects ofon the fruit quality and related gene expression of ‘Benihoppe’ strawberry were discussed comprehensively. 【】The fresh weight of transgenic and non-transgenic strawberries was ranging from 11.75 to 15.42 g. The vertical andtransverse diameters were ranging from 35.12 to 40.42 mm and 28.73 to 32.6 mm, respectively.Only the volume diameter of transgenic line 8 was significantly higher than that of line 7, and there were no significant differences between the other samples. The contents of anthocyanin in line 1 and line 7 were significantly higher than those of the control. The contents of total phenol in transgenic line1 and line 7 were significantly higher than that in control. The contents of total phenol in each line were significantly higher than that in the control. The soluble sugar contents in the transgenic line 1, line 7 and line 8 were significantly higher than that of the control (21.70 mg∙g-1FW), which were 2.87, 3.39 and 3.35 times of the control. There was a positive correlation between soluble solids contents and soluble sugar contents (=0.811*), but there was no significant difference in the soluble solids contents of the samples. The contents of amino acids in the fruiting fruits of the transgenic lines were ranging from 0.2580 to 0.3950 g/100 g FW. The content of amino acids in the control was 0.5151 g/100 g FW, which was significantly higher than that of the transgenic lines. The contents of titratable acid in the transgenic line 1 and line 7 were significantly higher than that in the control. The content of ascorbic acid in line 1 was 168.35 mg/100 g FW, which was significantly higher than that of the wild-type of 92.50 mg/100 g FW. The contents of soluble protein in transgenic line 9 and line 10 were 25.97 and 25.86 mg∙g-1FW, respectively, which was significantly higher than that of control (22.93 mg∙g-1FW). The expression levels of,(cinnamoyl-CoA reductase 2-like) and(myb-related protein 306) in the transgenic lines were significantly higher than that of the wild-type. It was found that the promoter region of differentially expressed genes contained a variety of higher plant cis-acting elements, mainly were CAAT-box and TATA-box, which had enhanced transcription efficiency of eukaryotes.It also included some the cis-acting elements such as G-Box, G-box, MBS, ARE, 5UTR Py-rich stretch, which can affect the response of each gene to light and play a regulatory role in the phenylpropane metabolic pathway.【】regulated the related genes involved in the development and maturation of transformants, improved the effectiveness of light, activated the key genes of flavonoid biosynthetic pathway. Differentially expressed genes contained a large quantity of light-induced response elements. The expression ofandpromoted the synthesis of secondary metabolites such as flavonoids, phenols, anthocyanins and total phenols. The transformation ofgene resulted in a significant increase in the nutrient and coloring material contents and improved the fruit quality in strawberry.
strawberry (Duch.);; overexpression; fruit quality; promotor
2017-08-31;
2017-11-14
江苏省农业科技自主创新资金项目(CX(12)5065)、江苏省六大人才高峰人才项目(NY068)
阎依超,E-mail:2014104020@njau.edu.cn。万春雁,E-mail:254071691@qq.com。阎依超与万春雁为同等贡献作者。
高志红,Tel:025-84395724;E-mail:gaozhihong @njau.edu.cn
