山西老陈醋发酵过程中高产酸乳酸菌的鉴定
2018-04-17于迪乔羽范振宇邢晓莹王如福
于迪 ,乔羽,范振宇,邢晓莹,王如福*
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801;2.山西农业大学 园艺学院,山西 太谷 030801)
山西老陈醋发酵过程需要霉菌、酵母菌、醋酸菌、乳酸菌等众多微生物共同参与[1],不同微生物在不同发酵时期的代谢及相互作用为老陈醋风味的形成奠定了物质基础[2]。乳酸菌能够利用葡萄糖代谢产生乳酸,乳酸含量高的食醋,能够减缓总酸含量过高带来的尖酸刺激口感,使其酸味更加柔和、醇厚[3]。此外,乳酸菌产生的乳酸与醇类物质发生酯化反应形成的乳酸乙酯等酯类物质,是山西老陈醋香气的主要成分之一[4-6]。
传统的乳酸菌鉴定方法需要做大量的生理生化试验,且过程繁琐,结果不稳定。近年来,利用16S rDNA序列分析等分子生物技术进行微生物的鉴定已成为最常用的检测方法[7-9]。本试验对山西老陈醋发酵过程中酒化阶段和醋化阶段分离出的乳酸菌进行产酸试验以及酒精、乙酸、温度耐受性试验,筛选出产酸量高、耐受性好的优势菌株,通过形态学特征以及16S rDNA序列分析对筛选出的优势乳酸菌进行鉴定。拟为下一步高产酸乳酸菌在山西老陈醋发酵过程中的强化应用提供良好的菌种基础。
1 材料与方法
1.1 材料、试剂与设备
1.1.1菌株
实验室前期从山西老陈醋发酵过程中酒化阶段的酒醪中分离出的10株乳酸菌,编号JL1~JL10;醋化阶段的醋醅中分离出的25株乳酸菌,编号CL11~CL35。
1.1.2试剂
氢氧化钠、邻苯二甲酸氢钾、TAE缓冲液、rTaq DNA聚合酶(Takara公司产品)、DNA 分子量 Marker(Takara公司产品)、dNTPS(Takara 公司产品)。
MRS肉汤培养基:蛋白胨10.0 g、乙酸钠5.0 g、牛肉粉5.0 g、葡萄糖20.0 g、酵母粉4.0 g、硫酸镁0.2 g、柠檬酸三胺2.0 g、硫酸锰0.05 g、吐温80 1 mL、磷酸氢二钾2.0 g,定容至1000 mL,121 ℃,20 min灭菌。
50×TAE Buffer 配制方法:(1)称量Tris 242 g,Na2EDTA·2H2O 37.2 g于1 L烧杯中;(2)向烧杯中加入约800 mL去离子水,充分搅拌均匀;(3)加入57.1 mL的冰乙酸,充分溶解;(4)用NaOH调pH至8.3,加去离子水定容至1 L后,室温保存。使用时稀释50倍,即1×TAE Buffer。
1.1.3试验设备
全自动高压灭菌器MCS-3020日本三洋公司;BPX-272电热恒温培养箱上海博讯实业有限公司;9700型PCR扩增仪美国ARI公司;旋涡震荡仪麒麟医用仪器厂;2100型分光光度计上海光谱仪器有限公司;凝胶成像系统美国RICAN BIO-RAD公司;可调式微量移液器、Centrifuge 5415R低速冷冻离心机德国Eppendorf公司。
1.2 试验方法
1.2.1产酸试验方法
菌株的活化:取出甘油保藏的35株乳酸菌,将菌液接种到灭菌后的MAS平板上,37 ℃恒温培养箱中培养24~36 h后,将MAS平板长出的乳酸菌再接种到MAS斜面上,37 ℃的恒温培养箱中培养24~36 h,以此活化2次,备用。
全域旅游要求全社会参与,全民参与旅游业,加大旅游与其他产业的融合力度,达到资源共享。旅游交通、旅游公共服务、智慧旅游三个系统构成了景区全域化发展一体化机制。借助“微社区”[6]模式突出社区居民参与,社区居民主动融入文旅产业的发展,是对自身的身份认同、文化认同、情感认同。当地居民对外来游客的态度影响着当地文旅产业的发展,所以在发展旅游产业的同时兼顾社区居民的综合利益也是至关重要的。
将活化后的菌株分别接种到灭菌后的9 mL MAS肉汤培养基中,在37 ℃的恒温培养箱中培养48 h,取出后摇匀,移取4 mL菌液,加入36 mL蒸馏水将菌液稀释10倍。用0.1 mol/L的NaOH溶液滴定至pH为8.2,记录消耗的NaOH溶液的体积。用NaOH溶液的消耗量来计算乳酸菌的产酸量。同样的方法做3次平行试验。
产酸量计算公式(以乙酸计)为:
式中:X为菌液的产酸量(以乙酸计),g/dL;V1为测定用乳酸菌菌液消耗NaOH标准滴定液的体积,mL;V2为空白培养基消耗NaOH标准滴定液的体积,mL;c为NaOH标准滴定液的浓度,mol/L;V为菌液的体积,mL;0.09为1.00 mL氢氧化钠标准滴定溶液[c(NaOH)=1.000 mol/L]相当于乳酸的质量,g。
1.2.2耐受性试验方法
1.2.2.1酒精耐受性试验方法
将活化的乳酸菌菌液按6%的比例接种于灭菌后的乙醇浓度分别为0,3%,6%,9%,12%的MRS肉汤培养基中,在37 ℃的恒温培养箱中培养48 h。在分光光度计波长600 nm处测定菌液的OD值,并做空白对照试验。
1.2.2.2乙酸耐受性试验方法
将活化好的乳酸菌菌液按6%的比例接种于灭菌后的乙酸浓度分别为0,1,2,3,5 g/dL的MRS肉汤培养基中,在37 ℃的培养箱中培养48 h。在分光光度计波长600 nm处测定菌液的OD值,并做空白对照试验。
1.2.2.3温度耐受性试验方法
将活化好的乳酸菌菌液按6%的比例接种于灭菌后的MRS肉汤培养基中,分别在30,35,40,45,50 ℃的培养箱中培养48 h。在分光光度计波长600 nm处测定菌液的OD值,并做空白对照试验[10,11]。
1.2.3形态特征观察[12]
菌落形态观察:观察菌落的大小、形状、边缘状况等特征,并记录结果。
1.2.416S rDNA鉴定
1.2.4.1按试剂盒的说明进行菌株DNA提取
1.2.4.2PCR扩增
PCR扩增见表1。

表1 PCR扩增Table 1 PCR amplification
PCR反应条件:对扩增产物进行电泳检测,PCR扩增后,在2%琼脂糖凝胶中加入2 μL扩增产物和5 μL染液充分混合后进行电泳,电泳时电压为5 V/cm,时间为45 min,电泳液为1×TAE。通过UVP凝胶成像系统观察电泳的条带图,见图1。
图1 电泳条带图Fig.1 Electrophoresis bar graph
1.2.4.3测序及分析
将PCR扩增后的菌株DNA送至上海生物工程股份有限公司进行16S rDNA鉴定。测序结果提交到Genbank基因库中,通过Blast比对进行同源性分析,建立系统发育树,分析其亲缘关系,对待测菌株进行鉴定。
2 结果与分析
2.1 高产酸乳酸菌的筛选
经过产酸量试验后,得到35株乳酸菌的产酸量,见图2。

图2 35株乳酸菌的产酸量Fig.2 Acid yield of 35 strains of suspected lactic acid bacteria
经过对35株乳酸菌产酸量的测定后,从中筛选出产酸量在7.50 g/dL以上的菌株8株,编号分别是JL6,JL9,CL20,CL21,CL28,CL29,CL31,CL33。其中产酸量最高的是醋化阶段的CL21菌株,产酸量达到10.02 g/dL,其次是酒化阶段的JL6菌株,产酸量为9.73 g/dL。
2.2 高产酸乳酸菌的耐受性试验
2.2.1酒精耐受性试验
经过酒精耐受性试验后,产酸量较高的8株乳酸菌在不同酒精浓度的培养基中培养48 h后的菌液OD值见图3。
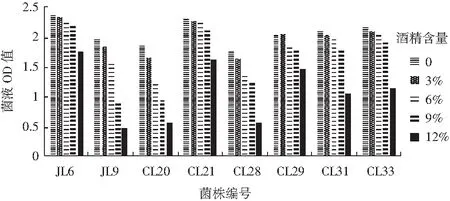
图3 8株菌株在不同酒精浓度下的OD值Fig.3 OD values of 8 strains of suspected lactic acid bacteria with different alcohol concentration
在山西老陈醋发酵过程中的酒化阶段,原料中的还原糖在酒化酶的作用下转化成乙醇,使酒醪的酒精度逐渐升高[13],能够达到7°~8°,甚至高至10°,所以筛选的菌株要对酒精有较好的耐受性。由图3可知,在不同酒精浓度条件下,与其他菌株相比,JL6,CL21,CL33菌株的OD值较高,所以它们的酒精耐受性较好。其中JL6菌株在不同酒精浓度下的OD值都是最高的,其次是菌株CL21。可能由于菌株JL6从酒化阶段的酒醪中分离出,长期的驯化使其对酒精有较好的耐受性。
2.2.2乙酸耐受性试验
经过乙酸耐受性试验后,产酸量较高的8株乳酸菌在不同乙酸浓度的培养基中培养48 h后的菌液OD值见图4。

图4 8株菌株在不同乙酸浓度下的OD值Fig.4 OD values of 8 strains of suspected lactic acid bacteria with different acetic acid concentration
醋化阶段,醋醅中底物丰富,环境也适合醋酸菌等微生物的生长,醋酸菌代谢产生的醋酸逐渐增多,导致醋醅的酸度快速增长,最高时能达到5 g/dL,因此随着发酵的进行,只有耐酸性好的菌株,才能在醋醅中存活。由图4可知,在不同乙酸浓度条件下,JL6,CL21,CL33菌株的OD值相对较高,其中CL21菌株的OD值在不同乙酸浓度下最高,其次是菌株JL6,最后是菌株CL33。
2.2.3温度耐受性试验
经过温度耐受性试验后,产酸量相对较高的8株菌株在不同温度条件下的OD值结果见图5。

图5 8株乳酸菌在不同温度下的OD值Fig.5 OD values of 8 strains of suspected lactic acid bacteria at different temperatures
醋化阶段,随着火醅的接入,微生物活动旺盛,醋醅的温度逐渐升高,醋酸发酵第5天,醋醅中的温度能够达到48 ℃[14],因此,筛选出的优势乳酸菌,不仅能够耐受较高的酒精度和酸度,同时对温度也要有足够的耐受性。由图5可知,在不同温度条件下,菌株JL6,CL21,CL33的OD值较高,其中菌株CL21的OD值最高,在45 ℃时OD值是1.725,50 ℃时OD值是0.361,其次是菌株JL6,最后是菌株CL31。
2.3 菌株的形态观察
观察筛选出的2株优势乳酸菌在MRS固体培养基上形成的菌落情况,单菌落形态图见图6。经革兰氏染色后在油镜下观察到的细胞形态见图7。对其形状、大小、颜色、表面状态以及细胞形态等方面进行描述,见表2。

图6 2株乳酸菌在MRS琼脂培养基上形成的菌落Fig.6 Colony of 2 strains of lactic acid bacteria on MRS agar medium

图7 乳酸菌菌株经革兰氏染色在油镜下观察到的细胞形态Fig.7 The morphology of lactic acid bacteria strains observed under oil microscope by Gram staining

表2 山西老陈醋发酵过程中2株乳酸菌菌落形态Table 2 Colony morphology of 2 strains of LAB isolated from fermentation of Shanxi mature vinegar
2.4 菌株16S rDNA鉴定
2.4.1PCR 扩增
将筛选出产酸量高、耐受性较好的2株待测乳酸菌进行DNA的提取鉴定,利用 2%琼脂糖凝胶电泳检测待测序菌株的16S rDNA PCR扩增产物。2株待测菌株的16S rDNA PCR扩增产物的琼脂糖凝胶电泳图见图8。

图8 DNA样本进行的PCR扩增产物电泳结果Fig.8 Electrophoresis results of PCR products
由图8可知,1500 bp附近出现亮条带,说明2株菌的 PCR产物扩增成功。
2.4.2系列对比
将所测序列结果提交NCBI网站,经BLAST检索系统对序列同源性的比较分析可知2株菌分别与发酵乳杆菌和干酪乳杆菌相似。为显示各菌株与相似菌种之间的亲缘关系及其系统地位,由图9可知,用MEGA生物学软件中的分析法Neighbour-joining构建系统发育树[15],见图9。

图9 菌株 16S rDNA 基因序列的系统进化树Fig.9 Phylogenetic tree of strain 16S rDNA gene sequences
3 讨论
赵国忠等[16]对食醋发酵过程中的酒醪分离出的乳酸菌进行鉴定,发现植物乳杆菌占有数量较多,是酒化阶段的主要细菌,在食醋发酵过程中发挥着重要作用;Wu等[17]利用分子生物学技术研究山西老陈醋发酵过程中细菌真菌的生物多样性,发现酒化阶段的主要乳酸菌包括植物乳杆菌、发酵乳杆菌、乳酸片球菌、布氏乳杆菌等;Nie Zhiqiang等[18]在分析山西老陈醋发酵过程中微生物群落的动态演替和多样性时,发现酒化阶段的乳酸菌主要为魏斯氏乳杆菌和植物乳杆菌,醋化阶段的乳酸菌为瑞士乳杆菌、耐酸乳杆菌等。本试验中酒化阶段筛选出的菌株JL6为发酵乳杆菌,醋化阶段筛选出的菌株CL21为干酪乳杆菌,与本领域中其他研究相比有一定的区别,这可能与酿醋所用原料和大曲有关,不同地域所处环境中的微生物种类不同,大曲制作过程中所接触的微生物也各不相同,因此不同厂家的酒醪醋醅中分离出的微生物种类也有所差异。
4 结论
本文通过产酸定量试验、耐受性试验,对山西老陈醋发酵过程中分离出的35株乳酸菌进行筛选,最终筛选出产酸量高、耐受性好的菌株JL6,CL21,产酸量分别为9.73 g/dL和10.02 g/dL,经16S rDNA鉴定分别为发酵乳杆菌和干酪乳杆菌。本研究可以为下一步研究乳酸菌的生长性能和发酵特性、菌种的选育、菌剂的生产以及在山西老陈醋发酵过程中的强化应用等方面提供良好的菌种基础,对推动我国食醋行业的发展具有重要意义。
参考文献:
[1]吕艳歌,马海亮,李云亮,等.山西老陈醋产酸菌的分离鉴定及系统学分析[J].中国食品学报,2013(12):163-171.
[2]杜宏福,聂志强,刘贤,等.山西老陈醋发酵过程中细菌群落组成与有机酸变化的关系研究[J].中国调味品,2015,40(7):26-31,42.
[3]张国华,何国庆.传统发酵食品中的乳酸菌多样性及其功能特性[J].中国食品学报,2013(9):174-181.
[4]闫彬,贺银凤.乳酸菌与酵母菌共生机理综述[J].食品科学,2012(3):277-281.
[5]王梦颖,赵国忠,赵建新,等.山西老陈醋发酵过程菌群微生态分析及乳酸菌分离[J].中国调味品,2016,41(6):29-33,38.
[6]蒋忠,冯文利,王伟,等.乳酸菌和酵母菌共酵改善食醋品质的研究[J].中国酿造,2015,34(9):104-108.
[7]付晓艳.利用16S rRNA基因部分序列的聚类分析鉴定乳酸球菌[D].哈尔滨:东北农业大学,2005.
[8]龚加路,赵兴秀,邹伟,等.高产酸乳酸菌的分离鉴定及其益生特性的研究[J].中国调味品,2016,41(3):17-20,31.
[9]Zheng X W,Yan Z,Nout M J R,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu, a Chinese industrial fermentation starter[J].International Journal of Food Microbiology, 2014,182(28):57-62.
[10]郭明烨,刘军,王洋,等.四川麸醋醋醅中一株乳酸菌的筛选及鉴定[J].中国调味品,2016,41(5):23-29.
[11]张志燕,钱静亚,马真,等.镇江香醋醋醅中优势高产酸醋酸菌菌株的筛选[J].食品工业科技,2016(11):174-178,194.
[12]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[13]张奶英.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技,2014(11):174-178.
[14]孙峰宇.乳酸菌的分离鉴定及在食醋酿造中的应用[D].天津:天津科技大学,2013.
[15]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[16]赵国忠,孙峰宇,姚云平,等.老陈醋酿造过程中乳酸菌筛选及对风味的影响[J].食品工业科技,2014,35(24):159-163.
[17]Wu J J,Ma Y K,Zhang F F,et al.Biodiversity of yeasts, lactic acid bacteria and acetic acid bacteria in the fermentation of "Shanxi aged vinegar", a traditional Chinese vinegar[J].Food Microbiology,2012,30(1):289-297.
[18]Nie Z,Zheng Y,Du H,et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiology,2015(47):62-68.
