纵隔胃受照剂量对T4期食管癌患者术后放疗靶区范围的影响
2018-04-17尹小祥周绍兵
古 亮,尹小祥,赵 莺,周绍兵
(泰兴市人民医院放疗科,江苏 泰兴 225400)
局部晚期食管癌单纯手术治疗预后较差,5 a生存率仅为20%~30%,局部复发及远处转移仍是治疗失败的主要原因。目前证据表明,Ⅲ期患者可以从术后辅助放疗中受益[1-2],术后放疗靶区范围争议很大,多数研究表明,术后预防照射重点是中上纵隔及双侧锁骨上区。但对于T4期患者术后放疗靶区是否要包全瘤床,仍是个棘手问题,若照射范围较大,导致残胃受照过多,不良反应较重,尤其是在术后纵隔胃患者更应慎重考虑,本文通过选取食管中段癌术后2种不同勾画范围,应用剂量-体积直方图(dose volume histograms, DVH)来分析比较纵隔胃受照剂量的差异,并探讨其对靶区勾画的影响。
1 材料与方法
1.1入组标准1)手术前有完整影像学资料,均为食管胸中段癌,即肿瘤的上边缘位于奇静脉弓下缘和下肺静脉下缘之间,均接受食管癌根治性切除术(R0),术后残胃位于纵隔内;2)术后病理类型均为鳞癌,T分期达T4期,且切缘阴性;3)手术与术后放疗间隔时间为3~4周;4)术后患者恢复良好,KPS评分≥70分,无放疗禁忌证;5)放疗前患者辅助检查均未见转移及复发征象。
1.2临床资料选取于2014年1月至2015年12月在我科行食管中段癌术后辅助放疗的患者,共15例,均符合入组条件,其中男9例,女6例;年龄(61.5±2.1)岁;根据手术前影像学资料及胃镜表现,肿瘤上缘距门齿(25.2±1.3)cm,肿瘤下缘距隆突(3.3±1.2)cm,肿瘤长度(4.5±1.5)cm。根据2009年UICC食管术后分期标准,5例患者术后分期为T4aN1M0,7例为T4aN2M0,3例为T4aN3M0,均具有术后辅助放疗指证。利用治疗计划系统计算术后胸腔胃的体积,15例患者胸腔胃体积(190.1±10.2)cm3,胸腔胃长度(31.8±2.9)cm。
1.3方法结合患者手术前及术后相关资料,勾画2种术后辅助放疗靶区,根据勾画靶区范围制作相应的调强放疗计划,由计划系统计算2种计划的剂量学指标,并进行比较。其放疗过程为:1)体膜固定:患者双手交叉置于头顶或体侧,头枕B枕,塑料体膜固定;2)CT扫描:CT扫描前30 min患者口服1 500 mL生理盐水,使残胃饱满,塑料体膜固定患者后行增强扫描,层厚5 cm,扫描范围为环状软骨上5 cm至肝脏下缘,并将CT图像传至治疗计划系统中进行计划制作;3)靶区勾画:采用2种方案勾画临床靶区(clinical target volume,CTV),一种方案为小野照射,其CTV包括锁骨上区和中上纵隔淋巴引流区域,上界:环状软骨上缘,下界:隆突下2~3 cm,另一种方案为扩大野照射,CTV除了包括锁骨上区和中上纵隔淋巴引流区外,同时包全瘤床,根据术前CT,扩大野照射的下界为肿瘤下缘向下2~3 cm。计划靶区(planning target volume,PTV)为CTV外放0.5 cm形成。同时勾画心脏、肺脏、脊髓、胸腔胃等危及器官。胸腔胃的勾画范围为:上界在胃食管胃吻合口处,一般位于胸廓入口处下方,下界在胃十二指肠交接处,一般位于横隔水平下方。所有靶区勾画者均经统一培训,按统一要求勾画,并由2名主任医师确认;4)放疗计划制作:由2~3名物理师共同协商完成调强放疗计划,处方剂量PTV为50 Gy,95%的PTV体积达到100%的处方剂量,剂量均匀性范围95%~107%,同时尽量避免或减少重要器官的照射。危机器官限量:双肺V5<65%,V20<25%,肺平均受量<13 Gy;心脏V40≤40%,脊髓最大剂量≤40 Gy。胸腔胃的剂量限制为V40<50%,同时不能有剂量高点。其放疗计划完成后由2名主任医师评估后开始放疗;5)放疗:患者在开始放疗前30 min口服1 500 mL生理盐水,采用西门子直线加速器,6 MV X线,常规分割。放疗过程中口服康复新等胃黏膜保护药物。
1.4剂量学观察指标利用治疗计划系统中的DVH分析比较2种不同勾画方案中胸腔胃受到的平均剂量(Dmean)、接受5、25、40、50 Gy照射的靶体积百分比(V5、V25、V40、V50)来评价胸腔胃受到照射的剂量情况[3]。
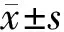
2 结果
利用治疗计划划系统对比,扩大野组照射范围长度比小野组照射长度增加(3.2±1.1)cm,导致纵隔胸腔胃受照体积增加(48.3±8.1)cm3。扩大野照射组Dmean、V40、V50高于小野照射组,差异均有统计学意义(P<0.05)。见表1。
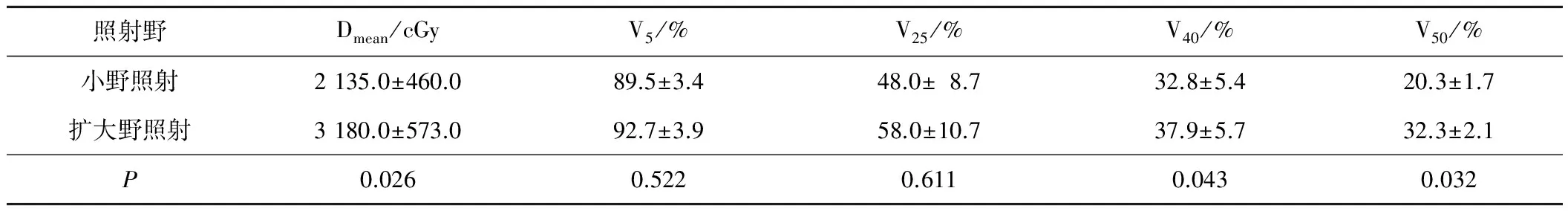
表1 2种不同勾画方案纵隔胸腔胃受照剂量比较
3 讨论
手术治疗为食管癌患者主要治疗方式之一,食管癌术后治疗失败的主要模式为区域性复发和(或)转移,其中以区域性复发常见,文献报道食管癌根治术后局部区域复发率为41.5%~49.0%[4],提示了局部治疗的重要性。目前已证明食管癌术后预防性照射可提高Ⅲ期根治性术后总生存率,降低放疗部位淋巴结转移率[2,5-6]。但术后照射范围尚未统一。多数学者通过研究食管癌术后淋巴结转移规律来指导术后靶区勾画。刘明等[7]报道食管癌根治术后纵隔淋巴结转移有一定规律,其左、右上纵隔气管旁淋巴结转移发生风险最高(64.1%),这是术后预防性照射的重点区域。刘俊等[8]通过对104例食管癌术后左胸路径术后局部复发规律的研究认为83.8%复发位于双侧锁骨上、中上纵隔,而吻合口主要位于上纵隔,因此预防性放射野若包括双侧锁骨上、中上纵隔及吻合口的T型野,则有可能最多降低90%左右的局部复发。本研究对照组采用小野照射,照射范围与多数学者研究的一致。目前已不支持照射全纵隔及胃左淋巴引流区,其原因可能为:食管癌根治术后对下纵隔、胃左贲门及腹腔淋巴结的清扫常常是彻底的,扩大照射野范围甚至远远超过了食管癌单纯放疗的照射野范围,而且术后胸胃基本上均在照射范围内,放疗反应重导致中途不得不暂停放疗而影响疗效,同时食管癌转移的重点仍然是中上纵隔[1,9-10]。而葛红等[11]的研究建议胸段食管癌术后放疗的靶区包括双侧锁骨上、中上纵隔以及食管瘤床。隆突下2~3 cm,不一定能完全把瘤床包括在照射靶区内,对于T4期患者,局部分期晚,若考虑要把瘤床照射在范围内,对T4a期患者来说照射野的下界明显下移,勾画方式与本研究扩大照射野组一致。
放射性胃损伤也是近年来临床比较关注的焦点。目前研究认为急性放射性胃炎的发生可能与多种因素有关,例如患者年龄、低体质量指数、胃充盈状态、病变部位,是否化疗、处方剂量、手术方式及放疗技术等,因其不可控因素较多[12],导致关于放射性胃损伤报道较少。有研究表明放射性胃损伤可能与胃受照射的最大剂量、单次剂量、照射面积和基础疾病等有关。如Feng等[13]在研究放疗导致胃出血模型中认为若无肝硬化,全胃照射41 Gy后胃出血的概率为10%,46 Gy则达到20%,56 Gy达到50%,若伴有肝硬化,引起10%、20%和50%胃出血的剂量分别为:16、18和22 Gy。Yoon等[14]认为V25是≥2级胃损伤的一个重要预测因子。国内沈文斌等[15]研究术后辅助放疗的49例患者中有19例(39%)患者出现≥2级急性放射性胃炎。其认为V40≤35.7%患者急性放射性胃炎发生率低于V40>35.7%组。而本研究扩大照射野组V40明显大于35.7,提示其发生≥2级放射性胃损伤的风险大。
目前食管癌手术方式较多,手术入路包括左胸路径、右胸路径,淋巴结清扫包括二野清扫、三野清扫等,而吻合口瘘是食管癌术后最常见和最严重的并发症,也是术后死亡的主要原因。因此有部分外科学者应用纵隔管状胃重建上消化道,其有利于减少胸胃综合征,减轻胸胃食管反流及吻合口溃疡发生[16]。因此我们在临床中常常会碰到纵隔胃这种患者行术后辅助放疗。目前,食管癌术后放疗的研究主要集中在针对于患者治疗后失败模式指导靶区勾画等方面,而关于放射性损伤影响靶区勾画的相关研究较少[16]。纵隔胃患者在术后放疗过程中,残胃位于照射靶区范围内较多,其可能出现比较严重的放射性损伤,我们利用治疗计划系统分析了2种靶区勾画方式对纵隔胃的剂量学影响,从中我们可以发现,扩大野照射组发生≥2级放射性胃损伤的风险较对照小野照射组明显升高,在临床决策中其可能导致靶区勾画的调整,尤其是对T4期患者。目前关于食管癌术后瘤床复发风险与放射性胃损伤相关性的报道较少。对于T4期患者我们是扩大照射野,包全瘤床,从而减少复发;还是缩小照射野,减少胃损伤,这需要我们根据临床经验结合患者情况权衡利弊。
对于T4期食管癌,我们可通过多学科综合治疗模式,外科医师选择恰当的手术方式,减少残胃在靶区内的范围及照射靶区的适当调整来减少放射性胃损伤,同时我们可以利用DVH图来评价放射性胃损伤的发生风险,进一步调整放疗计划,但有待于进一步研究。
参考文献:
[1] 肖泽芬,杨宗怡,梁军,等.食管癌根治术后预防性放射治疗的临床价值[J].中华肿瘤杂志,2002,24(6):608-611.
[2] 陈俊强,潘建基,陈明强,等.胸段食管鳞癌淋巴结转移数和区域与术后放疗价值的临床研究[J].中华放射肿瘤学杂志,2010,19(2):105-109.
[3] 古亮,刘阳晨,叶宏勋,等.不同位置胸腔胃在食管癌术后放疗中的剂量分析[J].肿瘤基础与临床,2015,28(4):317-319.
[4] BARRETO JC, POSNER MC.Transhiatal versus transthoracic esophagectomy for esophageal cancer[J].World J Gastroenterol,2010,16(30):3804-3810.
[5] SCHREIBER D, RINEER J, VONGTAMA D, et al.Impact of postoperative radiation after esophagectomy for esophageal cancer[J].J Thorac Oncol,2010,5(2):244-250.
[6] 陈凯,车嘉铭,臧旺福.食管癌术后预防性放疗的临床价值[J].中华临床医师杂志:电子版,2011,5(12):3544-3546.
[7] 刘明,李彩英,周道安,等.食管癌根治术后纵隔淋巴结转移的特点[J].中华放射肿瘤学杂志,2001,10(2):83-84.
[8] 刘俊, 吕长兴, 王家明,等. 104例胸段食管癌左胸路径术后局部复发规律及放疗靶区范围探讨[J].中华放射肿瘤学杂志,2013,22(2):111-114.
[9] 徐靖, 昊慧, 卢晓旭,等. 胸段食管癌术后预防性照射的预后分析[J].中华放射肿瘤学杂志,2015,42(1):33-35.
[10] 肖泽芬,杨宗怡,王绿化,等.食管癌术后淋巴结转移对生存率的影响和放疗的意义[J].中华肿瘤杂志,2004,26(2):112-115.
[11] 葛红,蒋月,刘劲松.胸段食管鳞癌术后放疗靶区的确定[J].临床肿瘤学杂志,2005,10(5):526-527,544.
[12] WYSOCKA B, KASSAM Z, LOCKWOOD G,et al.Interfraction and respiratory organ motion during conformal radiotherapy in gastric cancer[J].Int J Radiat Oncol Biol Phys,2010,77(1):53-59.
[13] FENG M, NORMOLLE D, PAN CC, et al.Dosimetric analysis of radiation-induced gastric bleeding[J].Int J Radiat Oncol Biol Phys,2012,84(1):e1-e6.
[14] YOON H, OH D, PARK HC,et al. Predictive factors for gastroduodenal toxicity based on endoscopy following radiotherapy in patients with hepatocellular carcinoma[J].Strahlenther Onkol,2013,189(7):541-546.
[15] 沈文斌,高红梅,曹彦坤,等. 食管癌根治性术后预防性IMRT所致放射性胃炎的剂量学研究[J].中华放射肿瘤学杂志,2016,25(8):818-822.
[16] 任宾,张双平. 管状胃在食管癌手术中的应用研究[J].中国药物与临床,2016,16(1):109-110.
