β2-微球蛋白血清质控物的制备及评价
2018-04-16郝庆钦许友山钱惠忠
郝庆钦,高 云,许友山,钱惠忠
(1.无锡市红十字中心血站检验科,江苏无锡 214000; 2.河南省肿瘤医院/郑州大学附属肿瘤医院检验科,郑州 450008)
β2-微球蛋白(β2-microglobulin,β2-MG)是由机体有核细胞合成的一种小分子量血清蛋白质,可自由通过肾小球滤过膜,最终约99.9%通过近端小管重吸收[1]。在健康个体中β2-MG含量较低且恒定,基本不受年龄、性别、机体肌肉组织含量等方面因素的影响。近年来,β2-MG被认为是反映早期肾功能损伤极灵敏标志物,尤其对于糖尿病肾病、高血压肾病、红斑狼疮肾炎的早期诊断具有重要的临床价值[2,3]。此外,也被广泛应用于多种恶性肿瘤的早期辅助诊断、预后评价和复发监测[4~6]。为确保β2-MG检测结果的准确性,必须有效地进行质量控制。由于本实验室β2-MG室内质控物主要依赖进口,价格较贵,因此我们应用混合人血清自制正常和病理浓度范围质控物,并对其均匀性和稳定性进行评价。
1 材料和方法
1.1混合血清制备收集我院2016年1月肿瘤患者血清,要求外观清澈透明,无溶血、脂血、黄疸,HBV,HCV,HIV以及梅毒抗体等感染指标均阴性。加叠氮钠至终浓度0.02%,3 000 r/min离心15 min去除沉淀,经粗滤后再用0.22 μm滤膜过滤,分装不同条件下保存,300 μl/管。整个混合分装过程均在无菌环境中操作。
1.2主要仪器与试剂C501全自动生化分析仪及配套的β2-微球蛋白免疫比浊法检测试剂盒(罗氏诊断有限公司)、硝酸纤维素滤膜,10%叠氮钠母液(上海铭博生物科技有限公司)。分析前对仪器进行校准,并测定质控品,在控后进行样品测定。
1.3均匀性检验参照文献[7]随机抽取10支质控物进行均匀性评价,每支重复测定3次。
1.4稳定性检验采用同步实验设计进行稳定性检验[8],设计以下“温时”,分别为液氮(参比温度和起始点);-80℃储存1,3,6,9,12个月;-20℃储存0.5,1,2,3,4,6个月;4℃储存1,3,5,7,14,28天;25℃储存1,3,5,7天;37℃储存1,2,4,6,8,14 h。不同温时的样品在储存时间到期时各抽取1管转移至液氮中。稳定性试验结束后,将上述所有样品从液氮中取出,室温复融、混匀后同时检测,每支重复测定2次。另外将置于-20℃保存的样品反复冻融5次,检测结果与初始检测结果进行比较,分析反复冻融对稳定性的影响。
1.5统计学分析采用SPSS17.0进行数据处理,均匀性检验采用单因素方差分析,稳定性分析采用线性回归系数的t检验;多组间均数比较符合方差齐性后采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1均匀性检验见表1。2个浓度水平样本单因素方差分析表明,同浓度质控物样本内和样本间的差异均无统计学意义(F=0.699,2.091,P>0.05),故认为制备的质控物均匀性良好。
表1
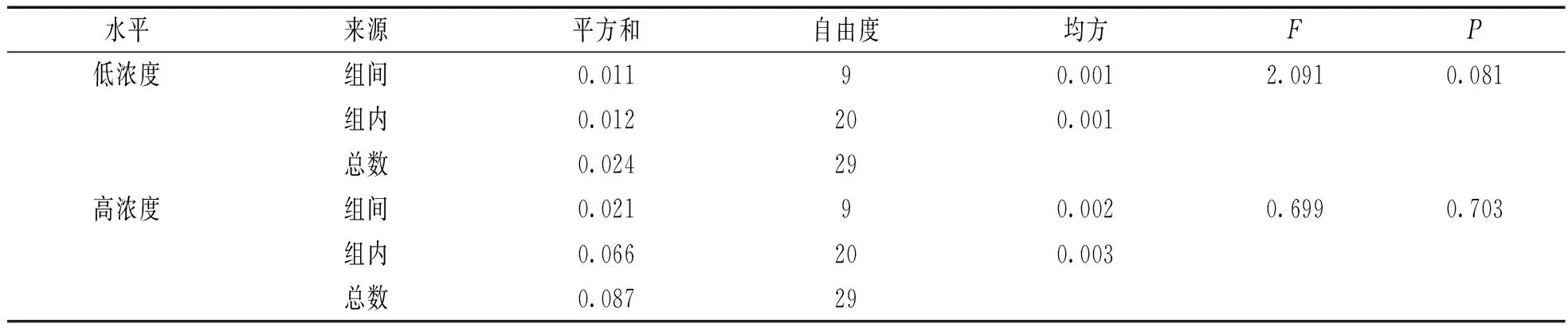
β2-MG质控物均匀性评价的单因素方差分析结果
2.2稳定性检验本研究数据显示可采用线性回归模型进行分析[9],以时间为X轴,测定值为Y轴,计算各温时下回归参数。对斜率b进行t检验,若P> 0.05,则表示差异不具有显著性,可认为稳定。稳定性检验结果见表2,3,4。研究显示制备的β2-MG质控物在-80℃储存条件下浓度随着保存时间延长不存在趋势性变化(t=-0.96,0.01,均P>0.05),至少稳定1年;-20℃储存条件下低浓度至少稳定半年(t=0.26,P>0.05),高浓度至少稳定4个月(t=-2.68,P>0.05);4℃储存条件下至少稳定28天(t=-1.86,-2.44,均P>0.05)。但在室温条件下不稳定,并随时间逐渐降低,低浓度至少稳定1周(t=-1.76,P>0.05),高浓度至少稳定5天(t=-2.64,P>0.05)。另外热稳定性评估表明自制的β2-MG质控物可在37℃至少稳定12 h(t=1.60,0.64,均P>0.05)。反复冻融5次后两种水平的质控物浓度同初始浓度无显著差异(F=1.699,P=0.23;F=1.543,P=0.26)。
表2
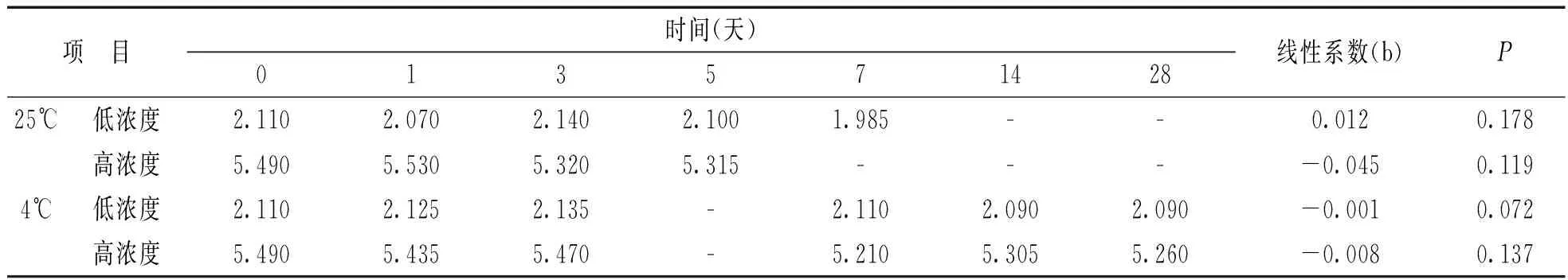
β2-MG质控物短期稳定性评价结果(mg/L)
表3
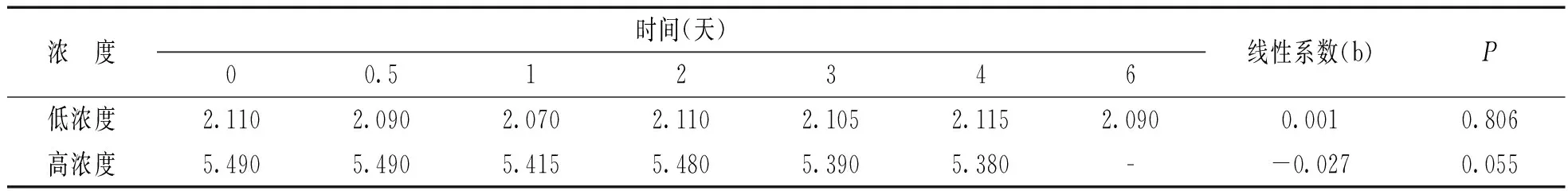
-20℃保存β2-MG质控物稳定性评价(mg/L)
表4

-80℃保存β2-MG质控物稳定性评价(mg/L)
3讨论室内质量控制是实验室管理最基本措施,是保证相关检验项目质量的重要手段,而质控品是该检测项目质控工作的物质基础。现阶段我室β2-MG室内质控采用罗氏诊断试剂盒配套的质控品,为节省成本,采用混合血清自制质控物,并依据较为严格的标准物质的评价指南或文件对其进行均匀性及稳定性评价。
作为较理想的临床化学质控品至少应具备以下一些特性:①人血清基质,分布均匀;②无传染性;③添加剂和调制物的数量少、对结果影响小;④瓶间变异小;⑤冻干品复溶后稳定;⑥到实验室后的有效期应在1年以上[10]。本实验室参考罗氏β2-MG质控品浓度水平,采用无传染性人混合血清,仅添加终浓度为0.02%叠氮钠防腐,经过过滤除菌制备β2-MG质控物,其成分、性状与临床样本高度一致,从而有效消除基质效应带来的分析干扰。
均匀性和稳定性是标准物质的重要特性[11],对于质控物同样要进行均匀性评价,均匀性评价合格后再进行稳定性评价。本研究采用单因素方差分析评价,结果表明质控物均匀性良好,瓶间变异小。稳定性评价主要有两种方案:经典稳定性研究和同步稳定性研究[9]。同前者相比,同步稳定性研究周期较长,风险大,但由于同时分析所有温时下的样品,因此检测系统的分析误差更小[9]。另外在稳定性研究时,不可直接采用线性模型进行稳定性检验,应依据待测物的稳定性变化曲线,否则可能产生相反的结论。本研究中我们采用同步稳定性研究方法评价,结果发现自制的质控物反复冻融5次或37℃放置12h对检测结果无影响;-20℃储存条件下至少稳定4个月,4℃储存条件下至少稳定28天,室温条件下至少稳定5天,短期稳定性能满足日常使用需要;长期稳定性研究发现自制质控物-80℃储存性状至少稳定1年,因此可满足实验室长期有效的室内质量控制要求。
基于以上研究,本室自制的质控物性质与临床标本高度一致,材料易取,制备过程简单,而且均匀性、稳定性符合要求。将其应用于室内质控,不仅可降低实验室成本,而且有利于β2-MG检测的质量控制和质量评价。
参考文献:
[1]袁学华,张薇薇,李权伦,等.血清视黄醇结合蛋白,胱抑素C及β2微球蛋白的联合检测在妊娠期糖尿病早期肾损害诊断中的临床意义[J].现代检验医学杂志,2017,32(2):106-109.
Yuan XH,Zhang WW,Li QL,et al.Clinical significance of combined detection of serum retinal-binding protein,cystatin C and β2-micoglobuimin in diagnosis of early renal injures of gestational diabetes mellitus[J].Journal of Modern Laboratory Medicine,2017,32(2):106-109.
[2]甘继红,常琳.β2-微球蛋白糖化血红蛋白和血清胱抑素C的联合检测在糖尿病肾病中的临床意义[J].国际检验医学杂志,2015,36(12):1723-1724,1727.
Gan JH,Chang L.The clinical significance of joint detection of β2-MG,glycated hemoglobin and cystatin C in early diabetic renal damage[J].International Journal of Laboratory Medicine,2015,36(12):1723-1724,1727.
[3]Zeng X,Hossain D,Bostwick D,et al.Urinary β2-microglobulin is a sensitivie indicator for renal tubular injury[J].Scholarena Case Reports,2014,1(1):103.
[4]Li K,Du H,Lian X,et al.Characterization of β2-microglobulin expression in different types of breast cancer[J].BMC Cancer,2014,14(1):750.
[5]Montalban C,Diaz-Lopez A,Dlouhy I,et al.Validation of the NCCN-IPI for diffuse large B-cell lymphoma(DLBCL):the addition of beta2 -microglobulin yields a more accurate GELTAMO-IPI[J].British Journal of Haematology,2017,176(6):918-928.
[6]Sun J,Yang ZL,Miao X,et al.ATP5b and β2-microglobulin are predictive markers for the prognosis of patients with gallbladder cancer[J].Journal of Molecular Histology,2015,46(1):57-65.
[7]中国合格评定国家认可委员会.能力验证样品均匀性和稳定性评价指南CNAS-GL03[S].北京:中国标准出版社,2006.
China National Accreditation Service for Conformity Assessment.Guidance on evaluating the homogeneity and stability of samples used for proficiency testing CNAS-GL03[S].Beijing:China Standard Press,2006.
[8]ISO.Reference materials-General and statistical principles for certification[J].Geneva,Switzerland:ISO,Guide 35,2006.
[9]周伟燕,张传宝,马嵘,等.高密度与低密度脂蛋白胆固醇参考物质在4种常规检测系统上的同步稳定性研究[J].中华检验医学杂志,2014,37(7):522-526.
Zhou WY,Zhang CB,Ma R,et al.The isochronous stability study of HDL-C and LDL-C reference material measured by four routine test systems[J].Chin J Lab Med,2014,37(7):522-526.
[10]王治国,李小鹏,武平原.临床检验定量测定室内质控系统的建立[J].检验医学,2004,19(1):6-9.
Wang ZG,Li XP,Wu PY.The establishment of internal quality control system for clinical laboratory quantitative determination[J].Medical Journal,2004,19(1):6-9.
[11]房亚哲,马怀安,郭楠,等.C反应蛋白冰冻混合人血清定值校准品的制备研究[J].中华检验医学杂志,2014,37(11):832-835.
Fang YZ,Ma HA,Guo N,et al.Preparation of the mixed serum calibrators for C-reactive protein[J].Chin J Lab Med,2014,37(11):832-835.
