柚皮素脂质体的制备及体外释放度的研究
2018-04-13王晓晨刘丁铭王建筑
王晓晨 陈 莹 刘丁铭 王建筑
(泰山医学院药学院,山东 泰安 271016)
柚皮素(naringenin)是一种二氢黄酮类化合物,广泛存在于芸香科植物中。目前研究发现柚皮素具有抗肿瘤、抗病毒、保护肝功能等多种药理活性[1]。但由于柚皮素分子结构中含有的多个酚羟基易氧化变质,并且由于该药物水溶性低,所以并不适合直接制备成注射剂进行给药,并且由于其脂溶性也较差,所以口服给药时胃肠道吸收差,其绝对生物利用率极低,所以也不适合直接制成口服制剂给药,柚皮素的这些结构性质限制了其临床应用。脂质体(liposome)是由磷脂、胆固醇等脂类材料分散于水中形成的一种封闭囊泡,具有与细胞膜相类似的磷脂双分子层结构[2],此结构可使不同溶解性的药物分布于双分子层之间或内水相[3]。20世纪70年代初,脂质体开始作为药物载体应用于药物传递[4]。脂质体相比于其他给药系统具有以下优势:能增强难溶性药物的生物利用度,特别是水难溶性的药物;能提高包载药物的稳定性,并且具有被动靶向性,可以提高某些药物的治疗指数[5];制备时所用材料有较好的细胞亲和性和生物降解性。将柚皮素制备成脂质体后进行给药,可以提高柚皮素的溶解性,使其体内分布具有被动靶向性,能够达到更好的治疗效果。本实验采用乙醇注入法制备柚皮素脂质体混悬液,来提高药物的生物利用度,延长药物的生物半衰期,并且有利于工业大规模生产[6]。
1 材料
柚皮素(质量分数≥98%);大豆磷脂(上海艾韦特医药科技有限公司,PC含量>95%);胆固醇(上海金穗生物科技有限公司);十二烷基硫酸钠(天津博迪化工股份有限公司);葡聚糖凝胶G50(如吉生物科技),其他试剂均为国产分析纯。
高效液相色谱仪(UV230Ⅱ,大连依利特分析仪器有限公司);马尔文粒径仪(马尔文仪器公司(中国));光学显微镜(NiKon E100,上海普赫光电科技有限公司); GL-25M 型高速冷冻离心机( 长沙骏逸实验仪器有限公司)。
2 试验方法
2.1 柚皮素脂质体的制备
用适量乙醇溶解处方量柚皮素、胆固醇和磷脂后,将此混合液通过蠕动泵匀速(0.6 ml/min)缓慢的注入到纯化水中,置于恒温磁力搅拌器中,维持恒温55℃搅拌一定时间,然后用旋转蒸发仪挥去乙醇,在室温下继续磁力搅拌30 min完全除去乙醇,将所得到的混悬液用纯化水定容至10ml,即得脂质体混悬液。同法制备不加药物的空白脂质体。
2.2 脂质体包封率和载药量的测定
2.2.1高效液相色谱条件
大连依利特BDSHYPERSILC18(4.6 mm×250 mm,5 μm);流动相:乙腈∶纯化水(60∶40);流速:1 ml/min;柱温:室温;检测波长:288 nm;进样量:20 μl。
2.2.2柚皮素标准曲线的制备
精密称取10.01 mg柚皮素对照品,用甲醇溶解制成400 μg·ml-1的储备液。用甲醇将上述储备液分别稀释成浓度为4 μg·ml-1、16 μg·ml-1、24 μg·ml-1、32 μg·ml-1、48 μg·ml-1、64 μg·ml-1、80 μg·ml-1的系列溶液,并分别取20 μl进样高效液相色谱系统,以峰面积(Y)对浓度(C)进行线性回归,得到浓度对峰面积的线性回归方程为Y=48.386C+2.3763,r2=0.9993。结果表明,在4~80 μg·ml-1的范围内柚皮素的浓度与色谱峰面积线性关系良好,经考察,精密度较好。
2.2.3脂质体包封率和载药量的测定
采用微柱离心法来分离柚皮素脂质体及游离药物柚皮素。精密量取脂质体混悬液0.2 ml至凝胶微柱的顶端,1500 r·min-1离心3 min,重新加入0.5 ml纯水再次以1500 r·min-1离心3 min,重复2次,收集3次的洗脱液,加甲醇破坏脂质体后, 3000 r·min-1离心5 min,按“3.2.1”项下色谱条件进样,将峰面积带入上述标准曲线计算药物浓度,并计算药物的包封率EE%和载药量DL%。
2.3 脂质体粒径的测定和外观形态观察
取脂质体适量,适当稀释后,用马尔文激光粒度分析仪进行测定其粒径和多分散指数PDI。
取脂质体适当稀释后,取少量滴加于铜网上,3%磷钨酸钠溶液负染后,透射电镜观察脂质体的形态。
2.4 脂质体稳定性的测定
取上述份柚皮素脂质体混悬液1000 r·min-1离心3 min,去除未包封的药物结晶,将其放入37 ℃空气浴震荡器100 r·min-1下震摇,每隔两小时取样并1000 r·min-1离心并显微镜下观察有无药物渗漏形成药物结晶(因柚皮素在水中的溶解度低,渗漏后易形成药物的结晶)。
2.5 药物体外释放的测定
采用体外透析法来测定柚皮素脂质体的体外释放过程。分别取原料药混悬液和脂质体混悬液(均含柚皮素约0.5 mg)置于透析袋中,扎紧两端,置锥形瓶中,以100 ml纯化水为释放介质, 37 ℃水浴下100 r·min-1搅拌,分别于0.25 h、0.5 h、1 h、1.5 h、2 h、3 h、4 h、5 h、6 h、8 h、10 h、24 h取样3 ml,微孔滤膜过滤后取续滤液进行测定,同时补加同温同体积的释放介质。
3 实验结果与讨论
3.1 包封率和载药量的测定
根据“2.2.3”项下方法,测得不同处方的柚皮素脂质体包封率和载药量如表1所示。
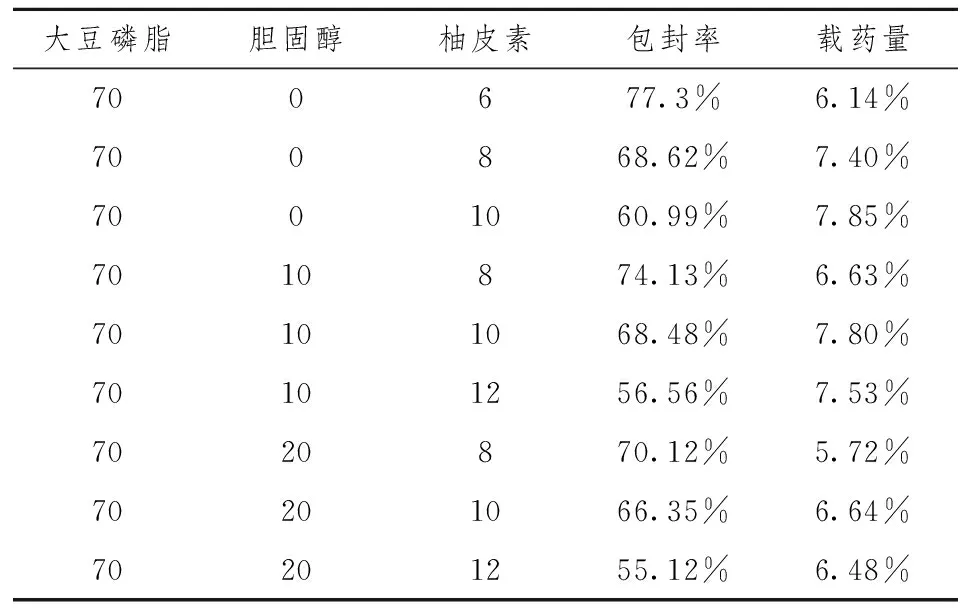
表1 脂质体的包封率和载药量
由表1数据可得,制备的柚皮素脂质体包封率在55%~77.3%之间,药物的载药量在6.14%~7.8%之间,说明制得的柚皮素脂质体有较高的包封率和载药量。
3.2 稳定性的测定
将脂质体置于37℃的空气浴摇床中震摇。不同时间取出观察其稳定性,其中1号、2号、3号震摇4h时即出现明显药物的针状结晶,说明未加胆固醇的脂质体膜非常不稳定,极易发生药物的渗漏。7~9号脂质体在10 h时开始出现少量的药物结晶,而4~6号脂质体24 h才出现少量结晶,说明脂质体中适量胆固醇的加入,有利于增加脂质体膜的柔韧性和流动性,使脂质体的稳定性增强,减少药物的渗漏。
3.3 脂质体粒径的测定
测得脂质体的粒径为120.2 nm,多分散指数PDI为0.203。结果如下图1所示
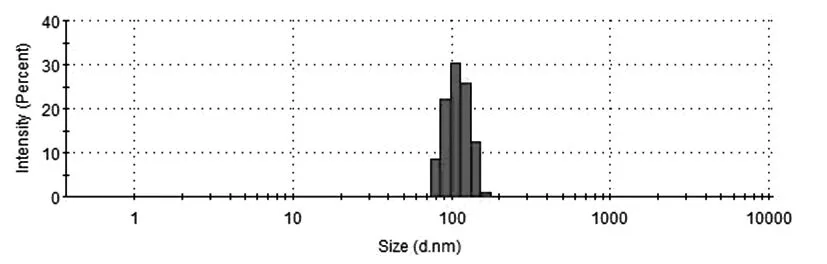
图1 脂质体的粒径分布图
3.4 药物体外释放的测定
根据“2.5药物体外释放的测定”项下方法,测定样品溶液中柚皮素浓度后计算不同时间点柚皮素脂质体中的柚皮素体外累积释放百分率,以时间为横坐标,柚皮素累积释放百分率为纵坐标,绘制柚皮素脂质体的体外释放曲线,如图2。
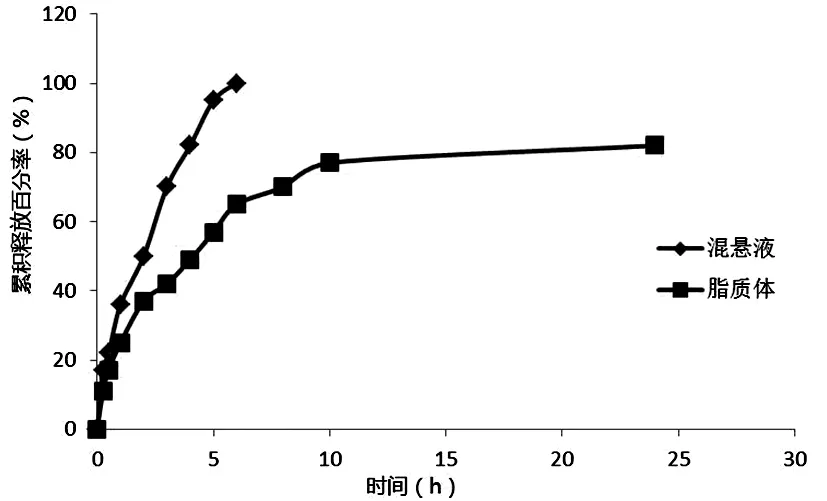
图2 柚皮素原料药混悬液和脂质体的体外释放曲线
由图2可知,柚皮素原料药在5 h时释放即达到90%以上,而柚皮素脂质体12 h累积释放量才接近80%,说明柚皮素脂质体具有明显的缓释效果。
4 结 论
在脂质体众多制备方法中,经典的薄膜分散法适合于脂溶性药物,但所制备的脂质体粒径往往较大[7],且柚皮素脂溶性较差,并不适合用于柚皮素制备脂质体。水溶性药物制备脂质体适合选择逆向蒸发法,但制备过程往往需要使用氯仿等毒性较大的有机溶剂。柚皮素在醇中有较大的溶解度,并且乙醇注入法制备过程简单,操作条件温和,有利于保持药物稳定性。柚皮素属于二氢黄酮类化合物,溶解性较差,限制了其临床应用,将柚皮素采用乙醇注入法制备成脂质体后,可以提高柚皮素的溶解性和生物利用度,增加疗效[8]。
在测定包封率和载药量时,分离脂质体与游离性药物是关键步骤。目前,常用的方法有离心法、超滤法、微柱离心法,透析法等。本实验采用微柱离心法是利用了微柱中的葡聚糖凝胶能够吸附游离的柚皮素药物,而其中的脂质体则直接随洗脱溶剂流出,因此可以有效地将游离药物与脂质体分离[9]。通过预实验研究发现,采用SephadexG-50微柱,以纯化水洗脱3次时,可以基本上将药物和脂质体分离,所以本实验选择此法来测定柚皮素脂质体包封率和载药量。
制备过程中发现药物浓度对柚皮素脂质体的包封率影响较大,因此可采用适当的方法进行优化。试验结果表明,磷脂、药物、胆固醇在7∶1∶1(w/w)时,制备的脂质体包封率最高,制备的柚皮素脂质体粒径在120 nm左右,粒径分布均匀(PDI=0.203)。本实验结果表明乙醇注入法用于制备柚皮素脂质体工艺方法简单可行,重现性好,制备过程中避免了使用氯仿等毒性大的有机溶剂,易于实现大规模生产;所制得的柚皮素脂质体药物包封率较高、粒径较小且均匀、稳定性高。
参考文献:
[1]季鹏,赵文明.柚皮素脂质张志勤,隋丽华,韩国柱.中草药脂质体的研究进展[J].中南药学,2011,9(10):775-779.
[2]Bangham A D, Standish M M, Watkins J C .Diffusion of univalent inos across the lamella of swollen phospholipids[J] .J M o l Biol , 1965 , 13:238.
[3]蒋桂秀,蒋满州,奉建芳.羟基喜树碱脂质体制备工艺的研究[J].中南药学,2012,10(3):161-165.
[4]Rahman Y E, Cerny E A , Tollaksen S L .Liposome encapsulated actinomy- cin D :Potential in cancer chemo-therapy[J] .Proc Soc Ex p Biol Med, 1974, 146(4): 1173.
[5]季鹏,赵文明.柚皮素脂质体冻干粉的制备及其药效学评价[J].中国医学科学院学报,2015,37(2):208-214.
[6]脂质体的制备及大鼠肺部给药药动学研究[J].中成药,2015,37(8):1699-1703.
[7]郑佳彤,陈奋,杨星钢,等.颌面血管瘤局部注射用平阳霉素脂质体的制备和优化[J].中南药学,2015,13(7):685-689.
[8]高飞,王东凯,张春叶,等.乙醇注入法制备水飞蓟宾脂质体及其质量评价[J].中国药剂学杂志,2008,6(6):301-308.
[9]龚素娟,蒋艳博,杨琳琳,等.冬凌草甲素脂质体的制备及影响因素考察[J].沈阳药科大学学报,2010,27(2):87-92.
