南通市婴幼儿腹泻患者空肠弯曲菌监测结果和耐药性分析*
2018-04-13许海燕熊海平
许海燕,熊海平,苏 婧,汤 敏
(南通市疾病预防控制中心微生物检验科,江苏226007)
弯曲菌(Campylobacter)是一类微需氧、不分解糖、氧化酶阳性、菌体弯曲呈弧形、S形或螺旋状,有动力的革兰阴性菌。弯曲菌属包括16个种和8个亚种,其中12个种可引起人类疾病。空肠弯曲菌是人类腹泻最常见的病原菌之一,其次是结肠弯曲菌,其它弯曲菌偶尔致病[1]。弯曲菌是重要的人兽共患病原菌,人通过接触动物或食入被污染的牛奶、水等食物而感染。弯曲菌进入肠道后侵入、定居和繁殖于宿主的肠黏膜上皮细胞而导致人类疾病[2]。弯曲菌引起的肠炎以散发的急性、自限性肠炎为主,对婴幼儿、老人或AIDS病等免疫力低下者危害较大,严重者可致死。楼金吐等[3]曾报道,23 431例婴幼儿腹泻患儿的粪便标本中共检出2 424份空肠弯曲菌阳性标本,阳性率高达10.3%。由此可见,婴幼儿空肠弯曲菌感染率较高,本调查采集2013—2016年南通市两家医院门诊5岁以下腹泻患儿的粪便样品1 257份应用荧光定量PCR技术结合细菌分离鉴定,对该人群腹泻患者的空肠弯曲菌感染及耐药状况进行监测分析,为制定本地区婴幼儿空肠弯曲菌病防治措施提供数据。
1 材料与方法
1.1 材料
1.1.1标准菌株:空肠弯曲菌CICC22936、大肠埃希菌ATCC29213(中国工业微生物菌种保藏管理中心)。
1.1.2检测试剂:空肠弯曲菌荧光定量PCR检测试剂盒(北京卓诚惠生生物科技有限公司),密封培养罐、微需氧产气袋(MGC公司),弯曲菌培养基mCCDA琼脂(含SR0155E)、布氏肉汤(含SR0208E)和药敏纸片(OXOID公司),常规试剂为国产分析纯试剂。所有试剂均在有效期内使用。
1.1.3检测设备:HS-200B恒温摇床(上海和呈仪器制造有限公司),ABI7500荧光PCR仪(美国应用生物系统公司)。
1.1.4样品信息:共采集南通市A、B两家医院门诊5岁以下腹泻患儿的粪便样品1 257份,其中A医院366份,B医院891份,A医院为县级医院,B医院为地市级医院,两家医院的选择采取随机的方式。第一季度256份,第二季度326份,第三季度394份,第四季度281份。腹泻病例定义:每日排便3次或3次以上,且粪便性状异常(稀便、水样便、粘液便或脓血便等)。在发病早期及使用抗生素之前采集腹泻患儿肛拭子样本,采集后将肛拭子直接放入1~2mL布氏肉汤中,室温或冷藏运回实验室,所有样品均于24 h内送达实验室并完成检测。
1.2 检测方法
1.2.1样品处理:取2mL已混有标本的布氏肉汤加入4mL含抗生素和生长促进剂的布氏肉汤中充分混匀,置微需氧环境(5%O2、10%CO2和 85%N2)下,(42±1)℃振摇培养 24h。
1.2.2DNA制备:取上述增菌培养液1 mL,13 000g离心2 min弃上清,加入200μL DNA提取液,混合均匀,煮沸10 min,冷却后16 000g离心2 min,取上清液作为空肠弯曲菌鉴定PCR模板。
1.2.3荧光定量PCR:严格按照空肠弯曲菌核酸测定试剂盒说明书操作。
1.2.4细菌分离鉴定:在进行荧光定量PCR实验的同时参照GB4789.9-2014分离鉴定空肠弯曲菌[4]。取PCR阳性增菌液分别划线接种于mCCDA平板,微需氧条件下(42±1)℃培养48h。观察菌落形态,挑取扁平、湿润、有光泽和边缘整齐的菌落,再次接种于mCCDA平板,直至得到纯的培养物后进行鉴定。
1.2.5药敏试验:采用2012年美国临床实验室标准化研究所(CLSI)推荐使用的琼脂扩散法。将相当于0.5麦氏单位浓度的纯菌悬液用灭菌棉拭子均匀涂布在4 mm厚的MH平板上,放置5min,用灭菌镊子将抗生素纸片贴附在琼脂表面,42℃孵育24h后观察有无抑菌环及其大小,抑菌环的边缘以肉眼见不到细菌明显生长为限。分别测量各纸片抑菌环直径(mm),敏感、中敏或耐药按CLSI/NCCLS或ROSCO标准判定。
1.3统计学处理使用SPSS 19.0统计学软件处理分析数据,计数资料采用χ2检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1空肠弯曲菌荧光定量PCR检测结果1 257份腹泻病例粪便样品中42份空肠弯曲菌阳性,阳性率为3.34%。(1)不同医院检测结果:A医院366份粪便样品中11份空肠弯曲菌阳性,阳性率3.01%;B医院891份粪便样品31份空肠弯曲菌阳性,阳性率3.48%。A、B两医院阳性率的差异无统计学意义(P>0.05)。(2)不同季度检测结果:第一、二、三和四季度空肠弯曲菌阳性率分别为1.56%、2.15%、5.58%和3.20%,第三季度空肠弯曲菌阳性率高于第一和第二季度阳性率,差异有统计学意义(P<0.05),其他季度之间阳性率差异无统计学意义(P>0.05)。见表1。

表1 空肠弯曲菌荧光定量PCR检测结果
2.2空肠弯曲菌细菌分离鉴定结果对1 257份样品进行空肠弯曲菌分离鉴定,共分离鉴定出32株空肠弯曲菌,检出率为2.55%,低于荧光定量PCR的3.34%阳性率,但差异无统计学意义(P>0.05)。
2.3分离株药敏试验结果对32株空肠弯曲菌对临床常用的8大类19种抗生素进行敏感试验,仅有3种抗生素的敏感率超过80%,分别为庆大霉素81.25%、红霉素84.38%和阿齐红霉素90.63%。而耐药率在80%以上的有9种,分别为阿莫西林96.88%、头孢拉定100.00%、头孢哌酮100.00%、头孢克罗96.88%、诺氟沙星84.38%、环丙沙星87.50%、左旋氧氟沙星84.38%、萘啶酸84.38%、复方新诺明100.00%。见表2。

表2 空肠弯曲菌分离株32株药敏试验结果
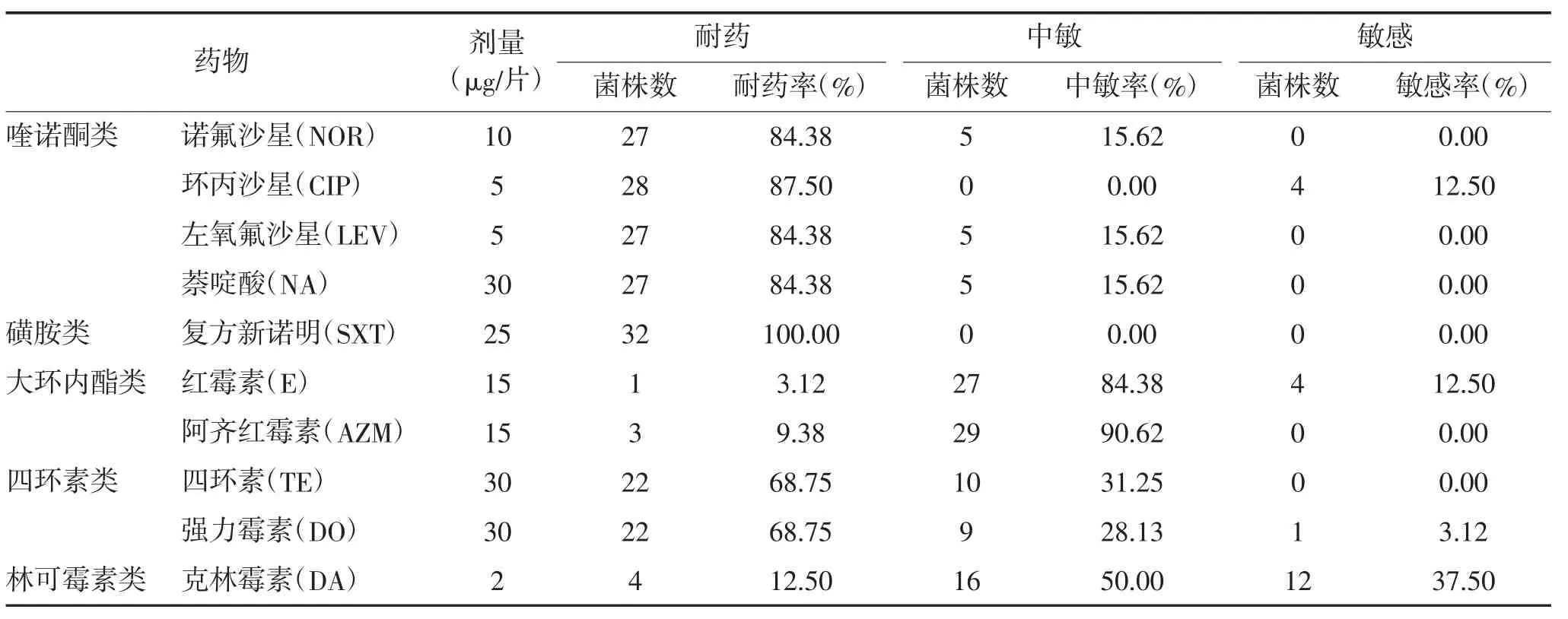
续表2 空肠弯曲菌分离株32株药敏试验结果
2.3空肠弯曲菌耐药菌株的耐药状况32株空肠弯曲菌均为多重耐药菌,对19种抗生素的耐药主要集中同时耐8种(简称8耐或8R)、11耐和12耐,占56.25%,其中11耐的菌株最多,占31.25%。
3 讨 论
弯曲菌广泛分布于自然界,可通过食物、水等传播。弯曲菌感染引起的腹泻病例数甚至超过沙门氏菌、志贺氏菌以及大肠杆菌O157:H7,成为常见的腹泻致病菌之一。发达国家的监测显示弯曲菌的易感人群为婴幼儿和成年初期[5]。2013年Tsoni等[6]报道出生15天的婴儿因感染空肠弯曲菌而引起脑膜炎的罕见病例。世界卫生组织已将弯曲菌病列为最常见的食源性传染病之一。本次监测的结果显示,南通市婴幼儿腹泻粪便中空肠弯曲菌的总体阳性率为3.34%,表明该人群存在空肠弯曲菌病的流行风险。
本调查共采集了1 257份5岁以下腹泻患儿的粪便标本,其中42份空肠弯曲菌阳性,阳性率为3.34%,而楼金吐等[3]在23 431例婴幼儿腹泻粪便标本中检测出2 424份空肠弯曲菌阳性标本,阳性率高达10.3%,与本结果差异有统计学意义(P<0.01),可能由于卫生状况、饮食结构以及饮食习惯不同所致。本次调查中336份标本来自县区A医院,891份标本来自市区B医院,空肠弯曲菌阳性率分别为3.01%、3.48%,差异无统计学意义,提示南通地区空肠弯曲菌感染的情况较为一致;但在不同季度均有空肠弯曲菌腹泻患儿,提示应加强空肠弯曲菌流行病学监测和相应的防治工作。
本研究结果显示,荧光定量PCR的阳性率3.34%,与细菌分离鉴定检出率2.55%的差异无统计学意义(P>0.05),但荧光定量PCR具有特异性强、操作简便、实验周期短的优势,因此可用于大规模实验流行病学调查。
空肠弯曲菌的耐药谱呈现出多样化和复杂化的趋势,多重耐药菌株的不断出现已成为现代社会所面临的公共健康问题之一[5]。本次调查选用临床上常用的8大类19种抗生素,对32株分离的空肠弯曲菌进行了药敏试验,结果显示空肠弯曲菌对9种抗生素的耐药率在84.38%~100%,所分离菌株均为多重耐药菌,从4耐到11耐不等,其中11耐的菌株最多,占31.25%,该结果与Pan等[7]分离自5岁以下婴幼儿腹泻患者的110株弯曲菌的部分耐药结果一致。如此严重的耐药性可能与临床及畜禽养殖业大量滥用抗生素有关,加强对抗生素使用的监管刻不容缓。
总之,南通地区5岁以下人群存在空肠弯曲菌病的流行风险,耐药状况严重,应采取包括抗生素监管等综合措施加以防控。
[参考文献]
[1]许海燕,熊海平,苏婧,等.腹泻患者空肠弯曲菌三种检测方法比较[J].中国卫生检验杂志,2013,23(13):2758-2759,2763.
[2]Kashoma IP,Kassem II,John J,et al.Prevalence and antimicrobial resistance of campylobacter isolated from dressed beef carcasses and raw milk in Tanzania[J].Microb Drug Resist,2016,22(1):40-52.
[3]楼金吐,张世新.婴幼儿腹泻病原体检测结果分析[J].浙江预防医学,2008,20(4):10-11.
[4]中华人民共和国国家卫生和计划生育委员会.GB 4789.9—2014食品安全国家标准 食品微生物学检验空肠弯曲菌检验[S].北京:中国标准出版社,2014.
[5]Allos BM.Campylobacter jejuni Infections:update on emerging issues and trends[J].Clin Infect Dis,2001,32(8):1201-1206.
[6]Tsoni K,Papadopoulou E,Michailidou E,et al.Campylobacter jejuni meningitis in a neonate:A rare case report[J].J Neonatal Perinatal Med,2013,6(2):183-185.
[7]Pan H,Ge Y,Xu H,et al.Molecular characterization,antimicrobial resistance and caco-2 cell invasion potential of campylobacter jejuni/Coli from young children with diarrhea[J].Pediatr Infect Dis J,2016,35(3):330-334.
