不同食盐添加量和蒸煮温度对猪肉糜品质的影响
2018-04-12王春彦康壮丽马汉军朱东阳宋照军高雪琴杨保进
王春彦,康壮丽*,马汉军,朱东阳,宋照军,高雪琴,杨保进
1(河南科技学院食品学院,河南 新乡,453003) 2(河南牧业经济学院食品学院,河南 郑州,450011)
近年来,我国肉制品行业取得了飞快的发展,成为最大的肉制品生产和消费国。肉糜制品在我国肉制品深加工中的地位举足轻重,其品种丰富,能够给消费者在营养、质构、风味和价格等方面提供选择。在肉糜制作和加热成熟过程中,食盐添加量和蒸煮温度对肉糜制品的品质起决定性作用。首先,食盐能够促使肌原纤维蛋白发生溶解和溶胀,较多提取肉糜中的肌原纤维蛋白,同时也能够赋予肉糜制品良好的滋味和风味[1-2]。因此,传统的肉糜制品中食盐的含量普遍比较高(质量分数2%左右),而过多的摄入食盐增加患高血压和心血管疾病的风险[3]。所以,如何减少肉糜制品中食盐含量是一个研究难点[4-5]。
在加热过程中,肉糜中提取出来的肌原纤维蛋白变性,发生聚集和交联,形成三维凝胶网络结构[6]。肉糜凝胶的品质与蒸煮温度密切相关,因为肌原纤维蛋白质热诱导凝胶的形成需要经历变性、聚集和交联3个过程。首先是蛋白质受热引起非共价键解离,改变蛋白质构象,引起蛋白质变性,变性暴露出来的蛋白质基团因交联和聚合作用而形成较大分子的凝胶体[7]。低于40 ℃时,肌球蛋白变性凝聚程度较低,而高于40 ℃,肌球蛋白凝聚成聚合体,随着温度升高,到60 ℃时已形成直径大于500 nm的聚合体[8]。也有报道发现在30 ℃,肌球蛋白重链的α-螺旋结构含量减少,到70 ℃时α-螺旋结构含量最少;在65 ℃时,表面疏水作用力最大,随着温度的升高,疏水作用力减少,主要原因是温度增加,部分疏水键参与蛋白质交联,形成网络凝胶结构[9]。因此,本实验将不同食盐添加量和蒸煮温度结合,研究两者对猪肉糜凝胶品质的影响,为降低食盐添加量,提高猪肉糜制品的品质提供理论依据。
1 材料与方法
1.1 实验材料
冷却24 h的猪后腿肉(水分为70.52%;蛋白质为20.05%;脂肪为8.08%;pH为5.75)和新鲜猪背膘(水分为8.72%;蛋白质为1.42%;脂肪为89.45%)购于新乡洪门菜市场。胶原蛋白肠衣购于中国神冠控股有效公司。
食盐为分析纯。
1.2 仪器与试剂
Stephan UMC-5C 斩拌机,德国;绞肉机,山东嘉信食品机械有限公司;CR-400色差计,日本美能达公司;Hanna pH计,意大利;T25高速匀浆器,德国IKA公司;HH-42水浴锅,常州国华电器有限公司;TA-XT.plus质构仪,英国Stable Microsystem公司;ShimadzuAUY120电子天平,日本岛津公司;HAAKE MARS流变仪,Thermo scientific;VF608灌装机, 德国;离心机,美国Beckman L-80-XP Ultracentrifuge;干燥箱,上海博讯实业有限公司。
1.3 方法
1.3.1猪肉糜的制备
所有猪肉糜均添加猪肉500 g,食盐加量分别为1%、2%和3%(质量分数)。剔除猪肉中可见的结缔组织和脂肪,使用绞肉机绞碎(6 mm孔板),用PE/尼龙真空包装袋进行分装,每袋500 g,真空包装,储存于-20℃直到加工,不得超过2周。使用前在0~4℃冷库中解冻约12 h至中心温度为0℃左右。解冻后的猪后腿肉应用如下方法进行加工,每种加工方法均重复4次:将1 000 g解冻后的猪后腿肉放入斩拌机,1 500 r/min斩拌30 s,斩拌过程中加入食盐,停3 min;再1 500 r/min斩拌30 s,停3 min;最后3 000 r/min斩拌60 s,中心温度低于10℃。加工好的猪肉糜立即使用真空灌装机进行灌装,使用18 mm的胶原蛋白肠衣。将灌装好的香肠分为16 cm的段,并称重。分别放入温度为70、80和90 ℃的水中煮制30 min。捞出放入流水中冷却中心温度至室温,4 ℃过夜冷却。
1.3.2色差的测定方法
使用色差计对熟肉糜中心部位进行测定,标准白色比色板为L*=96.86,a*=-0.15,b*=1.87。不同食盐添加量和蒸煮温度的样品测定5次。其中L*代表亮度值,a*代表红度值,b*代表黄度值。
1.3.3蒸煮得率
蒸煮得率为猪肉糜蒸煮后重量与蒸煮前重量的百分比。蒸煮得率按照公式(1)计算:

(1)
每组测定4次。
1.3.4质构的测定
不同食盐添加量和蒸煮温度的猪肉糜在室温环境中放置2 h。取蒸煮猪肉糜的中心部位,制成高20 mm,直径为25 mm的圆柱体,使用质构仪的P/36圆柱型探头进行质构测定。测试条件如下:测试前速度为2.0 mm/s,测试速度为2.0 mm/s,测试后速度为2.0 mm/s;压缩比为50%,时间5 s;触发类型:自动。得到的质构参数为:硬度(hardness):第1次压缩时使用力的最大值(N);内聚性(cohesiveness):第2次压缩曲线面积和第1次压缩曲线面积的比值;弹性(springiness):第1次压缩后样品的回复百分比[10]。
每个处理组重复6次。
1.3.5流变
不同食盐添加量和乳化工艺的肉糜使用热动态流变性使用流变仪进行测定。用35 mm不锈钢圆形平板探头,间隙为0.5 mm,肉糜均匀涂抹在2个平板之间,外周涂一层薄薄的硅油,防止水分蒸发。测定方法为20 ℃保温10 min,然后从20 ℃到 95 ℃,加热速率为2 ℃/min。在加热过程中,在一个振荡模式和一个固定的频率为0.1 Hz下对样品进行连续剪切。在此过程中,测量储能模量(G′)的变化。每个处理组测量3次。
1.3.6统计方法
本实验所有处理重复4次。应用软件SPSS v.18.0(SPSS Inc., USA)进行统计分析,使用单因素方差分析(ANOVA)的方法对数据进行分析,当p<0.05时认为组间存在差异显著,p<0.01认为组间存在差异极显著。
2 结果与分析
2.1 色差
由表1可知,不同食盐添加量和温度蒸煮猪肉糜的色差影响显著。在相同温度下,随着食盐添加量的增加L*值显著(p<0.05)升高,b*值显著(p<0.05)下降,而a*值差异不显著(p>0.05)。TOBIN等[11]报道了1%(质量分数)食盐添加量法兰克福香肠的色泽较2%(质量分数)食盐添加量的色泽黑一些。KANG等[1]报道了增加食盐添加量从0.5%到3%(质量分数),L*值显著(p<0.05)升高。在相同食盐浓度下,随着温度的升高,在80 ℃时L*值最高(p<0.05),而90 ℃时下降,与70 ℃时差异不显著(p<0.05)。a*值在70 ℃时值最大,随着温度的升高而降低,b*值随着温度的升高而增加。在所有蒸煮猪肉糜中,80 ℃时2%(质量分数)食盐和3%(质量分数)食盐的L*值最高,70 ℃和90 ℃时1%(质量分数)食盐的L*值最低(p<0.05);70 ℃时所有食盐添加量蒸煮猪肉糜的a*值最高,90 ℃时最低(p<0.05)。因为生猪肉糜中肌红蛋白的含量是一定的,变性肌红蛋白含量为0;温度升高到65~80 ℃时,肌红蛋白变性生成变性珠蛋白高铁血色原,当蒸煮中心温度达到50 ℃时,变性肌红蛋白含量为15%左右;当中心温度达到83 ℃时,变性肌红蛋白上升到80%以上[12-13]。所以升高温度造成蒸煮猪肉糜的a*值降低,L*值在80℃时最高。
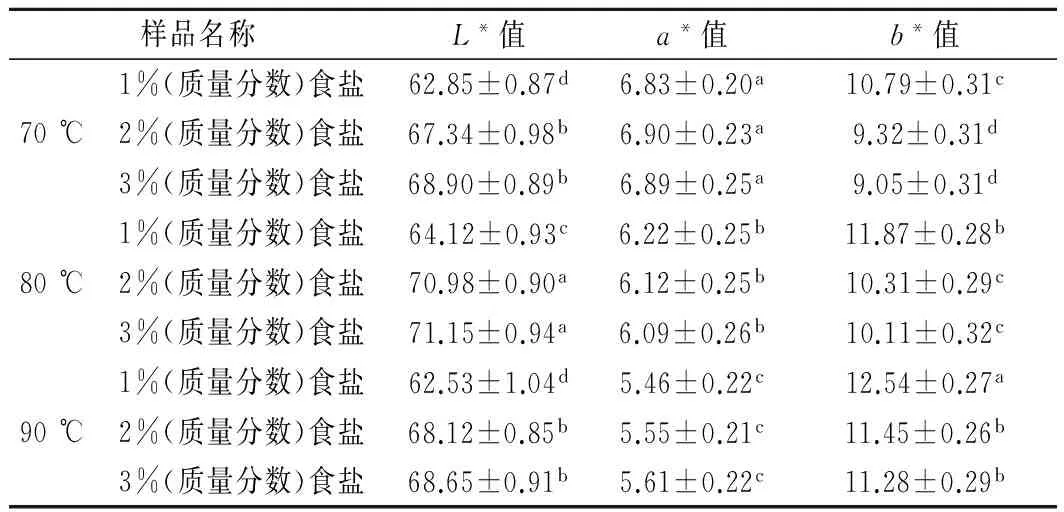
表1 不同食盐添加量和蒸煮温度猪肉糜的色差(L*, a*, b*值)Table 1 Effect on color (L*, a*, b* value) of cookedbatters product with various salt contents at differenttemperature
注:a-d不同字母表示纵列存在显著差异(p<0.05)。每组数据包含平均值+/-标准差,n=4。
2.2 蒸煮得率
保水性是猪肉糜凝胶的重要指标,蒸煮得率能够反映猪肉糜保水性的优劣。由图1可知,不同食盐添加量和温度对猪肉糜的蒸煮得率影响显著。在相同温度下,蒸煮得率随着食盐添加量的增加而升高。这是因为增加食盐添加量,提高盐溶性蛋白的溶出量,在加热过程中形成良好的三维网状结构,提高肉糜凝胶的保水性[1]。CARDOSO等[14]报道了增加食盐添加量,提高盐溶性蛋白的溶解度,降低肉糜的蒸煮损失。TOTOSAUS和PEREZ-CHABELA[15]报道了减少肉糜中食盐添加量,降低肌原纤维蛋白的提取量和溶解度,降低肉糜的蒸煮得率。1%(质量分数)食盐添加量时随着温度的升高而降低(p<0.05),90 ℃时猪肉糜的蒸煮得率最低;但食盐添加量2%和3%(质量分数)时,70 ℃时猪肉糜的蒸煮得率最高,80 ℃和90 ℃时显著降低(p<0.05),因为升高温度,蛋白质之间的聚集增加,凝胶结构变得粗糙,保水性降低[16]。而80 ℃和90 ℃时差异不显著(p>0.05),因为保水性与凝胶结构相关,较差的凝胶结构导致水分的大量渗出,致密的凝胶结构提高凝胶的保水性[17],增加食盐添加量,凝胶强度提高,在一定的温度范围内能够维持凝胶的结构和保水性。

图1 不同食盐添加量和蒸煮温度猪肉糜的蒸煮得率Fig.1 Cooking yield (%) of pork meat batters made withvarious amounts of added NaCl at different temperature注:每个值是平均值± SD, n=4。a-c不同字母表示存在显著差异(p<0.05)。
2.3 质构
食盐添加量和蒸煮温度影响蒸煮肉糜的质构(表2)。在相同蒸煮温度下,增加食盐添加量显著(p<0.05)提高蒸煮肉糜的硬度、弹性和内聚性,3%(质量分数)食盐添加量最佳。凝胶肉制品要获得良好的质构,肌原纤维蛋白在凝胶的形成过程起着重要作用。离子强度的增加会改变肌原纤维蛋白分子表面的电荷分布,从而改变稳定天然蛋白质结构的分子内静电相互作用,有利于肌原纤维蛋白在热作用下的解折叠[18]。减少食盐添加量,降低离子强度,导致肌原纤维蛋白,特别是肌球蛋白和肌动蛋白提取量和溶解量的减少,降低凝胶的质构特性[19]。蒸煮温度显著(p<0.05)影响蒸煮肉糜的硬度、弹性和内聚性。食盐添加量为3%(质量分数),80 ℃和90 ℃时,蒸煮猪肉糜的硬度最高,而70 ℃时蒸煮猪肉糜的硬度与食盐添加量为2%(质量分数),80 ℃和90 ℃时的猪肉糜差异不显著(p>0.05);温度对蒸煮猪肉糜特性和内聚性的影响最显著,在相同食盐添加量下,70 ℃时蒸煮猪肉糜的弹性最好,而内聚性在90 ℃时最高,且食盐添加量为3%(质量分数)时蒸煮猪肉糜的内聚性最高。猪肉糜凝胶强度和肌原纤维蛋白变性与离子强度、温度等条件下的展开程度有关,功能基团的暴露程度越高和变性程度越高,凝胶强度就越大,硬度与内聚性升高[20]。升高温度弹性下降的原因可能是过高蒸煮温度对凝胶的质构造成了破坏。

表2 不同食盐添加量和蒸煮温度猪肉糜的质构Table 2 Texture profile of pork meat batters made withvarious amounts of added NaCl at different temperature
注:每个值是平均值± SD,n=4。a~g不同字母表示存在显著差异(p<0.05)。
2.4 流变
由图2可知,不同食盐添加量猪肉糜在加热过程中G′值变化显著。1%、2%和3%(质量分数)食盐添加量的猪肉糜流变曲线相似,由蛋白质变性引起的G′的变化分为3个阶段。在第1阶段中,随着温度升高,蛋白质与蛋白质之间开始交联,形成的凝胶结构较弱[21-22],1%(质量分数)食盐添加量猪肉糜的G′从42 ℃到53 ℃之间缓慢升高,而2%和3%(质量分数)食盐添加量猪肉糜的G′从43 ℃到51 ℃之间缓慢升高。第1阶段结束后,立即进入第2阶段,由于肌球蛋白尾部在55 ℃左右时发生变性,对第1阶段形成的凝胶结构产生破坏[23-24],造成1%(质量分数)食盐添加量猪肉糜的G′从54~58 ℃之间缓慢下降,而2%和3%(质量分数)食盐添加量猪肉糜G′下降的温度区间为52~56 ℃。最后进入第3阶段,1%(质量分数)食盐添加量猪肉糜的G′从59~89 ℃,2%和3%(质量分数)食盐添加量猪肉糜G′从59~88 ℃之间,G′随着温度的升高快速增加,猪肉糜从黏稠的溶胶结构转变为富有弹性的凝胶网络[25]。由于过度加热对凝胶结构的破坏[16],1%(质量分数)食盐添加量猪肉糜的G′从90~95℃,2%和3%(质量分数)食盐添加量猪肉糜G′从89~95 ℃之间,G′随着温度的升高缓慢下降。
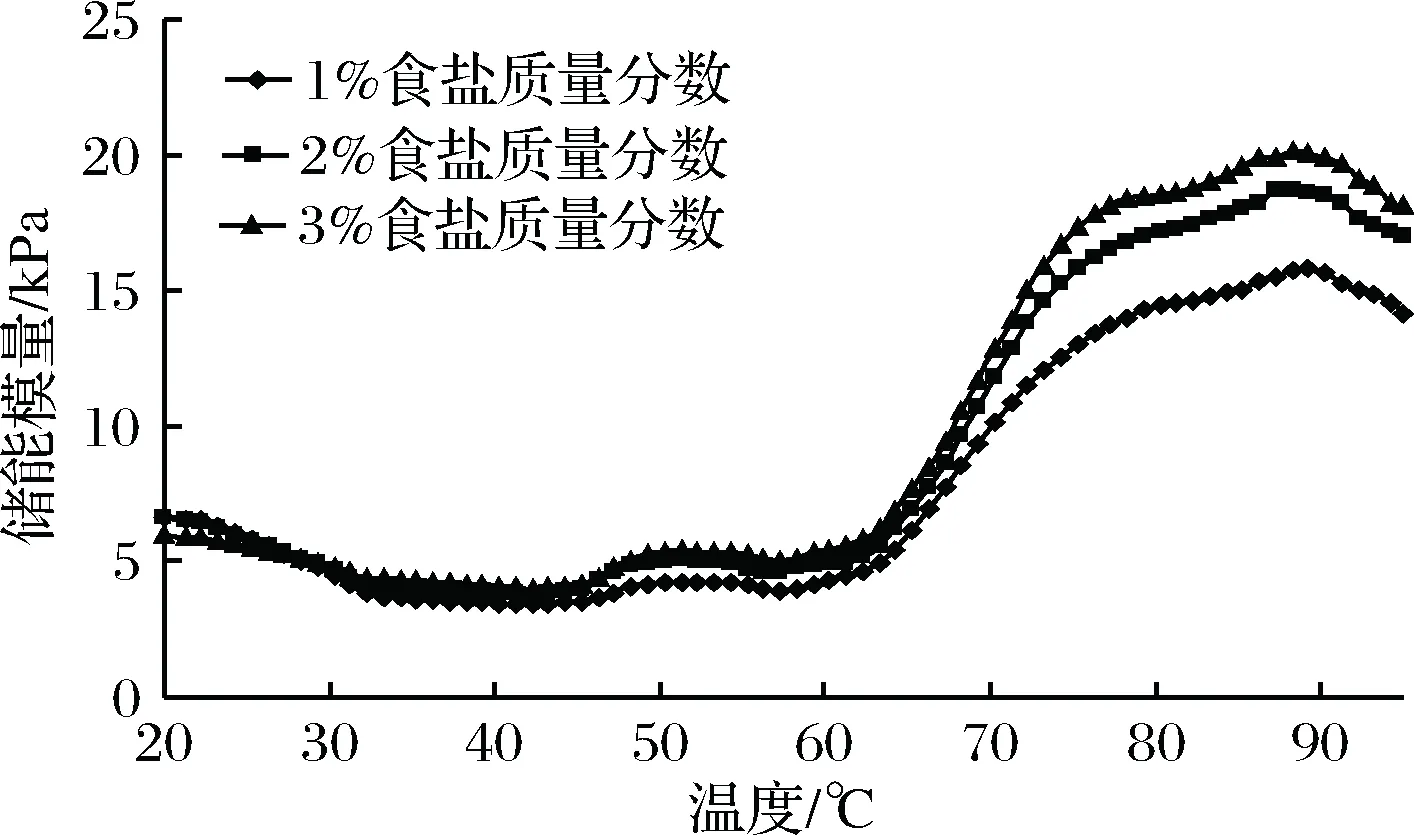
图2 不同食盐添加量猪肉糜在不同温度下(T, ℃)储能模量(G′, kPa)的变化Fig.2 Changes in dynamic storage modulus (G′, kPa) withtemperature (T, ℃) for pork batters made with variousamounts of added NaCl
3 结论
食盐添加量从1%增加至3%(质量分数),猪肉糜蒸煮得率、L*值和硬度、弹性、内聚性显著(p<0.05)升高,b*值显著(p<0.05)下降。在相同食盐添加量下,70 ℃时,蒸煮猪肉糜的蒸煮得率和弹性值最高;80 ℃时,蒸煮猪肉糜的L*值和硬度值最大;90 ℃时,蒸煮猪肉糜的b*值和内聚性值最大(p<0.05)。随着温度升高,不同食盐添加量猪肉糜的G′有相似的变化趋势,加热到25 ℃以后,3%(质量分数)食盐添加量猪肉糜的G′最高;加热到89 ℃以后,不同食盐添加量猪肉糜的G′都下降。
[1]KANG Z L, ZOU Y F, XU X L, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (kung-wan): A physico-chemical and textural study [J]. Meat Science, 2014, 96: 147-152.
[2]TOBIN B D, O'SULLIVAN M G, HAMILL R M, et al. The impact of salt and fat level variation on the physiochemical properties and sensory quality of pork breakfast sausages [J]. Meat Science, 2013, 93: 145-152.
[3]DESMOND E. Reducing salt: A challenge for the meat industry [J]. Meat Science, 2006, 74(6): 188-196.
[4]OMANA D A, PLASTOW G, BETTI M. Effect of different ingredients on color and oxidative characteristics of high pressure processed chicken breast meat with special emphasis on use of β-glucan as a partial salt replacer [J]. Innovative Food Science and Emerging Technologies, 2011, 12(4): 244-254.
[5]周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2008.
[6]BENJAKUL S, VISESSANGUAN W, CHANTARASUWAN C, et al. Effect of high-temperature setting on gelling characteristic of surimi from some tropical fish [J]. International Journal of Food Science and Technology, 2004, 39(6): 671-680.
[7]NICOLAI T, DURAND D. Controlled food protein aggregation for new functionality [J]. Current Opinion in Colloid and Interface Science, 2013, 18(4): 249-256.
[8]GRATACOSCUBARSI M, LAMETSCH R. Determination of changes in protein conformation caused by pH and temperature.[J]. Meat Science, 2008, 80(2): 545-549.
[9]MORITA J I, YASUI T. Involvement of hydrophobic residues in heat-induced gelation of myosin tail subfragment from rabbit skeletal muscle [J]. Agricultural Biological Chemistry, 1991, 55(4): 597-599.
[10]KANG Z, LI X, MA H, et al. Effect of the levels of transglutaminase in frankfurters: a physical-chemical and Raman spectroscopy study [J]. Cyta-journal of Food, 2017, 15(1):75-80.
[11]TOBIN B D, OSULLIVAN M G, HAMILL R M, et al. Effect of varying salt and fat levels on the sensory and physiochemical quality of frankfurters [J]. Meat Science, 2012, 92(4): 659-666.
[12]TROUT G R. Variation in myoglobin denaturation and color of cooked beef, pork, and turkey meat as influenced by pH, sodium chloride, sodium tripolyphosphate, and cooking temperature [J]. Food Sci, 1989, (54): 536-544.
[13]WARREN K E, HUNT M C, KROPF D H. Myoglobin oxidative state affects internal cooked color development in ground beef patties [J]. Food Sci. 1996(61): 513-515.
[14]CARDOSO C, MENDES R, VAZPIRES P, et al. Effect of salt and MTGase on the production of high quality gels from farmed sea bass [J]. Journal of Food Engineering, 2010, 101(1): 98-105.
[15]TOTOSAUS A, PEREZCHABELA M L. Textural properties and microstructure of low-fat and sodium-reduced meat batters formulated with gellan gum and dicationic salts [J]. LWT-Food Science and Technology, 2009, 42(2): 563-569.
[16]KONG W, ZHANG T, FENG D, et al. Effects of modified starches on the gel properties of Alaska Pollock surimi subjected to different temperature treatments [J]. Food Hydrocolloids, 2016, 56: 20-28.
[17]CHAIJAN M, BENJAKUL S, VISESSANGUAN W, et al. Physicochemical properties, gel-forming ability and myoglobin content of sardine (Sardinella gibbosa) and mackerel (Rastrelliger kanagurta) surimi produced by conventional method and alkaline solubilisation process [J]. European Food Research and Technology, 2006, 222(1-2): 58-63.
[18]GANG L, YOULING L X. Gelation of chicken muscle myofibrillar proteins treated with protease inhibitors and phosphates [J]. Journal of Agricultural and Food Chemistry, 1997, 45(9): 3 437-3 442.
[19]PIETRASIK Z, LI-CHAN E C Y. Response surface methodology study on the effects of salt, microbial transglutaminase and heating temperature on pork batter gel properties [J]. Food Research International, 2002, 35: 387-396.
[20]WANG C, DAMODARAN S. Thermal gelation of globular proteins: influence of protein conformation on gel strength [J]. Journal of Agricultural and Food Chemistry, 1991, 39(3): 999-1 006.
[21]WEISS J, GIBIS M, SCHUH V, et al. Advances in ingredient and processing systems for meat and meat products [J]. Meat Science, 2010, 86: 196-213.
[22]KANG Z, LI B, MA H, et al. Effect of Different Processing Methods and Salt Content on the Physicochemical and Rheological Properties of Meat Batters [J]. International Journal of Food Properties, 2015, 19(7): 1 604-1 615.
[23]WU M, XIONG Y L, CHEN J, et al. Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite Gels [J]. Journal of Food Science, 2009, 74(4): 207-217.
[24]TORNBERG E. Effects of heat on meat proteins-Implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3): 493-508.
[25]ALVAREZ D, XIONG Y L, CASTILLO M, et al. Textural and viscoelastic properties of pork frankfurters containing canola-olive oils, rice bran, and walnut [J]. Meat Science, 2012, 92(1): 8-15.
