超声对固定化木瓜蛋白酶化学动力学的影响
2018-04-12丁琳王真郑德娟程磊曹雁平
丁琳,王真,郑德娟,程磊,曹雁平*
1(北京工商大学 北京市食品添加剂工程技术研究中心,北京,100048)2(北京工商大学 食品添加剂与配料北京高校工程研究中心,北京,100048)
固定化酶是指能够固定在载体上并在一定的空间范围内可以进行催化反应的酶[1],具有稳定性好、易分离、产物收率高和使用效率高等优点[2]。但由于固定化酶存在的立体屏蔽、微扰动、分配效应以及扩散限制效应等会导致表观酶活较低[3]。超声具有化学效应、热效应、机械效应、空化效应等特点,同时又具有安全环保、节能高效等优点而得到广泛应用[4]。WANG 等[5]发现超声辅助能够提高固定化酶的活力,并且加快酶解过程,超声处理后的水解度增加74.38%。LADOLE[6]等研究超声功率对固定化纤维素酶的影响时发现,在24 kHz超声波条件下,6 W功率和6 min的孵育时间,固定化纤维素酶的催化活性比对照组增加了近3.6倍。壳聚糖作为一种天然高分子材料,常以凝胶或多孔微球的形态通过吸附或者包埋[7]的方法进行固定化[8]。EDWARDS[9]等将壳聚糖制成凝胶状膜,利用其吸附能力提高酶的固定效率。木瓜蛋白酶是一种半胱氨酸蛋白酶,具有酶活高、热稳定性好、天然卫生安全等特点,广泛应用于食品、医药等行业[10]。
超声能够提高固定化酶的酶活,使固定化酶的反应活化能等发生变化。林勤保[11]等发现,用频率为0.88 kHz的超声波处理肌酸激酶、丙酮酸盐激酶等固定化酶时,固定化酶的反应速率明显增加。周澍堃[12]等发现,与非超声相比,超声可以降低活化能,使降解反应更容易发生。但因为酶的种类不同,固定化方法与固定化材料的不同,其化学动力学参数难以定量分析并概括。故必须通过实验具体测定并总结[13]。
1 实验材料与方法
1.1 材料与试剂
试剂:木瓜蛋白酶,Sigma公司;壳聚糖,上海阿拉丁生化科技股份有限公司;冰醋酸、NaOH、干酪素、L-谷胱甘肽、无水Na2CO3、Na2HPO4·12H2O、NaH2PO4·2H2O、三氯乙酸:分析纯,国药集团化学试剂有限公司;福林酚,上海源叶生物科技有限公司。
1.2 仪器与设备
JXD-02型超声波电源,北京金星超声波设备技术有限公司;数显恒温水浴锅、恒温磁力搅拌器,国华电器有限公司;超声波清洗机,南京先欧生物科技有限公司;电子天平,DENVER INSTRUMENT;紫外分光光度计,日本岛津公司;低温恒温槽,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1固定化木瓜蛋白酶的制备
称取0.65 g壳聚糖溶于20 mL、0.9%HAc溶液中,置于60 ℃的恒温磁力搅拌锅中搅拌至壳聚糖完全溶解,呈透明无气泡的胶状溶液。然后加入0.01 g木瓜蛋白酶粉末,继续搅拌约5 min至酶溶解,将此混合液取出后冷却到室温。用一次性滴管将制备好的混合液缓慢滴入不断搅拌的1.1%的NaOH溶液中,使其固定化呈小球状,置于4 ℃的冰箱冷藏20 min后取出,用大量去离子水清洗小球至无NaOH残留,然后将小球置于干净的滤纸上晾干备用。制备好的小球置于4 ℃的冰箱中保存。
1.3.2固定化木瓜蛋白酶活性的测定
利用Folin-酚法测定固定化木瓜蛋白酶的表观酶活力。
1.3.3固定化木瓜蛋白酶反应级数的确定
对于反应aA+bB=dD+eE,实验测得其速率方程式为:
v=k(A)m(B)n
(1)
式中:k为反应速率常数;m为反应物A的级数;n为反应物B的级数;(m+n)为反应的级数,反应级数越大,表示浓度对反应速率的影响越大。
对反应速率方程进行积分,得到浓度与时间t的函数关系式,成为化学反应动力学方程式。对于反应A→B,零级反应符合式(2),一级反应符合式(3),二级反应符合式(4)。
CA=-kt+CA0
(2)
lnCA=-kt+lnCA0
(3)
1/CA=1/CA0+kt
(4)
式中:CA为t时刻酪蛋白被固定化木瓜蛋白酶水解后的剩余质量浓度,mg/mL;CA0为t=0时刻酪蛋白的质量浓度,mg/mL。
对于零级、一级、二级反应,分别对C-t、ln(C0/C)-t、(1/C-1/C0)-t做直线,通过最小二乘法对数据进行线性回归分析,其相关系数为最大值的直线所对应的方程即为该反应的速率特征方程,所对应的反应级数分别为零级、一级、二级。
1.3.4固定化木瓜蛋白酶化学反应动力学参数的测定
利用Arrhenius方程:

(5)
式中:k为反应速率常数;Ea表示表观活化能;A表示指前因子;R为摩尔气体常数;T为反应温度。
根据相关数据,lnk对1/T作图,根据lnk与1/T线性的斜率和截距可以求出表观活化能Ea和指前因子A。
2 结果与分析
2.1 固定化木瓜蛋白酶反应级数的确定
配置pH 7下初始质量浓度分别为2、4、6、8、10 mg/mL的底物(酪蛋白)溶液,分别置于40 ℃的恒温水浴以及超声条件下处理60 min,每10 min取样测定酶活力。根据实验结果,分别对C-t、ln(C0/C)-t、(1/C-1/C0)-t作图,得出酪蛋白在相应反应级数下的酶解速率常数k,并进行线性回归分析。结果如表1所示。
表1数据显示,超声与非超声条件下ln(C0/C)-t的回归方程斜率均相差最小,由此说明,一级反应动力学较零级、二级反应更能明确地描述固定化木瓜蛋白酶酶解酪蛋白的反应规律。因此,可以初步确定,酪蛋白被固定化木瓜蛋白酶酶解的反应符合一级反应动力学特性。这与相关研究文献所报道结果一致[15]。

表1 不同条件下酪蛋白浓度随时间的变化的零级、一级和二级反应的回归方程Table 1 The equation of zero,primary and secondaryreactions of casein concentration with time underdifferent conditions
2.2 固定化木瓜蛋白酶的化学动力学研究结果
将固定化木瓜蛋白酶分别在30、40、50、60、70 ℃的恒温水浴条件以及不同超声条件下与10 mg/mL的底物(酪蛋白)反应60 min,每隔10 min取样测定酶活力,超声条件见表2。
2.2.1超声对固定化木瓜蛋白酶化学反应速率常数的影响
图1、图2为各温度下的一级反应速率方程,在非超声与超声条件下,固定化木瓜蛋白酶的反应速率常数均随温度的升高而增大,且超声条件下固定化木瓜蛋白酶催化效果较非超声条件下更加明显。
表2超声处理固定化木瓜蛋白酶化学动力学的实验设计
Table2Experimentdesignofstudyingkineticsofultrasonictreatedimmobilizedpapain

频率/kHz功率/(W·cm-2)温度/K温度/℃280.0530330400.1531340500.25323501350.35333600.4534370
这说明溶液中酪蛋白分子的运动速率随温度的升高而增大,增加了酪蛋白与木瓜蛋白酶的接触机会,从而加快了反应的进行。磨建新[16]在探讨温度对化学反应速度的影响时发现,温度每升高10 ℃反应速度大约加快2~4倍。均说明反应速率对温度很敏感,在一定的反应条件下升高温度可以促使活化分子数目增多,加快反应进程。
2.2.2超声对固定化木瓜蛋白酶化学反应动力学参数的影响
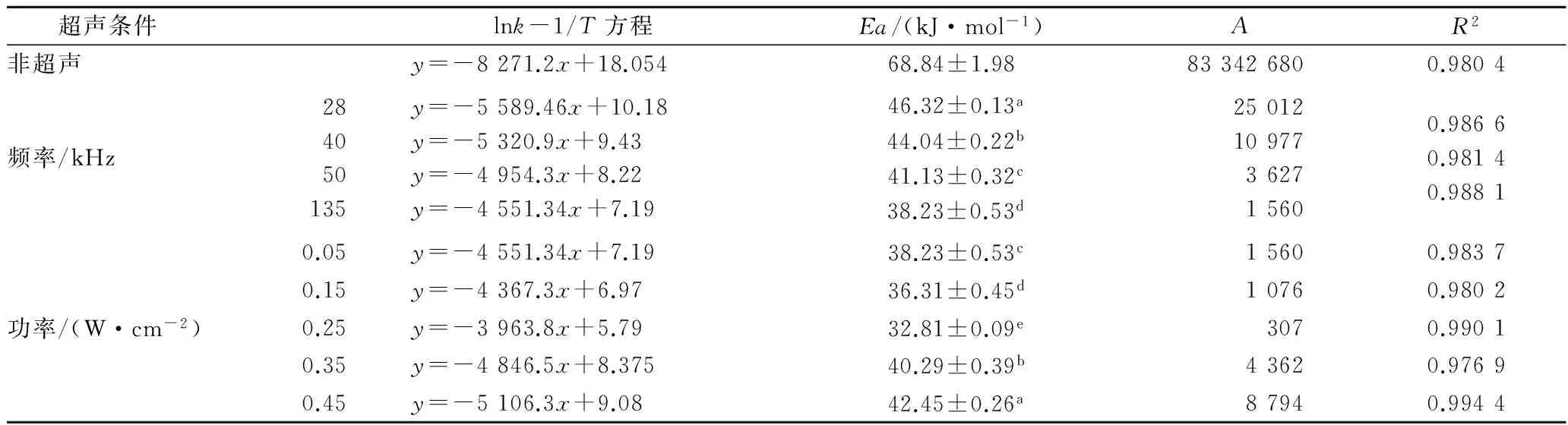
为进一步研究超声影响固定化木瓜蛋白酶水解反应的规律,需要探讨表观活化能以及指前因子的变化。结果如表3所示。

图1 超声频率对固定化酶酶解速率的影响Fig.1 The effect of ultrasonic frequency on reactionrate of immobilized enzyme
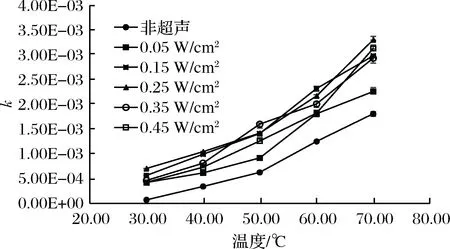
图2 超声功率对固定化酶酶解速率的影响Fig.2 The effect of ultrasonic power on reactionrate of immobilized enzyme
超声条件lnk-1/T方程Ea/(kJ·mol-1)AR2非超声y=-8271.2x+18.05468.84±1.98833426800.9804频率/kHz284050135y=-5589.46x+10.18y=-5320.9x+9.43y=-4954.3x+8.22y=-4551.34x+7.1946.32±0.13a44.04±0.22b41.13±0.32c38.23±0.53d2501210977362715600.98660.98140.98810.05y=-4551.34x+7.1938.23±0.53c15600.98370.15y=-4367.3x+6.9736.31±0.45d10760.9802功率/(W·cm-2)0.25y=-3963.8x+5.7932.81±0.09e3070.99010.35y=-4846.5x+8.37540.29±0.39b43620.97690.45y=-5106.3x+9.0842.45±0.26a87940.9944
表3数据显示,超声能显著(p<0.05)降低表观活化能。当超声功率为0.05 W/cm2时,随着超声频率的增加,表观活化能Ea逐渐减小。当超声条件为135 kHz,0.05 W/cm2时,表观活化能最小为38.23±0.53 kJ/mol。超声频率增加,空化气泡数量呈线性增加,产生大量的冲击波能高频率的进入固定化酶的小缝隙中,增加了木瓜蛋白酶与酪蛋白的接触机会。同时,超声波产生的瞬间破坏力使壳聚糖载体网状结构打开,减少了酪蛋白与产物分子在通道中受到的阻力,从而加速了催化反应[17]。
当超声频率为135 kHz,超声功率从0.05 W/cm2增加到0.25 W/cm2时,表观活化能持续降低,到0.25 W/cm2时为32.81±0.09 kJ/mol。其原因可能为,超声功率增大,超声波强度增加,空化效果明显,产生的剪切力改变固定化酶的结构[18],或者使得木瓜蛋白酶活性位点暴露,能够充分与底物结合,从而加速了反应速率。但是,超声功率从0.25 W/cm2升至0.45 W/cm2时,表观活化能出现上升趋势。此现象可以从3方面进行解释:
(1)在高超声频率条件下,当超声功率达到一定值后,空化趋于饱和,随着超声功率增加而产生的大量无用空化气泡,在声波的振动下,空化核急剧崩溃闭合产生大量散射强度,形成瞬时压力,阻碍产物释放,造成反应通道堵塞,降低了空化强度与反应速率[19]。
(2)超声强度增加,一定程度上会导致酶分子构象改变。超声波对酶活性部位的接触残基施加影响,导致酶失活[19-20]。超声强度的增加有抑制作用。
(3)超声的热作用[21]。超声条件下振动的能量不断被媒质吸收转化为热量,并且功率越高,产生的热量也会越高[22],使得媒质温度也随之升高,导致气泡中蒸汽压增大,瞬间爆破时受到阻碍,使得产生的冲击波能量较小,减缓了催化反应,使催化反应不易进行。
以上数据显示,表观活化能以及指前因子均会随不同超声条件有所改变。理论上活化能越低,反应速率越大,活化分子碰撞速率越高,相对应的指前因子数值越大。但是实验结果显示,指前因子A的大小随着表观活化能Ea的增大而增大,随着Ea的减小而减小。出现这种情况的原因可能是[23]:在均相或多项反应中(不同溶剂中的液相反应、催化剂组成有规律变化或表面预处理不同的多相反应、同类无机盐或有机高聚物的热分解反应等),常会存在补偿效应,即指前因子A会随着Ea的增大而增大,随着Ea的降低而减小,也就是说表观活化能与指前因子对反应速率起相反的影响,这种关系称为动力学补偿效应或动力学效应。壳聚糖固定化木瓜蛋白酶水解酪蛋白催化反应的体系复杂,因此,对于复杂体系以及复杂分子的化学反应而言,需要考虑补偿效应。
3 结论
通过超声处理壳聚糖固定化木瓜蛋白酶的动力学结果可以看出:酪蛋白被固定化木瓜蛋白酶酶解反应符合一级的反应动力学特征。在研究壳聚糖包埋固定化木瓜蛋白酶催化酪蛋白的化学动力学中,温度对催化反应有直接作用,随着温度的升高,酶促反应速率常数k随之增大。在固定功率时,表观活化能随超声频率的升高而减小,可见增大超声频率对反应有促进作用。在固定频率时,增加超声强度,表观活化能Ea先减小后增大,说明一定的超声功率对固定化木瓜蛋白酶催化反应有一定抑制作用。135 kHz,0.25 W/cm2超声条件下,表观活化能最小,即参加反应的活化分子数量最多,酶促反应最容易进行。
[1]侯瑾, 李迎秋. 固定化酶的研究进展及其在食品工业中的应用[J]. 江苏调味副食品, 2017(1):9-12.
[2]贺天. 酶的固定化及酶活性荧光分析检测[D]. 西安:陕西师范大学, 2015.
[3]袁勤生. 酶与酶工程[M]. 上海: 华东理工大学出版社, 2012: 1-434.
[4]闫军旺. 小功率高频超声波生物处理装置及其频率控制研究[D]. 无锡:江南大学, 2013.
[5]WANG B, MENG T, MA H, et al. Mechanism study of dual-frequency ultrasound assisted enzymolysis on rapeseed protein by immobilized Alcalase[J]. Ultrasonics Sonochemistry, 2016, 32:307-313.
[6]LADOLE M R, MEVADA J S, PANDIT A B. Ultrasonic hyperactivation of cellulase immobilized on magnetic nanoparticles[J]. Bioresource Technology, 2017, 239:117-126.
[7]韩志萍, 叶剑芝, 罗荣琼. 固定化酶的方法及其在食品中的应用研究进展[J]. 保鲜与加工, 2012, 12(5):48-53.
[8]梁足培, 冯亚青, 孟舒献,等. 壳聚糖及其衍生物在固定化酶中的应用进展[J]. 中国海洋药物, 2004, 23(4):39-42.
[9]EDWARDS W, LEUKES W D, ROSE P D, et al. Immobilization of polyphenol oxidase on chitosan-coated polysulphone capillary membranes for improved phenolic effluent bioremediation[J]. Enzyme & Microbial Technology, 1999, 25(8-9):769-773.
[10]苏二正, 李明亮, 魏东芝. 木瓜蛋白酶的原位固定化及理化性质研究[J]. 南京林业大学学报(自然科学版), 2014(6):99-104.
[11]林勤保, 高大维. 超声波对酶反应的影响[J]. 声学技术, 1997(sx):26-28.
[12]周澍堃, 曹雁平, 黄正华. 黑米色素在超声场中稳定性研究[J]. 中国食品添加剂, 2015(3):71-76.
[13]陈石根, 周润琦. 酶学[M]. 上海: 复旦大学出版社, 2005: 1-415.
[14]王福荣, 庞玉珍. 福林—酚试剂法测定蛋白酶活力的条件试验[J]. 中国调味品, 1981(12):23-26.
[15]高大维, 陈满香. 超声波催化糖化酶水解淀粉的初步研究[J]. 华南理工大学学报 (自然科学版), 1994(1):6-9.
[16]磨建新. 温度对化学反应速度、平衡与转化率的影响[J]. 高教论坛, 2004(5):162-164.
[18]SUTAR R S, RATHOD V K. Ultrasound assisted enzyme catalyzed degradation of Cetirizine dihydrochloride[J]. Ultrasonics Sonochemistry, 2015, 24:80-86.
[19]滕超, 查沛娜, 范园园,等. 超声波在酶解制备技术中的应用进展[J]. 江苏农业科学, 2014, 42(6):13-16.
[20]黎春怡, 黄卓烈, 张东方,等. 超声波和超临界流体对酶活性的影响[J]. 生物技术通讯, 2007, 18(2):360-362.
[21]WANG J, HAN J T, ZHANG Y. The Application of the ultrasonic technology in the chemical production[J]. Shenyang Chemical Industry, 2002,9(2):147-154.
[22]张强, 孙昱东, 施宏虹,等. 超声波技术及其在应用技术领域的机理研究[J]. 广东化工, 2013, 40(13):90-91.
[23]邹文樵. 化学动力学中的补偿效应[J]. 大学化学, 1997, 12(2):47-49.
