重组大肠杆菌制备副溶血弧菌噬菌体内溶素Lys qdvp001 CHAP域及诱导条件初步优化
2018-04-12鞠晓晨吕新伟王静雪
鞠晓晨,吕新伟,王静雪,林 洪
(中国海洋大学食品科学与工程学院,山东青岛 266003)
副溶血弧菌是一种革兰氏阴性致病菌,会引起海鲜类食品污染,是引发海产品类食源性疾病最主要的因素之一,常导致肠胃炎、伤口感染和败血症[1]。然而近年来,由于水产养殖过程中抗生素的滥用,导致了多重耐药性的副溶血弧菌的产生,这严重威胁着人类健康,同时也制约了鱼类及贝类养殖产业的发展[2]。有文献报道,从取自河北省地区的水产品中,采用稀释法分离得到38株副溶血弧菌菌株,结果发现所有的菌株都对氨苄西林有耐药性,其中44.74%对磺胺异恶唑有耐药性,34.21%对甲氧苄氨嘧啶有耐药性,68.42%对妥布霉素有耐药性,21.05%对头孢曲松有耐药性,28.95%对先锋霉素有耐药性,73.68%对呋喃妥因有耐药性,39.47%对头孢哌酮有耐药性,26.32%对环丙沙星有耐药性[3],表明细菌抗药性问题已经非常严重。因此,找到能够替代抗生素并能有效防控副溶血弧菌的抑菌剂迫在眉睫。
由于耐药菌的出现,新型抗菌剂——内溶素,成为替代抗生素的一种绝佳选择。内溶素是天然存在的杀菌剂,是噬菌体编码的一种肽聚糖裂解酶,在噬菌体侵染细菌阶段起作用,用于细菌的肽聚糖层,在噬菌体侵染细菌最后的裂解阶段,水解肽聚糖,裂解细菌,使得繁殖在细菌体内的子代噬菌体得以释放出来[4]。用重组菌克隆表达制备的内溶素已经成功应用于抑制有耐药性的革兰氏阳性病原体,且内溶素在控制食品安全,医疗器械表面消毒,消除细菌生物膜的产生以及病原体检测和疫苗制备方面都有很好的应用[56]。因此,内溶素作为新型抑菌剂有很好的应用前景。
本实验室前期成功克隆表达溶血弧菌噬菌体qdvp001的ORF60,制备出新型的内溶素抗菌剂Lys qdvp001[7],并对其进行结构物预测,发现ORF60为模块化结构,包含两个部分,PG_binging_1域和CHAP域[8]。本研究将对其CHAP域进行克隆表达,确定Lys qdvp001 CHAP域表达形式,对诱导表达条件进行初步优化,并对其进行了复性。
1 材料与方法
1.1 材料与仪器
原核表达载体 pET30a、BL21(DE3) 均由实验室保存;质粒抽提试剂盒、DNA回收试剂盒 购自天根生化公司;T4DNA连接酶、Taq DNA聚合酶 购自康为公司;电泳相关试剂(Tris,Glycine,SDS,SDS-PAGE凝胶制备试剂盒等) 购自北京索莱宝科技有限公司;0.22 um 滤器及透析袋 购于Millipore公司;异丙基βD硫代半乳糖苷(简称 IPTG) 购于北京索莱宝生物技术有限公司;溶菌酶 购于北京索莱宝生物技术有限公司;卡那霉素(硫酸盐) 购于上海生工生物工程股份有限公司;Ni2+SepharoseTM6 Fast Flow填料 购于美国GE healthcare公司;咪唑 购于北京索莱宝科技有限公司;LB肉汤培养基、LB培养基琼脂 购于北京陆桥技术有限公司;LArginine 购于北京索莱宝科技有限公司;尿素、甘油、氯化钠 购于上海沪试有限公司;GSSG,GSH 购于上源叶生物有限公司。
DNA合成仪 美国BIOAUTOMATION公司;PCR仪 中国赛默飞世尔公司;电泳仪 伯乐生命医学产品(上海)有限公司;超声细胞破碎仪 宁波新芝生物有限;高速冷冻离心机 湖南湘仪有限公司;四维旋转混合仪江苏 海门其林贝尔仪器制造有限公司;SWCJ2FD超净工作台 苏州安泰空气技术有限公司;Power Wave XS2微孔板分光光度计 美国百特国际有限公司。
1.2 实验方法
1.2.1 pET30aCHAP表达载体的构建 对已知的Lysqdvp001中CHAP域的蛋白氨基酸序列进行密码子优化,在合成序列的上下游段引入NdeI/HindII酶切位点序列,通过DNA合成仪合成所需的DNA序列,以合成的DNA片段为模板进行PCR扩增,为方便表达载体的构建,选择在上下游引物的5′端也分别引入限制性内切酶 NdeI/HindII的酶切位点,根据优化设计序列设计引物,引物序列如下:上游引物P1:5′(CGTCATATGCATCATCATCACCATCACGAC)3′,下游引物P2:5′(TCGAAGCTTTCATTATTGA TGCGGATTACGATAG)3′,引物由上海生工公司合成。然后通过限制性酶切位点Nde Ⅰ和Hind Ⅲ,将PCR产物及pET30a质粒进行双酶切,将 CHAP基因插入到表达载体pET30a中,再用T4 DNA连接酶连接得到重组质粒[9]。
1.2.2 pET30aCHAP表达菌的构建及表达 将含有CHAP基因的质粒转化到 BL21(DE3)感受态细胞中,涂布于添加卡那霉素抗性(卡那霉素50 μg/mL)的LB平板,37 ℃过夜培养,次日获得转化子克隆。取4个单克隆并提取质粒,质粒经PCR鉴定(引物P1、P2)及DNA测序筛选pET30aCHAP重组表达载体。
1.2.3 重组内溶素初步诱导表达 挑取含有pET30aCHAP重组表达载体的单菌落至5 mL的LB肉汤培养基(含50 μg/mL卡那霉素)中,同时以pET30空载体转化的大肠杆菌作对照。37 ℃,150 r/min培养过夜后以1∶100的比例加入到100 mL的LB肉汤培养基(含50 μg/mL卡那霉素)中,培养6 h后OD600 nm达到0.4左右,再加入IPTG至终浓度为0.5 mmol/L,同时以未加IPTG诱导的pET30aCHAP重组表达载体菌液作为对照,于16 ℃,150 r/min继续培养5 h,取出1 mL菌液。将取出的菌液12000 r/min离心2 min,弃掉上清液,用45 μL的4×上样缓冲液复溶菌体,煮沸7 min进行SDSPAGE电泳。未加IPTG诱导的菌液作为第二组对照。
1.2.4 表达形式的确定 将于37 ℃,150 r/min培养过夜后以1∶100的比例加入100 mL的LB肉汤培养基(含50 μg/mL卡那霉素),培养6 h后OD600 nm达到0.4左右后,再于16 ℃,150 r/min,加入IPTG(0.5 mmol/L)诱导5 h的得到的菌液,分别12000 r/min,2 min离心,收集菌体。将离心所得菌体用pH为8的缓冲液(50 mmol/L Tris,150 mmol/L NaCl)复融,利用超声破碎仪在300 W,工作5 s,休息5 s条件下进行超声破碎20 min,破碎好的菌液于12000 r/min,30 min离心,沉淀和上清进行SDS-PAGE电泳观察。其中沉淀于8 mol/L Urea,50 mmol/L Tris,150 mmol/L NaCl的缓冲液溶解,溶解时可进行适度超声使其溶解完全。
1.2.5 IPTG诱导浓度的确定 使用不同浓度的IPTG进行诱导表达(0.05、0.1、0.5、1、1.5、2、5 mmol/L),分别于37 ℃,150 r/min培养诱导5 h,将菌液12000 r/min离心2 min,弃掉上清液,用45 μL的4×上样缓冲液复溶菌体,煮沸7 min进行SDSPAGE电泳。
1.2.6 诱导温度的确定 使用浓度为0.5 mmol/L的IPTG对重组表达载体进行诱导表达,培养温度分别设定为16,25和37 ℃继续培养5 h,将菌液12000 r/min离心2 min,弃掉上清液,用45 μL 的4×上样缓冲液复溶菌体,煮沸7 min进行SDS-PAGE电泳。
1.2.7 诱导时间的确定 使用浓度为0.5 mmol/L的IPTG对重组表达载体在16 ℃进行诱导表达,分别在1、2、3、4、5、6、7、8 h后取出1 mL菌液至无菌EP管中,至4 ℃冰箱保存。将菌液12000 r/min离心2 min,弃掉上清液,用45 μL的4×上样缓冲液复溶菌体,煮沸7 min进行SDSPAGE电泳。
1.2.8 包涵体的制备 挑取含有pET30aCHAP重组表达载体的单菌落至5 mL的LB肉汤培养基(含50 μg/mL卡那霉素)中,于37 ℃,150 r/min培养过夜后以1∶100的比例加入2 L的LB肉汤培养基(含50 μg/mL卡那霉素)中,培养6 h后OD600 nm达到0.4左右,再加入IPTG至终浓度为0.5 mmol/L,于16 ℃,150 r/min继续培养7 h,离心,去上清,沉淀即为包涵体,保存于80 ℃备用。
1.2.9 包涵体的变性 取上述制备的4 g包涵体用40 mL超声破碎液缓冲液(pH=8,50 mmol/L Tris,150 mmol/L NaCl,10 mmol/L Imidazole)重悬,将菌液放入冰水混合物中,静止5 min,使菌液保持较低的温度。清洗探头,进行超声破碎,超5 s停10 s,超声20 min,观察到菌液已经破碎成均匀的溶液。去杂质包涵体用洗涤液(1 mol/L Urea、50 mmol/L Tris(pH=8.0)、150 mmol/L NaCl、1% Triton X100[10]、5 mmol/L EDTA、2 mmol/L DTT)洗涤,每次充分混匀后,10000 r/min离心10 min左右,重复3次。然后用纯水洗涤一次。以50 mmol/L Tris(pH8.0),150 mmol/L NaCl,8 mol/L Urea缓冲液溶解包涵体,轻度的超声,直到沉淀彻底溶解。
1.2.10 目的蛋白的纯化 首先进行重组蛋白纯化的小试实验,以确定最优洗脱条件。将4 mL Ni2+SepharoseTM6 Fast Flow填料加入柱子中,以1 mL/min的流速分别用超纯水和结合缓冲液(8 mol/L Urea,50 mmol/L Tris,150 mmol/L NaCl,10 mmol/L咪唑,pH8)洗柱子直至基线,加入5 mL粗酶液,依次用含有50、100、200、300、400、500 mmol/L咪唑的结合缓冲液洗脱蛋白至OD280 nm平稳,进行电泳检测,纯化过程使用的试管及缓冲液均经过4 ℃预冷。将纯化后的重组蛋白置于80 ℃保存。
1.2.11 包涵体的复性 将纯化得到的上清装入已经预处理好的透析袋中(截留分子量为3.5 kDa),将蛋白按照体积比为1/20透析至300 mL的复性缓冲液[50 mmol/L Tris(pH8.0),150 mmol/L NaCl,4 mmol/L GSH,0.4 mmol/L GSSG,2 mmol/L EDTA[11],0.4 mol/L LArginine[12],10% Glycerol]中复性,时间为24 h,温度为4 ℃。
把装有CHAP蛋白的透析袋取出,将其按照体积比为1/20透析至300 mL的储存缓冲液50 mmol/L Tris,150 mmol/L NaCl,10% Glycerol(pH8.0)中,时间为8 h,每2 h换液一次,温度为4 ℃。
透析复性结束后,将蛋白取出离心:13000 r/min,15 min,温度为4 ℃,离心结束后留上清,并用滤头抽滤(直径为0.22 μm)后分装,并将其冻存至80 ℃,等待检测。
1.2.12 酶活测定 通微孔板分光光度计检测450 nm处光密度的降低来测定裂解活性。将副溶血弧菌vp17802培养过夜直到OD450 nm达到0.8左右。细胞在9000 r/min离心15 min,用50 mmol/L Tris、150 mmol/L NaCl(pH8.0),洗涤一次,并重新悬浮在相同的缓冲液中以将OD450 nm调节至1.0左右。在96孔板中先加入100 μL细菌复融液,再加入100 μL重组蛋白Lys qdvp001 CHAP,透析液作为阴性对照,分别在1、2、3、4、5、10、15、20、25、30 min测定其吸光值,每组3个平行。
2 结果与分析
2.1 转化后的大肠杆菌菌落PCR结果
取其中转化后的大肠杆菌菌落进行菌落PCR,显示有明亮条带的为阳性克隆,不显示条带的菌落为假阳性菌落,测序结果发现阳性克隆与目的基因序列为100%一致,可以确定目的基因成功导入。
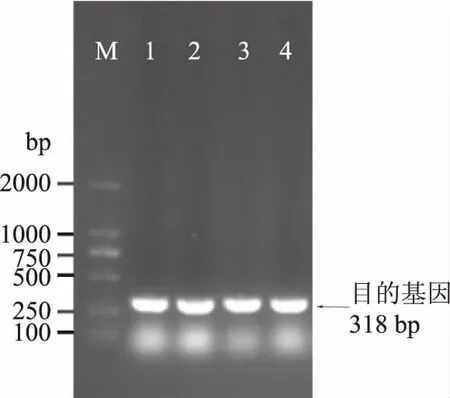
图1 转化后菌落PCR检测Fig.1 Agarose gel electrophoresis of transfered E.coil注:M:marker;脉道1,2,3,4:pET30aCHAP PCR产物。
2.2 重组内溶素初步诱导表达
可以从图2看出,pET30空载体和重组菌表达的蛋白分子量极为相似,经过蛋白质谱鉴定,确定pET30空载体和重组菌表达蛋白的氨基酸序列不一致,根据PCR扩增目的基因的条带分子大小以及测序结果确定了目的基因成功导入到大肠杆菌中。其次未加IPTG诱导的菌液几乎没有目的蛋白的表达(图2,泳道2)。
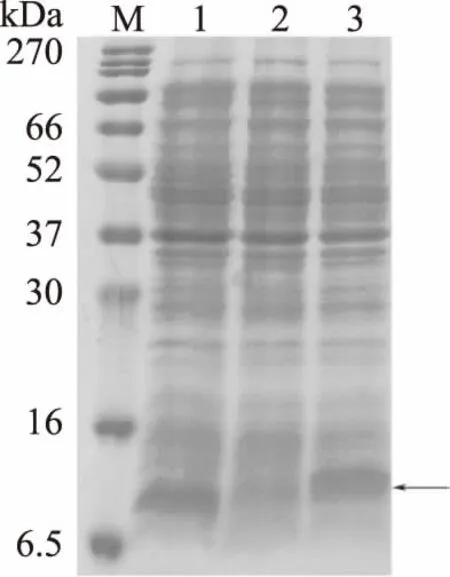
图2 重组菌的初步表达Fig.2 Total fractions of induced of recombinant bacteria注:M:marker;1:pET30质粒空载体大肠杆菌菌液(加IPTG诱导),2:未加IPTG诱导的Lysvp001 CHAP基因的重组菌株菌液,3:正常诱导的Lysvp001 CHAP基因的重组菌株菌液,箭头所指位置为目的蛋白大小位置。
2.3 IPTG诱导浓度的确定
IPTG诱导浓度大小会对表达量的多少产生影响,可以从图3看出,IPTG浓度太低时蛋白的表达量太低,IPTG为浓度5 mmol/L时,其浓度过高反而会抑制蛋白的表达。当IPTG浓度为0.5、1、1.5、2 mmol/L各个条带中目的蛋白的表达量没有明显的差别,考虑到经济因素,并且IPTG有细胞毒性,不利于菌体生长[13],所以表达量差别不大时,选取低浓度,因此最终选取IPTG最佳诱导浓度为0.5 mmol/L。
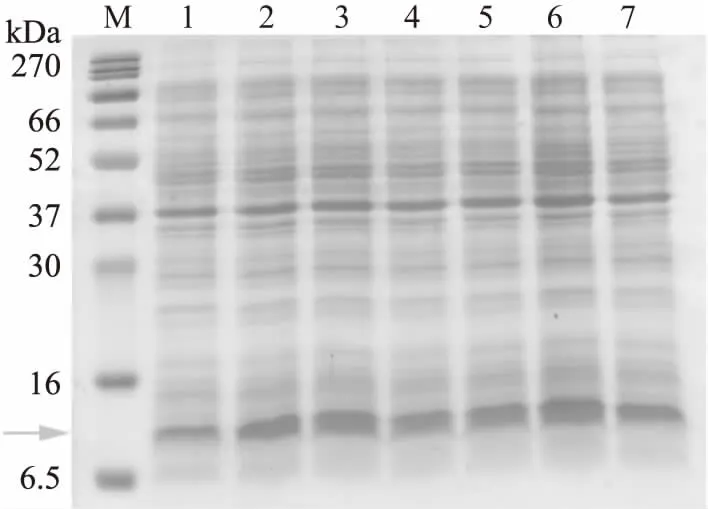
图3 IPTG浓度对重组蛋白表达量的影响Fig.3 The effects of different IPTG concentration on recombinant bacteria注:M:marker;1~7:IPTG终浓度分别为0.05、0.1、0.5、1、1.5、2、5 mmol/L,箭头所指位置为目的蛋白大小位置。
2.4 诱导温度的确定
诱导温度会对表达量产生影响,从图4看出,当诱导温度为16 ℃和37 ℃各个条带中目的蛋白的表达量差别不大,但诱导温度过高会导致当蛋白质合成速度过快,多肽链不能正确折叠,导致疏水基因暴露在外等问题,因此当表达量一样时,选取最后的诱导温度为16 ℃[14]。
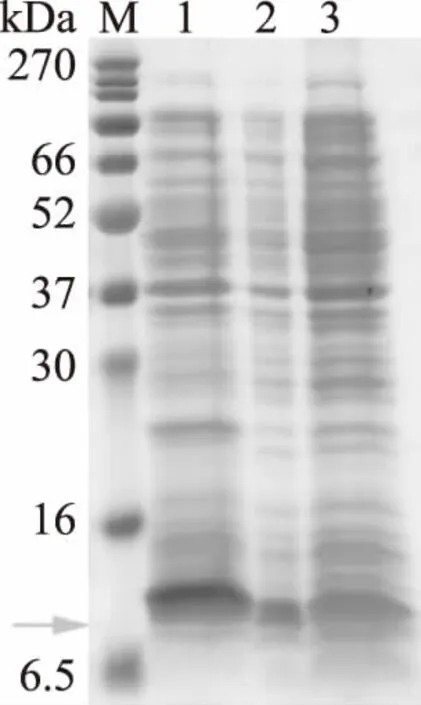
图4 不同诱导温度对重组蛋白表达量的影响Fig.4 The effects of different temperature on recombinant bacteria注:M:marker;1:诱导温度为16 ℃,2:诱导温度为25 ℃,3:诱导温度为37 ℃,箭头所指位置为目的蛋白大小位置。
2.5 诱导时间的确定
诱导时间的多少会对表达量产生影响,从图5看出,诱导时间越长,目的蛋白的表达量越高,诱导时间为7 h目的蛋白表达量最高,但诱导时间过长,诱导产生的氨基酸反而会抑制目的蛋白的合成[15],从图可以看出,诱导8 h,目的蛋白的表达量反而减少了。因此最终选取最佳诱导时间为7 h。
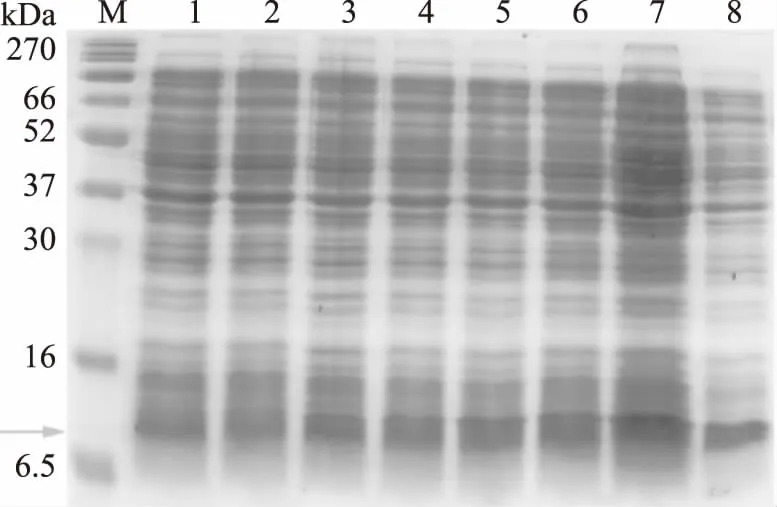
图5 不同诱导时间对重组蛋白表达量的影响Fig.5 The effects of different time on recombinant bacteria注:M:marker;1:诱导时间为1 h,2:诱导时间为2 h,3:诱导时间为3 h,4:诱导时间为4 h,5:诱导时间为5 h,6:诱导时间为6 h,7:诱导时间为7 h,8:诱导时间为8 h,箭头所指位置为目的蛋白大小位置。
2.6 表达形式的确定
从重组菌的上清和沉淀中目的蛋白含量确定其表达形式,从图6可以看出,诱导后重组菌的上清中目的蛋白含量较少,但诱导后的沉淀在 10 kDa左右处有大量的目的融合蛋白,这说明该工程菌所表达的融合蛋白多为不可溶的包涵体。目前具有模块化结构的格兰氏阴性菌噬菌体内溶素的C段结构域大多是以包涵体形式存在的[16],结合本研究所克隆表达的目的蛋白的分子结构是具有模块化结构的格兰氏阴性菌噬菌体内溶素Lys qdvp001的C端CHAP域,可知目的蛋白的表达形式也为不可溶性的包涵体,与目前已知的大多文献结果一致。
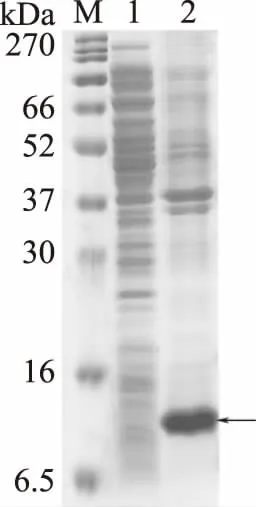
图6 16 ℃诱导条件下重组蛋白表达形式Fig.6 The expression form of recombinant protein at 16 ℃注:M为蛋白marker;1:超声破碎后上清液中的细菌总蛋白,2:超声破碎后的沉淀溶于8 mol/L尿素的沉淀中的细菌总蛋白,箭头所指位置为目的蛋白大小位置。
2.7 包涵体变性结果
可以从图7泳道6清楚的得出,含8 mol/L Urea的变性剂可以很好的将沉淀复性,洗涤剂对杂蛋白也有很好的去除作用,但是第2,3次有少量目的蛋白洗脱下来,因此可以适当的减少洗涤沉淀的次数,洗涤次数为一次即可。
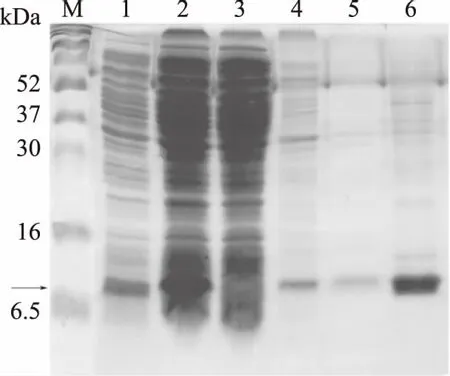
图7 8 mol/L尿素溶解重组蛋白Fig.7 SDS of Urea dissolved recombinant protein注:M:marker;1:重组菌株菌液,2:破碎后的菌液,3:第一次洗涤沉淀后的上清,4:第2次洗涤沉淀后的上清,5:第3次洗涤沉淀后的上清,6:沉淀复性以后的上清,箭头所指位置为目的蛋白大小位置。
2.8 纯化结果
用不同浓度的咪唑缓冲液洗脱蛋白可以确定最佳咪唑浓度,从图8可以看出,复性后的蛋白过Ni柱可以很好的纯化出来,其在50,100 mmol/L咪唑洗脱缓冲液都能洗脱下来,且在100 mmol/L咪唑洗脱缓冲液时浓度明显很高,因此可以确定最佳咪唑洗脱缓冲液为100 mmol/L。
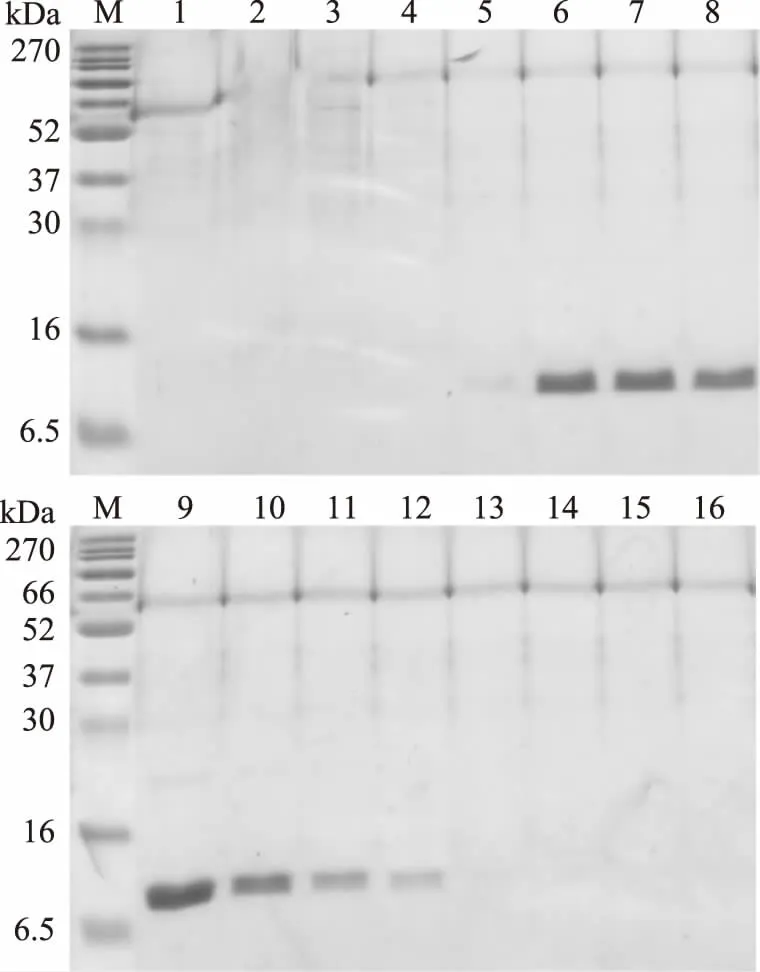
图8 重组蛋白纯化过程电泳图 Fig.8 SDSPAGE of the purifacation process of recombinant protein注:M:marker;1~4:10 mmol/L咪唑洗脱缓冲液,5~6:50 mmol/L咪唑洗脱缓冲液,7~10:100 mmol/L咪唑洗脱缓冲液,11:200 mmol/L咪唑洗脱缓冲液,12~13:300 mmol/L咪唑洗脱缓冲液,14:400 mmol/L咪唑洗脱缓冲液,15~16:500 mmol/L咪唑洗脱缓冲液。
2.9 复性结果
未加透析促进剂透析,溶液出现沉淀现象,分别取上清和沉淀进行电泳,结果如图10所示,上清中目的蛋白含量较低,蛋白集中在沉淀中,说明复性促进剂对目的蛋白的复性有着非常重要的作用;添加复性促进剂的SDSPAGE 和 Western Blot的结果显示,透析结束后,上清液中目的蛋白的含量明显增加,说明包涵体已由不可溶转化成可溶的蛋白,最终获得的可溶性蛋白浓度是标准品浓度0.68 mg/mL,复性回收率为61.7%。
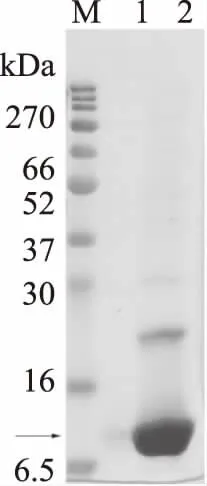
图9 未加复性剂透析结果Fig.9 SDSPAGE without renaturation accelerator after dialysis 注:M:maker;1:透析后上清,2:透析后沉淀。
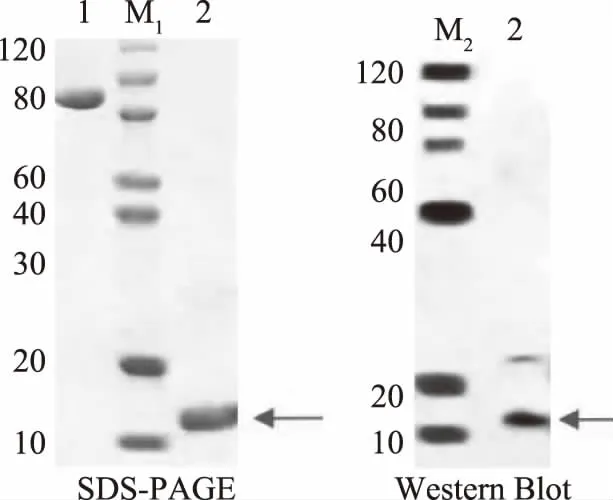
图10 透析后上清液电泳结果Fig.10 SDSPAGE and Western Blot of liquid supernatant after dialysis 注:1:牛血蛋白清,2:重组蛋白,M1:蛋白电泳marker,M2:组氨酸抗体。
2.10 酶活结果
由图11酶活测定结果显示,复性之后的获得的目的蛋白可以使副溶血弧菌vp17802的OD450 nm下降0.5左右,证明其对副溶血弧菌有明显的抑制作用。
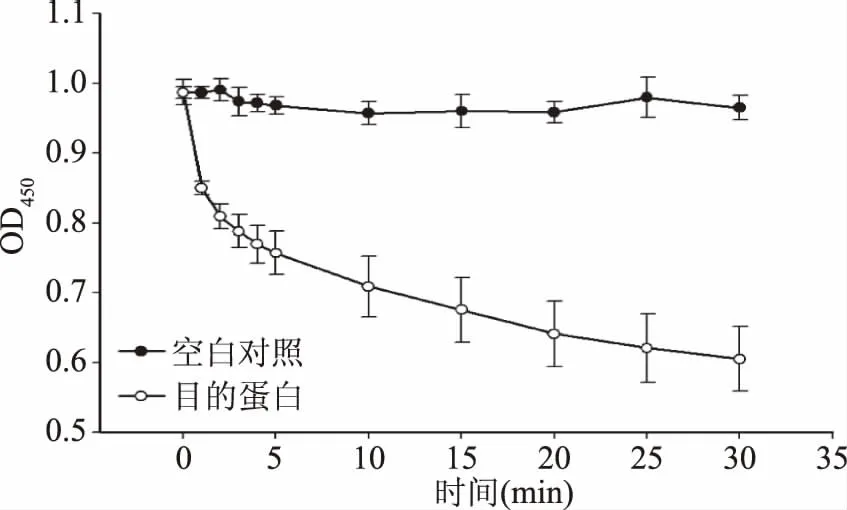
图11 酶活测定结果Fig.11 The results of enzyme activity
3 结论
本研究成功克隆和表达的工程菌pET30a-CHAP,通过IPTG的诱导表达,确定最佳诱导条件为诱导温度为16 ℃,IPTG终浓度0.5 mmol/L,诱导时间为7 h,确定了重组菌的表达形式为没有活性的包涵体。本实验将表达的pET30aCHAP包涵体蛋白先用洗涤剂洗涤一次,去除杂蛋白,然后用尿素变性剂溶解,Ni2+SepharoseTM6 Fast Flow亲和层析柱进行层析将杂蛋白进行纯化,再用EDTA,氧化型谷胱甘肽、还原型谷胱甘肽等作为折叠复性促进剂,经过透析得到可溶性的 pET30aCHAP蛋白。此研究为利用内溶素防控副溶血弧菌以及其他革兰氏阴性细菌提供了制备方法。
[1]李楚楚,李伟燕,潘建义. 副溶血弧菌Ⅲ型分泌系统(T3SS)效应蛋白及其对宿主细胞的操控[J]. 中国生物化学与分子生物学报,2017,33(3):247251.
[2]Elmahdi S,Dasilva L V,Parveen S. Antibiotic resistance of Vibrio parahaemolyticus andVibriovulnificusin various countries:A review[J]. Food Microbiology,2016,57:128134.
[3]Fang L,Guan W Y,Alam M J,et al. Pulsedfield gel electrophoresis typing of multidrugresistantVibrioparahaemolyticusisolated from various sources of seafood[J]. Journal of Health Science,2009,55(5):783789.
[4]Gerstmans H,RodríguezRubio L,Lavigne R,et al. From endolysins to Artilysin®s:novel enzymebased approaches to kill drugresistant bacteria[J]. Biochem Soc Trans,2016,44(1):123128.
[5]Rodríguezrubio L,Gutiérrez D,Donovan D M,et al. Phage lytic proteins:biotechnological applications beyond clinical antimicrobials[J]. Critical Reviews in Biotechnology,2015,36(3):542.
[6]Briers Y,Lavigne R. Breaking barriers:expansion of the use of endolysins as novel antibacterials against Gramnegative bacteria.[J]. Future Microbiology,2015,10(3):377.
[7]王伟宇,林洪,王静雪. 副溶血弧菌噬菌体qdvp001重组内溶素诱导表达以及理化性质初步研究[J]. 食品工业科技,2016,37(16):205.
[8]Wang W,Li M,Lin H,et al. TheVibrioparahaemolyticus-infecting bacteriophage qdvp001:genome sequence and endolysin with a modular structure[J]. Archives of Virology,2016,161(10):18.
[9]Alves Filho J G,Do Nascimento A S,Gondim A C,et al. Isoform characterisation,heterologous expression and functional analysis of two lectins from Vatairea macrocarpa[J]. Protein & Peptide Letters,2013,20(11):1204.
[10]Sunitha K,Chung B H,Jang K H,et al. Refolding and purification of Zymomonas mobilis levansucrase produced as inclusion bodies in fedbatch culture of recombinantEscherichiacoli[J]. Protein Expression and Purification,2000,18(3):388393.
[11]Duarte C A,Palomino M. An improved method for purification and refolding of recombinant HIV Vif expressed inE.coli[J]. Biotechnology & Applied Biochemistry,2017.
[12]Lange C,Rudolph R. Suppression of protein aggregation by Larginine[J]. Current Pharmaceutical Biotechnology,2009,10(4):40814.
[13]Corralesgarcia L,Ortiz E,Castaedadelgado J,et al. Bacterial expression and antibiotic activities of recombinant variants of humanβdefensins on pathogenic bacteria and M tuberculosis[J].Protein Expression and Purification,2013,89(1):3343
[14]SanMiguel T,PérezBermúdez P,Gavidia I. Production of soluble eukaryotic recombinant proteins in E.coli,is favoured in early logphase cultures induced at low temperature[J]. Springerplus,2013,2(1):89.
[15]Studier F. Protein production by autoinduction in high-density shaking cultures[J]. Protein Expression & Purification,2005,41(1):207234.
[16]Walmagh M,Briers Y,dos Santos SB,et al. Characterization of modular bacteriophage endolysins from Myoviridae phages OBP,201φ21 and PVPSE1[J]. Plos One,2012,7(5):e36991.
