不同酯化度的柑橘果胶对Pb2+的吸附作用影响及其机理研究
2018-04-12梁瑞红李鹏琳贺小红况苗苗刘成梅
梁瑞红,李鹏琳,贺小红,况苗苗,陈 军,刘成梅
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
自然环境中重金属是普遍存在的,但是当人体从环境或食物链中摄入的某些重金属元素超过人体所适应范围,体内不同元素间固有的比例被破坏,这时就会对人体的健康产生危害[1]。重金属污染导致的食品安全问题是我国“十二五”规划重点防范的对象。而铅是食品中重金属污染严重的问题之一,它会对人体的肾脏、神经系统、心血管系统和生殖系统等造成损伤,并具有致突变和致癌性。铅中毒已成为影响人类健康和国计民生的重大问题[2],解决铅污染问题对于提升我国食品安全水平具有非常重要的意义。
目前,除铅技术常用的有絮凝/沉淀、吸附、反向渗透、电化学技术和离子交换等,其中吸附技术是目前最受关注的,被认为是未来的发展方向[3]。目前已有研究表明柑橘皮具有显著吸附重金属的能力,被认为是一种低价高效的生物吸附剂[46]。江西省是我国柑橘主产区,2011年全省柑橘栽培面积达462万亩,产量达356.7万吨[7],每年柑橘加工产生大量的副产物柑橘皮。而果胶则被认为是柑橘皮吸附重金属的主要作用物质[89]。通常果胶在食品、化工、生物医药等行业作为添加剂(如凝胶剂、增稠剂、药物载体等)和功能因子(如预防和减少癌症、抗氧化和促进肠道健康等)被广泛应用[10]。近年来果胶作为Pb2+吸附剂的研究备受关注[1113]。如Khotimchenko等[14]报道低酯果胶作为Pb2+的吸附剂可以在30 min内吸附400 mg/g Pb2+;Wai等[15]报道1.0 g/100 mL的柑橘果胶可移除68.75% 10 mmol/L的Pb2+等,这些均表明果胶作为Pb2+的优良生物吸附剂具有较好的前景。
为了探索果胶酯化度对Pb2+吸附的影响规律及其机理,本文考察不同酯化度果胶对Pb2+的吸附量的影响,并从吸附动力学和热力学特性来推测果胶吸附Pb2+的机理。
1 材料与方法
1.1 材料与仪器
柑橘果胶 上海SigmaAldrich公司;氢氧化钠、氯化钠、硝酸铅 分析纯,西陇化工股份有限公司;盐酸、硝酸 分析纯,上海试剂一厂;异丙醇、无水乙醇 分析纯,上海振兴化工一厂;溴化钾(纯度≥99.5%) 上海国药化学试剂有限公司;60%的异丙醇溶液 量取1200 mL的异丙醇用蒸馏水定容到2000 mL,备用;1 mol/L的异丙醇盐酸混合液 量取166.667 mL的盐酸用60%的异丙醇定容到2000 mL,备用。
Delta320 pH计 上海精密仪器仪表有限公司;Nicolet 5700红外光谱仪 美国Thermo公司;X852S型恒温磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;DW86L390超低温冰箱 青岛澳柯玛超低温冷冻设备有限公司;Alpha12LD冷冻干燥机 美国Labconco公司;HHS26恒温水浴锅 金坛市梅香仪器有限公司;TAS990F原子分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 样品的制备 采用酸法制备具有不同酯化度的果胶[16]。用60%的异丙醇溶液配制盐酸浓度为1 mol/L的异丙醇—盐酸混合液,置于4 ℃的冰箱备用;将3 g柑橘果胶加入到100 mL异丙醇—盐酸混合液,接着在冰水浴中搅拌,使其充分溶解后置于4 ℃冰箱,平行4组,分别于2、6、10、14 d后取出;取出后的溶液先加入60 mL的无水乙醇以沉淀果胶,经抽滤后再依次用60%的异丙醇溶液和0.1 mol/L NaCl溶液进行多次洗涤,最后在80 ℃,2 Pa下真空冷冻干燥48 h得到样品。
1.2.2 FTIR光谱分析 将冷冻干燥的果胶样品与一定量的KBr粉末一起研磨压片置于操作台,在4000~450 cm-1频率范围下扫描[17],用红外光谱仪记录光谱。根据红外光谱分析仪记录的1750、1620 cm-1处峰的面积计算出果胶样品的酯化度(DE)。
1.2.3 不同pH下果胶吸附Pb2+情况 将硝酸铅溶于去离子水中,配制成浓度为20 mg/L的铅离子溶液,备用。分别移取10 mL的铅离子溶液依次加入小烧杯中;用1 mol/L的硝酸溶液和1 mol/L的氢氧化钠溶液将铅离子溶液pH分别调为2.0、3.0、4.0、5.0、6.0、7.0;再分别将0.03 g制备的不同酯化度果胶样品加入其中,在30 ℃下以150 r/min搅拌40 min。采用原子吸收分光光度计测定初始Pb2+浓度和经吸附后上清液中的Pb2+浓度。用下式计算吸附量(q)[18]:
式(1)
式中:V代表溶液的体积(mL);C0和Ce分别表示初始铅离子的浓度和平衡时的浓度(mg/L);m表示所用吸附剂的质量(mg)。
1.2.4 果胶吸附Pb2+热力学考察 用1 mol/L的硝酸溶液和1 mol/L氢氧化钠溶液将上述配制的铅离子溶液的pH调为5.0;分别移取10 mL该溶液依次加入小烧杯中;再分别将0.03 g制备的不同酯化度果胶样品加入其中,分别在277、293、303、323、343、363 K下,以150 r/min搅拌90 min。采用原子吸收测定初始Pb2+浓度和经吸附后上清液中的Pb2+浓度。然后根据热力学公式计算热力学参数焓变、熵变和吉布斯自由能[1921]。
1.2.5 果胶吸附Pb2+动力学考察 用1 mol/L的硝酸溶液和1 mol/L氢氧化钠溶液将上述配制的铅离子溶液的pH调为5.0;分别移取10 mL该溶液依次加入小烧杯中;再分别将0.03 g制备的不同酯化度果胶样品加入其中,在30 ℃下,以150 r/min分别搅拌0、20、40、60、80、120、140 min。采用原子吸收测定初始Pb2+浓度和经吸附后上清液中的Pb2+浓度。然后采用准一级、准二级,Intraparticle diffusion模型和Boyd kinetic模型[17,22]进行分析。
2 结果与分析
2.1 FTIR分析
从图1中可以看出,样品的红外光谱图相似,只是1751.57和1638.52 cm-1处的峰面积发生了改变。其特征吸收峰主要有3448.39、2935.63、1751.57、1638.52、1105.79、1015.28 cm-1,而这些特征吸收峰分别是由OH、CH、(C=O)COOMe、COO、COC和CC振动引起的[15]。根据本实验室前期研究建立的酯化度与红外光谱中1751.57 cm-1和1638.52 cm-1处峰面积比值的关系[23],可以计算出制备的样品酯化度。经计算得出本研究制备的四种不同酯化度的果胶样品,其酯化度(DE)分别为82.32%、75.57%、64.56%、55.88%。

图1 不同酯化度果胶的红外光谱图Fig.1 Fourier infrared spectrum of pectin with different degree of esterification
2.2 pH对吸附Pb2+的影响
pH对果胶吸附Pb2+有很大的影响。图2显示了不同酯化度的果胶在不同pH溶液下吸附Pb2+的能力。总体而言,随着果胶酯化度的增大,吸附量增多。酯化度为82.32%、75.57%、64.56%、55.88% 的果胶在pH=5时均达到最大吸附量分别为5.037、4.799、4.598、4.283 mg/g。从图2中还可以看出,四种不同酯化度的果胶在pH为2.0~5.0的范围内,随着pH的增大吸附量增多,这可能是因为在低pH溶液中含量极多的H+和H3O+处于吸附剂表面,相对地减少了Pb2+与果胶的结合位点,随着pH的增大,H+含量减少,相对地增多了Pb2+与果胶的结合位点,导致吸附量随之增多。在pH为5.0~7.0范围内,所有果胶的吸附量降低,这可能是Pb2+与OH-形成了氢氧化铅沉淀造成的[22]。为避免由于pH过高导致金属离子发生沉淀,并创造适合吸附过程的化学环境,以下实验中用到的Pb2+溶液pH均调为5.0。
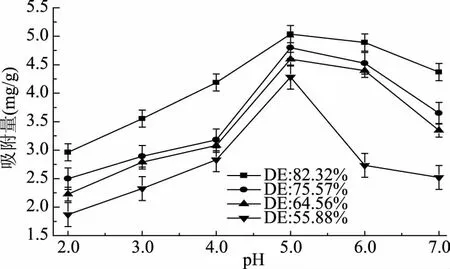
图2 不同pH条件下不同酯化度果胶对铅的吸附作用Fig.2 Effect of pectin with different degree of esterification on the adsorption of Pb2+ under different pH
2.3 吸附热力学考察
在277~363 K的温度范围内实验了四种不同酯化度的果胶对Pb2+吸附量的影响。从图3中可以看出,在277~303 K范围内随温度的升高,吸附量增多,在303 K时吸附量达到最大,酯化度为82.32%、75.57%、64.56%、55.88%的四种果胶在温度由277 K升高至303 K时对Pb2+的吸附量分别由2.619、2.197、1.774、1.211 mg/g增加到4.451、3.606、3.324、2.761 mg/g;从303 K升高至363 K时又分别降低为0.788、0.507、0.366、0.225 mg/g。其中酯化度为82.32%、75.57%、64.56%、55.88%的四种果胶在363 K时对Pb2+的吸附量比在277 K时对Pb2+的吸附量分别降低了1.831、1.690、1.408、0.986 mg/g。四种不同酯化度果胶对Pb2+的吸附量在277~303 K范围内增加,而在303~363 K范围内降低,可能是由于作为吸附剂的果胶其表面吸附位点活性随温度改变而引起的[22]。

图3 不同温度下不同酯化度果胶对铅的吸附性Fig.3 Effect of pectin with different degree of esterification on the adsorption of Pb2+ under different temperature
为了明确果胶吸附铅离子过程中的热力学性质,可以借助热力学参数吉布斯自由能(ΔG0),焓变(ΔH0)和熵变(ΔS0)来判断和估计吸附进行的难易程度[1921]。
它们的计算公式为:
ΔG0=RT ln Kc
式(2)
而物理学中ΔG0、ΔH0、ΔS0三者的关系式为:
ΔG0=ΔH0TΔS0
式(3)

式(4)
式中:R为气体常数(8.314 J/mol·K);T为开尔文温度(K);Kc为热力学常数。
然后以logKc对1/T作图得到图4,由直线的斜率和截距可以算出ΔH0和ΔS0,再由公式(3)得出ΔG0。

图4 果胶吸附铅的热力曲线Fig.4 Thermodynamic curve of adsorption experiment in pectin
表1中R2表示实验得到的吸附量实际值与计算出的吸附量理论值线性相关系数。由表1中的热力学参数可知,酯化度为82.32%、75.57%、64.56%、55.88%的四种果胶对Pb2+吸附的过程中ΔH0分别为16.56、18.04、20.59、21.64 J/mol,逐渐增大且均为正数,说明四种不同酯化度的果胶对Pb2+的吸附是一个吸热的过程;吉布斯自由能ΔG0可以对反应进行的方向和方式进行判断,四种不同酯化度的果胶对Pb2+吸附过程中,随温度升高ΔG0值逐渐减小且均为负数,说明反应为自发的一个过程;熵变ΔS0代表整个反应体系内部存在状态的混乱程度,四种果胶的ΔS0值为正数,说明在吸附实验进行的过程中Pb2+可以与其它更多离子进行交换,酯化度为82.32%、75.57%、64.56%、55.88%的四种果胶的ΔS0分别为104.12、110.35、120.49、126.75 J/mol·K,说明体系无序性增强,这可能是在吸附过程中也有物理吸附参与作用,因为溶液中的H+、H3O+在吸附过程中逐渐减少[24]。
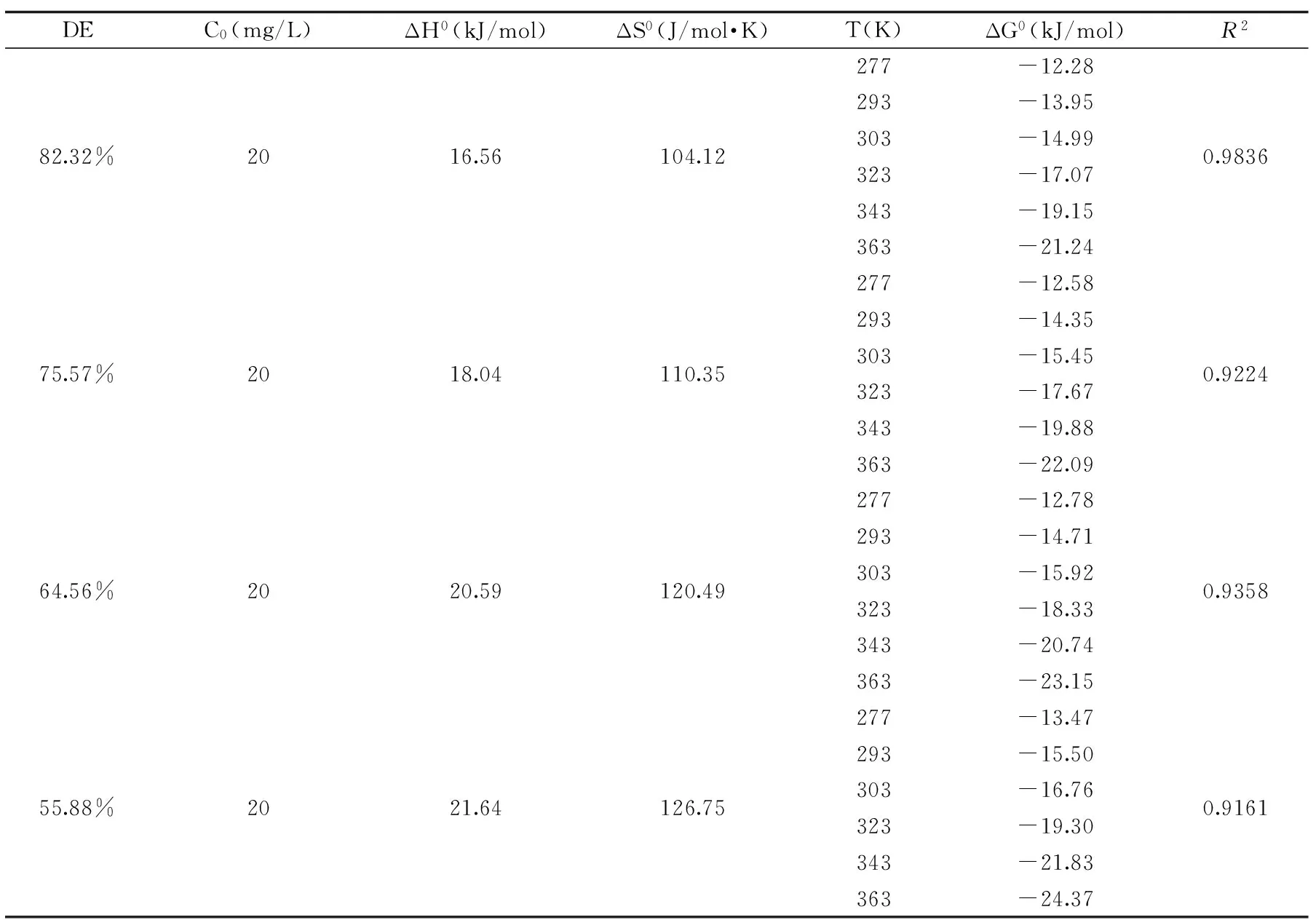
表1 四种不同酯化度果胶吸附铅的热力学参数Table 1 Thermodynamic parameters of adsorption experiment in pectin
2.4 吸附动力学考察
吸附量随时间变化的结果如图5所示,四种不同酯化度的果胶对Pb2+的吸附速率都很快,随着时间增长,吸附量增多,在40 min后基本达到平衡。刚开始吸附速率快可能是因为果胶表面有很多吸附基团,随着时间的推移,吸附基团逐渐被消耗掉。四种不同酯化度的果胶吸附铅的变化规律是一致的,但平衡吸附量仍有差异,酯化度为82.32%、75.57%、64.56%、55.88%的四种果胶平衡吸附量分别达到了5.70、4.85、4.10、3.70 mg/g,这可能是因为不同酯化度的果胶表面的吸附基团数量不同,果胶的酯化度越高,表面吸附基团越多,达到平衡时吸附量越大。
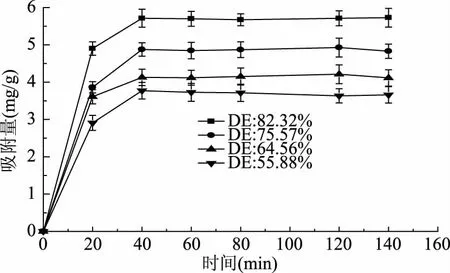
图5 不同时间条件下不同酯化度果胶对铅的吸附效果Fig.5 Effect of pectin with different degree of esterification on the adsorption of Pb2+ under different time
为了探讨吸附机理和速率控制步骤,用吸附动力学模型[17,22]进行模拟:
准一级模型方程表达式为:
式(6)
准二级模型表达式为:
式(7)
式中:qt为t时刻生物吸附剂对铅离子的吸附量(mg/g);qe为吸附平衡时的吸附量(mg/g);k1为准一级动力方程速率常数(min-1);k2为准二级动力学方程速率常数(mg·g-1·min-1)。
表2为动力吸附参数,图6为动力学模型图。图6A为准一级模型,可以看出不能形成直线,拟合相关系数R2值太小,理论的平衡吸附量与实际值相差大,所以它不符合准一级模型;图6B为准二级模型,可看出它接近一条直线,拟合相关系数R2≈ 1,实际与理论的平衡吸附量接近,所以它符合准二级模型,说明果胶吸附Pb2+的速率受化学吸附控制[17]。
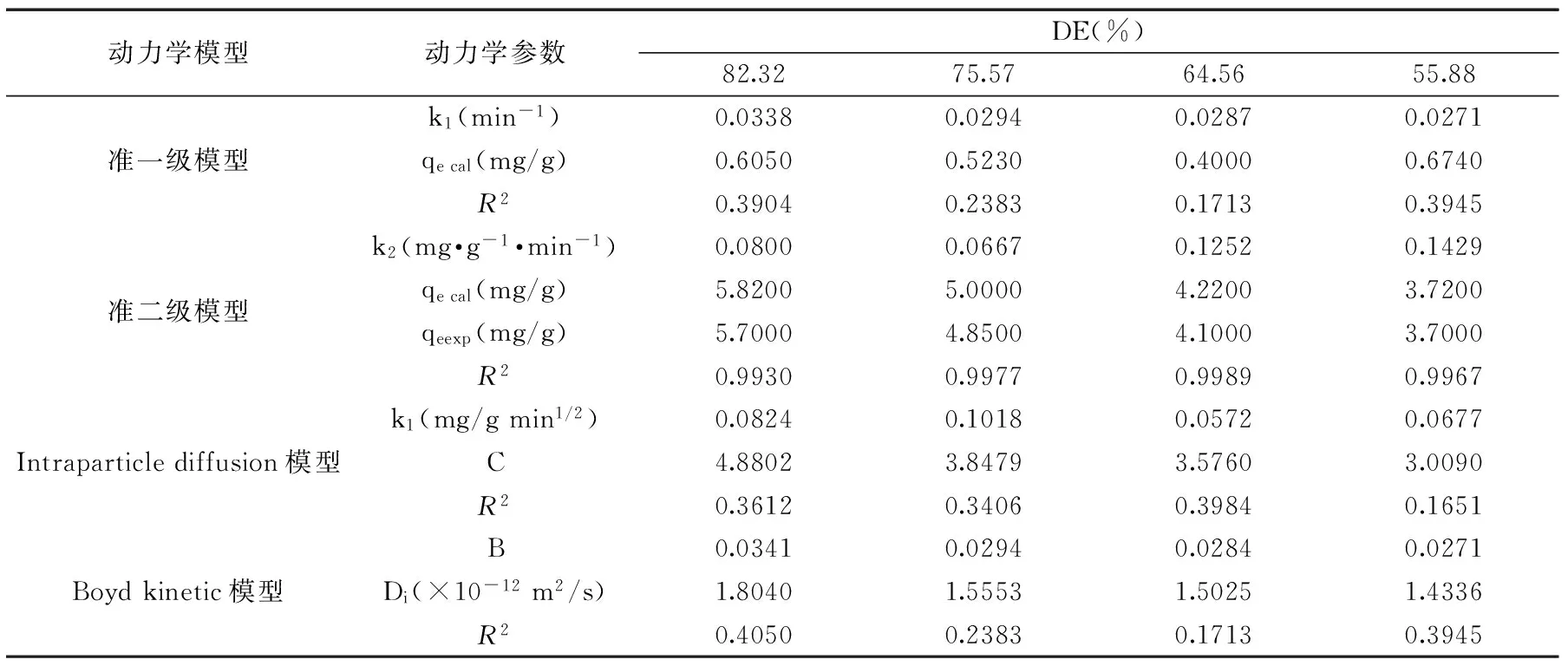
表2 四种不同酯化度果胶吸附铅离子的动力学参数Table 2 The kinetic parameter of adsorption experiment in pectin

图6 不同酯化度的果胶吸附铅离子的动力学模型Fig.6 The kinetic model of adsorption experiment in pectin注:A:准一级模型;B:准二级模型。
准一级模型和准二级模型无法解释吸附机制,也无法确定整个吸附过程中决定吸附Pb2+速率的因素,所以另外引入Intraparticle diffusion和Boyd kinetic[17,22]两种模型。
Intaparticle diffusion表达式:
qt=k1t1/2+C
式(8)
式中:qt为t时刻生物吸附剂对铅离子的吸附量(mg/g);k1为粒子扩散速率常数(mg/g min1/2);C为是吸附剂吸附边界的厚度常数。
Boyd kinetic model表达式:
式(9)
Bt=0.4977ln(1F)
式(10)
式(11)
式中:qt为t时刻生物吸附剂对铅离子的吸附量(mg/g);qe为吸附平衡时的吸附量(mg/g);F为t时刻的吸附百分数;Bt为F的功能函数;Di为有效扩散速率(m2/s);r为吸附剂的有效半径(m)。
表2为动力吸附参数,图7为Intraparticle diffusion模型和Boyd kinetic模型两种动力学模型图。表2中Intraparticle diffusion模型和Boyd kinetic模型的拟合相关系数R2值均太小。图7A为Intraparticle diffusion模型,从中可看出,没有形成直线,且不经过原点,这说明粒子内扩散不仅限制吸附速率,而且对吸附的步骤有影响;四条线的斜率都很小,说明Pb2+在溶液中与果胶表面接触进行吸附,并不会进入果胶内部进行吸附[22]。图7B为Boyd kinetic模型,用于确定吸附过程中吸附进程最慢的一步,从中可看出也没有形成直线,且不经过原点,该模型更好的证明了Pb2+仅与果胶的表面接触进行吸附。

图7 不同酯化度的果胶吸附铅离子的动力学模型Fig.7 The kinetic model of adsorption experiment in pectin注:A:Intraparticle diffusion模型;B:Boyd kinetic模型。
3 结论
研究采用异丙醇—盐酸法制备的四种不同酯化度(82.32%、75.57%、64.56%、55.88%)柑橘果胶对Pb2+吸附作用的影响。结果表明:四种不同酯化度的果胶吸附Pb2+的速度都很快,经过40 min后基本达到平衡,溶液温度为30 ℃(303 K),pH为5.0时吸附效果好。通过四种不同酯化度的果胶在不同溶液pH、温度、吸附时间下吸附Pb2+的实验可知Pb2+的吸附量随酯化度的增大而增多。通过吸附热力学的模拟,发现四种不同酯化度的果胶对Pb2+的吸附是一个自发、吸热的过程;在吸附进行的过程中Pb2+可以与其它更多离子进行交换,且可能存在物理吸附参与作用。通过进行吸附动力学准一级动力方程、准二级动力方程、Boyd kinetic方程、intraparticle diffusion方程的模拟,发现准二级方程(R2≈ 1)可以很好的描述果胶吸附Pb2+,说明吸附速率受化学吸附控制。而且Boyd kinetic方程、Intraparticle diffusion方程的模拟说明四种不同酯化度果胶对Pb2+的吸附是发生在果胶表面并未进入内部。
[1]于晓莉,刘强. 水体重金属污染及其对人体健康影响的研究[J]. 绿色科技,2011(10):123126.
[2]Ji A,Wang F,Luo W,et al. Lead poisoning in China:A nightmare from industrialisation[J]. The Lancet,2011,377(9776):14741476.
[3]Peng Q,Guo J,Zhang Q,et al. Unique lead adsorption behavior of activated hydroxyl group in twodimensional titanium carbide[J]. Journal of the American Chemical Society,2014,136(11):41134116.
[4]Thirumavalavan M,Lai Y L,Lee J F. Fourier transform infrared spectroscopic analysis of fruit peels before and after the adsorption of heavy metal ions from aqueous solution[J]. Journal of Chemical and Engineering Data,2011,56(5):22492255.
[5]Njikam E,Schiewer S. Optimization and kinetic modeling of cadmium desorption from citrus peels:A process for biosorbent regeneration[J]. Journal of Hazardous Materials,2012,213:242248.
[6]Schiewer S,Balaria A. Biosorption of Pb2+by original and protonated citrus peels:equilibrium,kinetics,and mechanism[J]. Chemical Engineering Journal,2009,146(2):211219.
[7]刘勇.江西柑橘多收了近90万吨销售战即将圆满收官[N/OL].江西省信息中心江西省电子政务网络管理中心. http://www.jx.xinhuanet.com/news/201204/06/content_25018319. htm.
[8]Schiewer S,Iqbal M. The role of pectin in Cd binding by orange peel biosorbents:A comparison of peels,depectinated peels and pectic acid[J]. Journal of Hazardous Materials,2010,177(1):899907.
[9]FENG N,GUO X. Characterization of adsorptive capacity and mechanisms on adsorption of copper,lead and zinc by modified orange peel[J]. Transactions of Nonferrous Metals Society of China,2012,22(5):12241231.
[10]Srivastava P,Malviya R. Sources of pectin,extraction and its applications in pharmaceutical industryAn overview[J]. Cheminform,2011,42(42):2037.
[11]Khotimchenko M,Poleschuk T,Savchenko O,et al. Comparative leadremoving activity of the nonstarch polysaccharides[J]. Journal of Medical Sciences,2013,13(8):647.
[12]Mata Y N,Blázquez M L,Ballester A,et al. Studies on sorption,desorption,regeneration and reuse of sugarbeet pectin gels for heavy metal removal[J]. Journal of Hazardous Materials,2010,178(1):243248.
[13]Mata Y N,Blázquez M L,Ballester A,et al. Optimization of the continuous biosorption of copper with sugarbeet pectin gels[J]. Journal of Environmental Management,2009,90(5):17371743.
[14]Khotimchenko M,Kovalev V,Khotimchenko Y. Equilibrium studies of sorption of lead(II)ions by different pectin compounds[J]. Journal of Hazardous Materials,2007,149(3):693699.
[15]Wai W W,AlKarkhi A F M,Easa A M. Comparing biosorbent ability of modified citrus and durian rind pectin[J]. Carbohydrate Polymers,2010,79(3):584589.
[16]ElNawawi S A,Heikal Y A. Production of a low ester pectin by deesterification of high ester citrus pectin[J]. Carbohydrate Polymers,1995,27(3):191195.
[17]Zhang L,Ye X,Ding T,et al. Ultrasound effects on the degradation kinetics,structure and rheological properties of apple pectin[J]. Ultrasonics Sonochemistry,2013,20(1):222231.
[18]Khotimchenko M Y,Kolenchenko E A,Khotimchenko Y S,et al. Cerium binding activity of different pectin compounds in aqueous solutions[J]. Colloids and Surfaces B:Biointerfaces,2010,77(1):104110.
[19]Özer A,Özer D. Comparative study of the biosorption of Pb(II),Ni(II)and Cr(VI)ions ontoS.cerevisiae:Determination of biosorption heats[J]. Journal of Hazardous Materials,2003,100(1):219229.
[20]Yurtsever M,Sengil I A. Biosortion of Pb(II)ions by modified quebracho tannin resin[J]. Journal of Hazardous Materials,2009,163(l):5864.
[21]Özer A,Akkaya G,Turabik M. Biosorption of acid blue 290(AB 290)and acid blue 324(AB 324)dyes on Spirogyra rhizopus[J]. Journal of Hazardous Materials,2006,135(1):355364.
[22]Senthil Kumar P. Adsorption of lead(II)ions from simulated wastewater using natural waste:A kinetic,thermodynamic and equilibrium study[J]. Environmental Progress and Sustainable Energy,2014,33(1):5564.
[23]Liang R,Chen J,Liu W,et al. Extraction,characterization and spontaneous gelforming property of pectin from creeping fig(FicuspumilaLinn.)seeds[J]. Carbohydrate Polymers,2012,87(1):7683.
