一种经皮种植体抗菌肽控释涂层的构建及性能研究
2018-04-12苗强夏雨凝蒙萌张征宇马楚凡
苗强 夏雨凝 蒙萌 张征宇 马楚凡
经皮钛种植体在临床上应用广泛,如骨锚式助听器、牙科植入物、颌面赝复体、心室辅助装置等等,但由于皮肤结构和组成特殊性,如皮脂腺和毛囊的存在,同时体表为有菌环境,使经皮种植体在皮肤整合过程中有着远高于口内种植体的感染率与失败率[1-2]。
为了解决经皮种植体感染率高的问题,许多学者尝试改变植入物的表面形貌、增大表面积从而增强植入物与经皮部位的整合,维持表皮屏障,以减少细菌的侵入、定植,降低感染风险[3-4]。
研究表明,微米级表面可以在植入物与皮肤结合处形成机械锁扣结构,阻止上皮下行,从而促进皮肤整合[3];而纳米管结构有助于植入物与皮肤的整合,而且可以装载药物,纳米管结构本身也有一定的抗菌性能[5]。但是,增大植入物表面积的同时也增加了病原体粘附几率,不利于感染控制。因此即使经过严格的消毒与感染控制,经皮种植手术之后细菌侵袭仍然常有发生,经皮部位感染主要由金黄色葡萄球菌,凝固酶阴性葡萄球菌引起[6-7],且种植体经皮部位在愈合过程中处于有菌状态,因此仅仅依靠改变种植体经皮段或经皮基台的表面形貌不足以满足抗菌需求。
在种植体穿皮肤段进行药物装载,提高抗感染能力的同时促进与皮肤的整合,是一种非常有前景的方法。但目前常用的银离子、化学药物、抗生素等还存在细胞毒性、耐药性等问题[8-11]。抗菌肽是一类生物机体产生的自我防御性的小分子多肽,具有高效、广谱的抗菌性能,且具有较好的生物安全性以及不易产生耐药性等优势[12];其中抗细菌肽HHC-36具有良好的应用前景。直接在植入体表面加载药物虽然可以提高抗菌能力,但由于药物会在很短时间流失、代谢掉,难以在术后的高危感染期保持最小的抑菌浓度,使用效果不佳。因此需要使用高分子聚合物、高分子微球如聚(乳酸-乙醇酸)(PLGA)、聚乳酸乙醇酸酯(PGLA)、聚苹果酸、石墨烯微胶囊等等作为缓释剂,来抑制药物突释,实现药物的持续释放。其中PDLLA生物相容性好,可降解为对机体无毒、无刺激性的物质,是目前最常用的一类缓释剂[13]。
因此,为解决目前经皮钛种植体感染率高的问题,本试验使用钛纳米管为载体,研究在其表面构筑PDLLA缓释的HHC-36抗菌涂层的方法,并测试涂层的体外药物缓释效果和抗菌性能。
1 材料与方法
1.1 主要试剂与仪器
所有试剂均为分析纯,购自西安飞扬生物科技有限公司,抗菌肽由上海生工生物工程股份有限公司合成,金黄色葡萄球菌由第四军医大学口腔医院微生物实验室提供,稳压电源 (TPR6010S,深圳市安泰信科技有限公司),紫外分光光度计 (UV-1600,上海美谱达仪器有限公司)。
1.1.1 TiO2纳米管的制备及抗菌肽装载 采用阳极氧化法制备二氧化钛纳米管。直径10 mm、厚1 mm纯钛片,在400ml去离子水中加入5ml HF,一定速度磁力搅拌下,阳极放入钛片,阴极为碳棒,20 V电压下阳极氧化处理4 h。
采用溶剂浇铸法在制备好的二氧化钛纳米管表面加载药物。精确秤取2.0 g PDLLA,充分溶解于乙酸乙酯中,加入0.1 g抗菌肽,超声振荡,形成5%分散均匀的悬浊液,将试件载药面浸没在浊液中2 min,取出静置晾干后再次浸入,重复3次,室温下过夜干燥,乙酸乙酯挥发后获得载药试件。
1.1.2 缓释性能的测定 将载药试件放入1×PBS中,37℃水浴,在不同时间点取出2 ml PBS并补充,第1天0~5 h共取6次,第2~15天每日11:00 AM取样,通过回归方程测定取出液中抗菌肽浓度,记录释放量。
1.1.3 抗菌性能测试 试件抑菌圈测定:选用金黄色葡萄球菌为指示菌,试验前将冷冻保存的菌种划线接种至平板培养基,37℃培养24 h;挑单菌落接种至100 ml液体培养基,37℃、200 r/min摇床培养过夜,菌液备用。使用预加菌液倾注平板法制备试验平板,往已冷却至50℃左右的琼脂平板培养基中注入一定量的菌液,混合均匀,倾注平板 (约20 ml/平板),水平静置凝固后备用。
抗菌试验的试件分为3组,1组为PDLLA复合抗菌肽涂层的试验组,2组为只加载PDLLA的对照组,3组为未载药的空白对照组。,以环氧乙烷消毒,置入含金黄色葡萄菌的MH琼脂平板中心位置,载药面对培养基。37℃恒温箱培养24 h,取出,观察抑菌效果,并用游标卡尺测量抑菌圈大小。
2 结 果
2.1 TiO2纳米管表面形貌观察
样品扫描电镜观察结果(图1A),可见有序排列的纳米管阵列,20 V管径约为80~120 nm。
载药后电镜结果(图1B),可见管口药物覆盖。
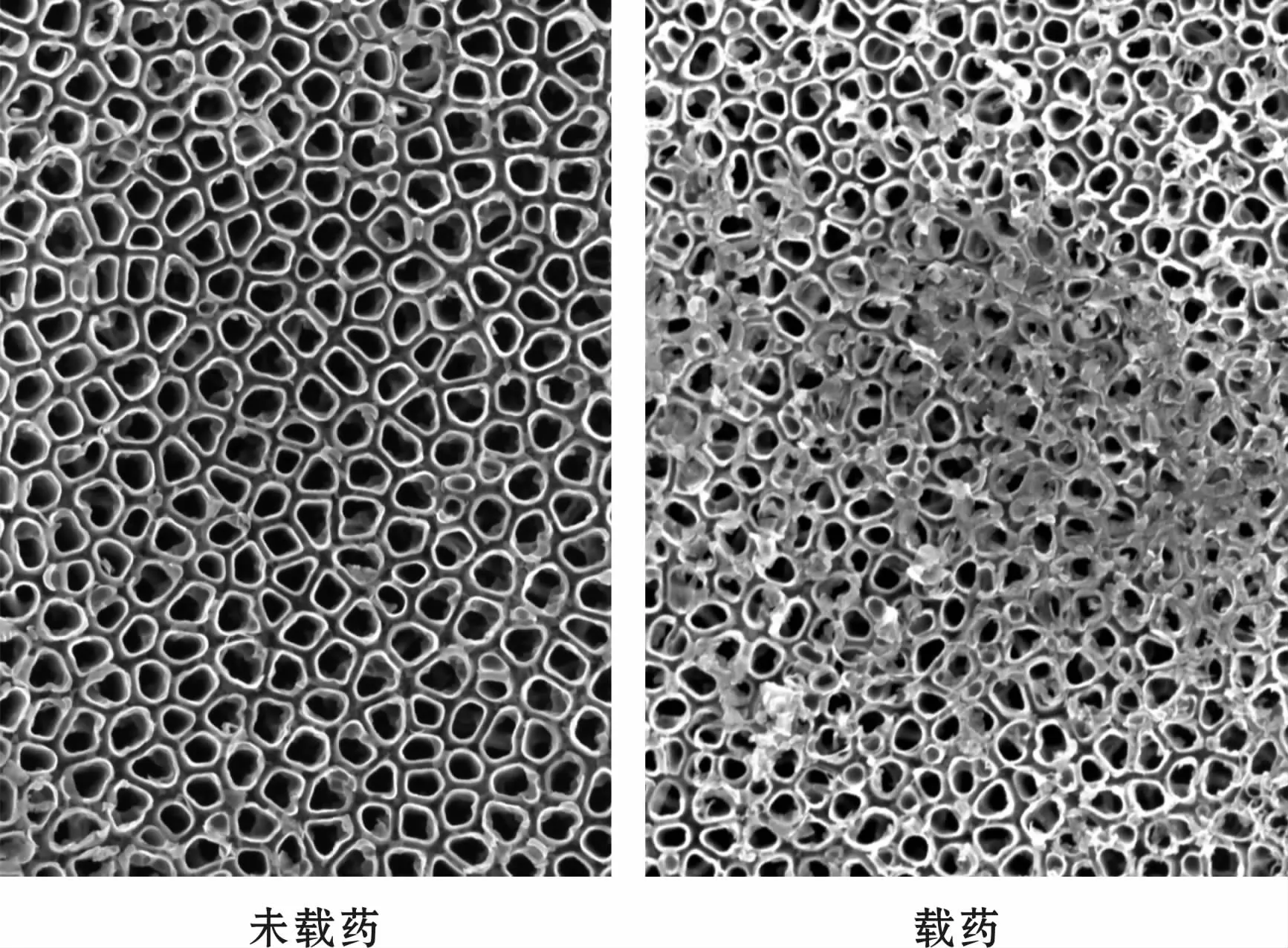
图1 TiO2纳米管表面形貌(扫描电镜,×50 000)Fig 1 Surface form of the TiO2 nanotube(SEM,×50 000)
2.2 缓释性能的测定
按实验方法中所述取样,结果见表1。
2.3 抗菌性能测试
在金黄色葡萄球菌平板上装载试件,获得了清晰明显的抑菌圈,且10 d后再次测定,抑菌圈大小基本没有变化且无细菌长入,抑菌圈大小约15 mm(图2)。
3 讨 论
TiO2纳米管制备设备和工艺简单,适宜于在形状复杂的物体如种植体表面形成涂层[14]。表面的纳米管结构可以提高细胞粘附与增殖[15],从而更好的与皮肤整合,促进经皮封闭[16-17],纳米管结构本身具有一定的药物装载能力,同时也具有一定的抗菌性能。
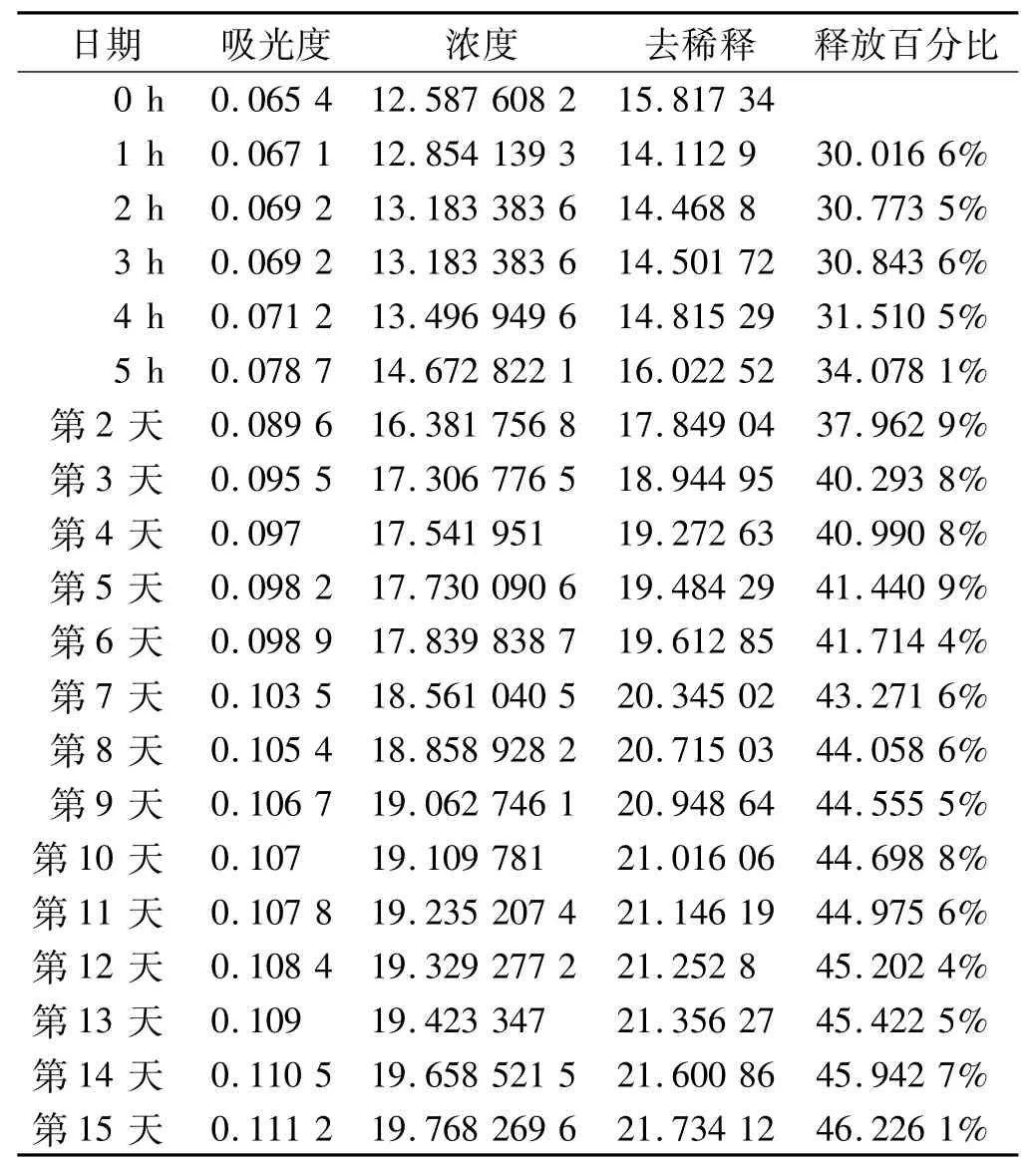
表1 缓释实验吸光度及累计释放百分比Tab 1 Absorbance and cumulated release percent
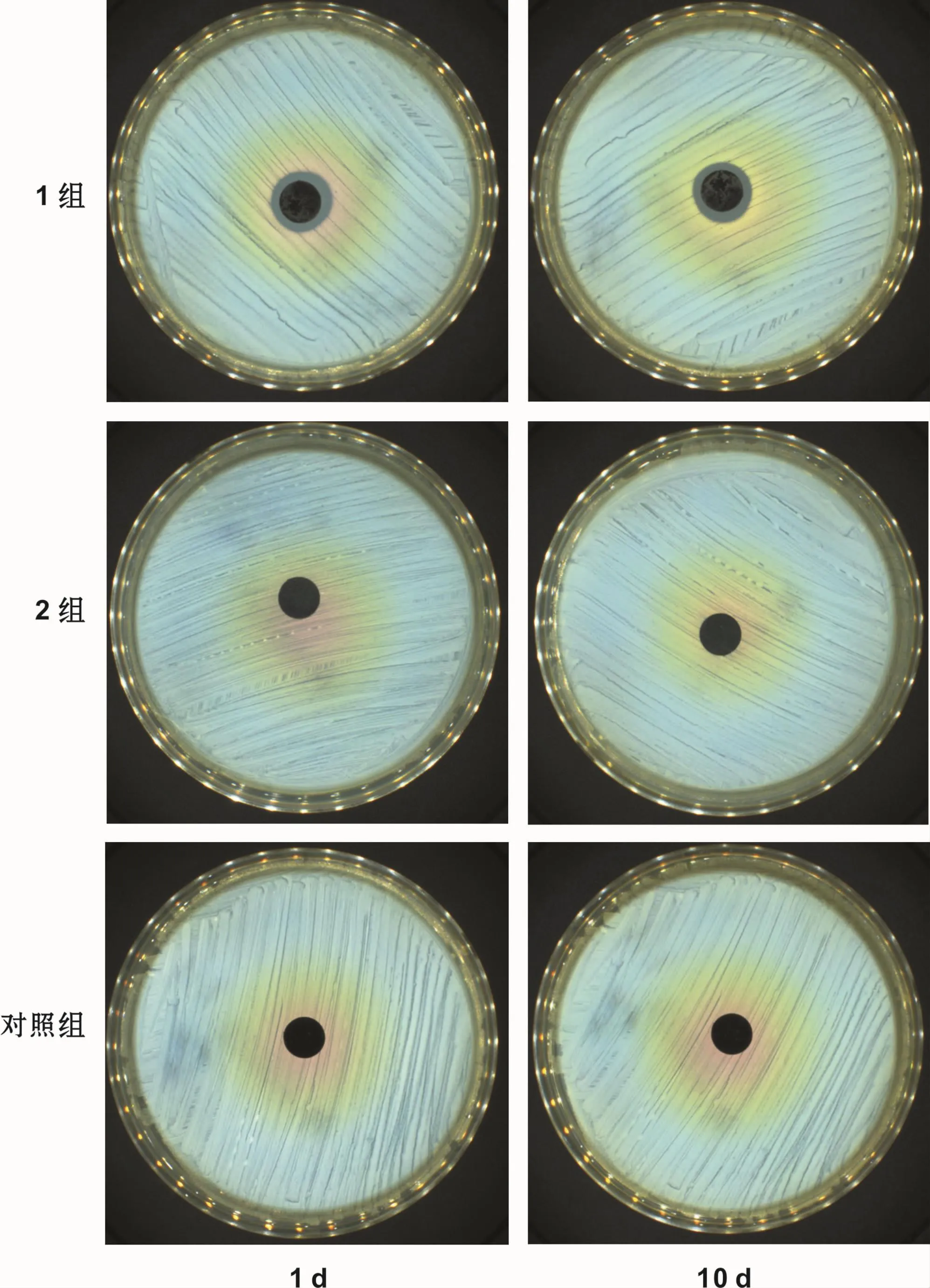
图2 抑菌实验结果Fig 2 Diameter of the inhibition zone
术后植入物表面不可避免的会有细菌定植并形成细菌生物膜,由于菌膜的存在,生物膜中的细菌耐药性更高,常规抗生素治疗通常无法减少术后种植体周围感染率[18-19]。理想的方式是在植入体表面构建载药涂层,使药物从生物膜内部缓释并持续作用一段时间,植入体本身虽然有一定的载药能力,然而其一般没有控释能力,难以在术后一定时间的高危感染期保持最小抑菌浓度。HHC-36是一种具有广谱抗菌能力的抗菌肽,已有实验证明可以有效杀死经皮感染中常见的金黄色葡萄球菌及革兰氏阳性菌[20]。PDLLA作为植入物涂层的缓释材料,不仅有良好的生物相容性,且机械稳定性良好,具有良好的抗血栓能力[13]。
经皮种植体所处皮肤环境易于细菌附着,有证据表明即使经过严格的消毒与感染控制,经皮种植手术之后细菌侵袭仍然常有发生,经皮部位感染主要由金黄色葡萄球菌,凝固酶阴性葡萄球菌引起[6-7]。抗菌肽是一类非常有前景的生物活性抗菌剂,通常为两亲性阳离子肽,抗菌谱广,其抗菌机制主要为使细菌细胞膜紊乱、抑制其生物大分子合成与表达[21]。Menghan等[22]使用真空辅助的物理吸附方法在80 nm管径的纳米管表面构建了HHC-36抗菌肽涂层,HHC-36抗菌活性测试表明其可以有效杀死金黄色葡萄球菌与格兰氏阳性菌,加载于TiO2纳米管表面后周围细菌灭杀率达到99.9%,且可以有效降低4 h后附着与表面的细菌总数,抗菌肽还有着几乎不产生耐药性的特点[23]。
本实验在20 V电压下阳极氧化获得了管径为80~120 nm的TiO2纳米管试件,并使用了PDLLA作为缓释剂在TiO2纳米管试件表面成功构筑了载HHC-36抗菌肽的缓释涂层,测定了载药试件15 d的药物释放,获得表1结果,除第1~2天有一个小幅度突释,后测试的连续14 d均有持续稳定的药物释放,且15 d药物释放比达到了46%,可以认为载药试件具有良好的缓释性能。在抑菌圈实验中可见试件周围约15 mm左右抑菌圈,且10 d之后测定抑菌圈大小基本没有变化,抑菌圈内也无细菌长入,表明所构建载药试件有持续有效的抗菌作用。
4 结 论
在100 nm管径TiO2纳米管试件表面成功构建了以PDLLA为缓释剂的HHC-36抗菌肽涂层,并测定了载药量与缓释曲线。对所构建载药试件的抗菌性能做了相关研究,证明了试件具有良好抗菌性能。
[1]Tillander J,Hagberg K,Hagberg L,et al.Osseointegrated titanium implants for limb prostheses attachments:Infectious complications[J].Clin Orthop Relat Res,2010,468(10):2781-2788.
[2]Jeyapalina S,Beck JP,Bachus KN,etal.Efficacy of a porous-structured titanium subdermal barrier for preventing infection in percutaneous osseointegrated prostheses[J].JOrthop Res,2012,30(8):1304-1311.
[3]Walboomers XF,Jansen JA.Effectofmicrotextured surfaces on the performance of percutaneous devices[J].J Biomed Mater Res A,2005,74(3):381-387.
[4]Kim H,MurakamiH,Chehroudi B,etal.Effects of surface topography on the connective tissue attachment to subcutaneous implants[J].Int JOral Maxillofac Implants,2006,21(3):354-365.
[5]Tan J,Li Y,Liu Z,et al.Anti-infection activity of nanostructured titanium percutaneous implants with a postoperative infectionmodel[J].App Sur Sci,2008,254(8):2441-2449.
[6]von Eiff C,Jansen B,Kohnen W,etal.Infections associated with medical devices:Pathogenesis,management and prophylaxis[J].Drugs,2005,65(2):179-214.
[7]ZimmerliW,Ochsner PE.Managementof infection associated with prosthetic joints[J].Infection,2003,31(2):99-108.
[8]Wahlig H,Dingeldein E.Antibiotics and bone cements.Experimental and clinical long-term observations[J].Acta Orthop Scand,1980,51(1):49-56.
[9]Antoci V Jr,Adams CS,Hickok NJ,et al.Antibiotics for local delivery systems cause skeletal cell toxicityin vitro[J].Clin Orthop Relat Res,2007,462:200-206.
[10]Ince A,Schütze N,Hendrich C,et al.Effect of polyhexanide and gentamycin on human osteoblasts and endothelial cells[J].Swiss Med Wkly,2007,137(9-10):139-145.
[11]Ince A,Schütze N,Hendrich C,etal.In vitro investigation of orthopedic titanium-coated and brushite-coated surfaces using human osteoblasts in the presence of gentamycin[J].JArthroplasty,2008,23(5):762-771.
[12]Ma M.Local delivery of antimicrobial peptides using selforganized TiO2nanotubes for implant-related infections[D].UK:UBC,2010.
[13]Shive MS,Anderson JM.Biodegradation and biocompatibility of PLA and PLGA microspheres[J].Adv Drug Deliv Rev,1997,28(1):5-24.
[14]Mendonça G,Mendonça DB,Aragäo FJ,et al.Advancing dental implant surface technology——From micron-to nanotopography[J]Biomaterials,2008,29(28):3822-3835.
[15]曹灿,赵领洲,宋艳艳,等.载钴纳米管种植体涂层的制备及毒性研究[J].实用口腔医学杂志,2015,31(2):175-179.
[16]Puckett SD,Lee PP,Ciombor DM,et al.Nanotextured titanium surfaces for enhancing skin growth on transcutaneous osseointegrated devices[J].Acta Biomater,2010,6(6):2352-2362.
[17]Farrell BJ,Prilutsky BI,Ritter JM,et al.Effects of pore size,implantation time,and nano-surface properties on rat skin ingrowth into percutaneous porous titanium implants[J].JBiomed Mater Res A,2014,102(5):1305-1315.
[18]Lindsay D,von Holy A.Bacterial biofilms within the clinical setting:What healthcare professionals should know[J].JHosp Infect,2006,64(4):313-325.
[19]Høiby N,Bjarnsholt T,Givskov M,et al.Antibiotic resistance of bacterial biofilms[J].Int J Antimicrob Agents,2010,35(4):322-332.
[20]Mostafa NE,Shaghayegh V,Matthew N,et al.Structure of the antimicrobial peptide HHC-36 and its interaction with model cell membranes[J].Biophys J,2012,102(3):397a-398a.
[21]Brogden KA.Antimicrobial peptides:Pore formers ormetabolic inhibitors in bacteria?[J].Nat Rev Microbiol,2005,3(3):238-250.
[22]Ma M,Kazemzadeh-NarbatM,HuiY,etal.Local delivery of antimicrobial peptides using self-organized TiO2nanotube arrays for peri-implant infections[J].JBiomed Mater Res A,2012,100(2):278-285.
[23]Hancock RE,Patrzykat A.Clinical development of cationic antimicrobial peptides:From natural to novel antibiotics[J].Curr Drug Targets Infect Disord,2002,2(1):79-83.
