甲砜霉素在大菱鲆体内的代谢及消除规律
2018-04-12吴少坤林茂李忠琴黄利强李江森
吴少坤,林茂,*,李忠琴,黄利强,李江森
(1. 集美大学水产学院; 2. 厦门市渔用药物工程技术研究中心,福建 厦门 361021)
甲砜霉素(thiamphenicol,TAP) 又名硫霉素、甲砜氯霉素,与氟苯尼考、氯霉素均属于酰胺醇类药物,其结构和氯霉素相似,氯霉素分子中的对硝基以甲磺酰基取代即为甲砜霉素。甲砜霉素为广谱抗菌药,抗菌谱和抗菌作用与氯霉素接近,但其毒性低[1];口服给药后吸收快,体内分布广泛,可用于肠道感染,也可用于全身性的细菌性疾病[2-3]。在氯霉素被世界各国禁止用于食用动物后,甲砜霉素与氟苯尼考分别作为氯霉素的替代药物应用于水产动物的疾病防治[4],中国农业部1435号公告发布的第一批《兽药试行标准转正标准目录》中就列有水产用的甲砜霉素制剂——甲砜霉素粉[5]。
大菱鲆(Scophthalmusmaximus)俗称多宝鱼,是一种低温、底层肉食性鱼类,隶属于硬骨鱼纲(Osteichthyes)、鲽形目(Pleuronectiformes)、鲆科(Bothidae)、菱鲆属(Scophthalmus)[6]。1992年,大菱鲆由中国水产科学研究院黄海水产研究所雷霁霖院士从英国引进,经过二十多年的推广,大菱鲆已成为中国重要的海水经济养殖鱼类[7]。大菱鲆在养殖过程中,常见的细菌性疾病的病原菌主要有弧菌(Vibriospp.)、链球菌(Streptococcusspp.)、嗜水气单胞菌(Aeromonashydrophila)、沿海屈挠杆菌(Flexibactermaritimus)和液化沙雷氏菌(Serratialiquefaciens)等[8],使用药物进行防治是最直接、最常规、最有效的手段。但是药物的过度使用,也导致一些问题的出现。2006年,上海、广州、香港等多个城市的食品药品监督部门对市场销售的大菱鲆进行抽样检查,检测出药物残留超标和使用违禁药物现象。一时之间多宝鱼在消费者眼中成为“毒鱼”,沦为 “致癌”水产品。“多宝鱼事件”是水产养殖业的一次危机,促使监管部门进一步加大了对违禁药物的监测和执法力度。随着民众对食品质量需求的提升,水产养殖的药物使用将更加严格,这就要求在渔药残留检测技术和药动学理论方面开展更加深入的研究。
目前,国内外对甲砜霉素在畜禽动物体内的药代动力学多有研究[9-14],在水产动物体内的药代动力学也有些报道,研究对象主要集中于鲫(Carassiusauratus)[1,4,15]、鲤(Cyprinuscarpio)[1,4,15-16]、凡纳滨对虾(Litopenaeusvannamei)[17]、红笛鲷(Lutjanussanguineus)[18]、眼斑拟石首鱼(Sciaenopsocellatus)[19]等,但尚未见甲砜霉素在大菱鲆体内代谢规律的研究报道。本研究采用混饲口灌给药方式,研究甲砜霉素在大菱鲆体内的药代动力学特征和残留消除规律,并提出给药方案和休药期建议,以便为实际生产中的安全使用提供科学的理论依据。
1 材料与方法
1.1 主要试剂
本实验所需试剂主要包括甲砜霉素标准品(99.7%,中国兽医药品检查所);甲砜霉素原料药(99.0%,潍坊三江医药化工有限公司)、甲醇(色谱纯,TEDIA公司)、乙酸乙酯(西陇化工股份公司);正己烷(西陇化工股份公司);氨水(国药集团化学试剂有限公司)。
1.2 实验动物
实验前大菱鲆暂养在200 L养殖缸中,每缸10~15尾,使用循环水养殖系统,水温19 ℃,盐度17.8。期间大菱鲆抽样检测体内无甲砜霉素残留,暂养7 d后开始实验,平均体重为(451.5±67.8)g。
1.3 给药及样品采集
代谢动力学研究组采用30 mg/kg的常规治疗剂量以导管单次混饲口灌给药,在给药后0.25、0.50、1、2、3、4、6、9、12、24、36和48 h,分别采集大菱鲆的血液、肝脏、肾脏和肌肉等组织样品。残留消除研究组则采用60 mg/kg的高剂量[20-25],采样时间点为给药后的1、3、5、8、10、13、15和30 d。每个时间点取5条鱼作为重复,未口灌处理的大菱鲆各组织样品为空白对照组。
血液的采集是用2 mL注射器进行尾部抽血,并置于5 mL 离心管中,注射器和离心管使用前用0.1 %肝素钠润洗风干。血液以1 480 g离心10 min,取上清液,同其他组织样品置于-80 ℃保存。
1.4 样品处理
组织(肌肉、肝脏、肾脏)和血浆自然解冻后,组织剪碎并用研磨仪匀浆。肌肉、肝脏、肾脏各取1 g,血浆取1 mL,样品分别放入10 mL离心管中。加入3 mL碱化乙酸乙酯(乙酸乙酯∶氨水=97∶3,V/V),漩涡振荡5 min后,以9 300 g离心5 min,取其上清液于广口瓶中。重复上述提取步骤2次,合并上清夜。将广口瓶置于50 ℃水浴锅中,在通风柜中进行风干。样品抽干后加入2 mL流动相溶液,放入摇床振荡至完全溶解。加入2 mL正己烷,振荡5 min。所有溶液移至10 mL离心管中,以9 300 g离心5 min,移取1 mL下层溶液于15 mL离心管中,用流动相稀释10倍后以0.22 μm微孔滤膜过滤,存于进样瓶中待测。
1.5 检测方法
TAP含量的检测使用液相色谱串联质谱仪Agilent 1260-6420。色谱条件:色谱柱Agilent ZORBAX C18(2.1mm×50 mm,1.8 μm);柱温30 ℃;流动相为甲醇∶水(80∶20,V/V);流速0.40 mL/min;进样量10 μL。质谱条件:喷雾离子源(ESI);负离子扫描;多级反应监测(MRM);毛细管电压 -3 500 V;定性离子对(m/z)353.9/290和353.9/184.7,定量离子对(m/z)353.9/184.7;采集时间200 ms;碰撞解离电压130 V;碰撞能量8 V/20 V。
1.6 标准曲线和检测限
用1.4节方法前处理的空白样品将TAP 标准品配制成1、10、25、50和100 ng/mL的样品标准溶液,进行色谱检测。以TAP浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线,计算回归方程和相关系数。检测中对于含量超过100 ng/mL的样品以流动相进行相应的稀释,使终浓度在标准曲线范围内。
1.7 回收率和精密度
将空白对照大菱鲆的血浆、肝脏、肾脏和肌肉样品进行组织匀浆后,分别加入TAP标准液,制成不同质量浓度梯度样品,混匀静置,使药物充分渗入组织中,最终含量为50、10和1 ng/mL。按照1.4节进行样品前处理。于一日和一周内分别对各个浓度样品重复测定3次,并计算回收率和日内、日间精密度[26]。
1.8 数据处理
代谢动力学的药时数据使用DAS 3.0软件进行分析。残留消除的药时数据用WT1.4软件来计算休药期,计算涉及到的甲砜霉素最高残留限量值(MRL,50 μg/kg)依据中国农业部发布的235号公告[27]。
2 结果与分析
2.1 色谱质谱特征
在优化的检测条件下,血浆样品中TAP保留时间约为0.39 min,色谱峰的峰形尖锐,且有良好的分离效果(图1)。以m/z353.9作为母离子,选取碎片丰度最强的m/z184.7和290.0作为TAP的监测离子,以3倍信噪比(S/N)计,甲砜霉素的最低检测限为0.001 mg/L。
2.2 分析方法验证
绘制血浆、肝脏、肾脏和肌肉中的TAP标准曲线,经计算各批样品对应的标准曲线方程的相关系数(R2)均大于0.998。添加TAP的加标空白样,经检测,平均回收率为(93.1±5.6)%(表1)。方法日内变异系数为(2.4±0.6)%,日间变异系数为(4.7±1.1)%。

图1 甲砜霉素(50 ng·mL-1)的MRM色谱图1:母离子m/z 353.9;2:子离子m/z 290.0;3:子离子m/z 184.7。Fig.1 MRM chromatograms of TAP(50 ng·mL-1)1:parent ion m/z 353.9;2:daughter ion m/z 290.0;3:daughter ion m/z 184.7.

表1 样品加标回收率Tab.1 Recoveries of standard addition n=5
2.3 甲砜霉素在大菱鲆血浆中的药动学特征
甲砜霉素以30 mg/kg的剂量对大菱鲆给药后的时间-浓度曲线(图2)显示,在0~9 h内,甲砜霉素在血浆中的浓度逐渐升高,在9 h时达到峰浓度(Cmax)21.968 μg/mL。之后迅速消除,在24 h时血浆中甲砜霉素残留为1.563 μg/mL,在48 h时为1.087 μg/mL。药时数据以非房室模型进行分析,获得的药动学参数(表2)显示药时曲线下面积(AUC0-∞)为319.754 mg/(L·h),表观分布容积(Vz/F)为6.206 L/kg,平均滞留时间[MRT(0-∞)]和消除半衰期(T1/2z)分别为33.984 h和45.841 h。

图2 单次口灌甲砜霉素后大菱鲆血浆中的药时曲线(n=5)Fig.2 Mass concentration-time curve of TAP in the plasma of Scophthalmus maximus after single oral administration(n=5)

表2 甲砜霉素在大菱鲆血浆、肌肉、肝脏和肾脏中的非房室药动学参数Tab.2 Non-compartmental pharmacokinetic parameters of TAP in plasma,muscle,liver and kidney of Scophthalmus maximus
注:AUC表示曲线下面积;MRT表示平均驻留时间;(0—t)表示在 0—48 h时间内;(0—∞)表示在 0—∞时间内;T1/2表示消除半衰期,下标“z”表示统计矩原理计算;Vz/F表示表观分布容积;CL/F表示清除率;Tmax表示达峰时间;Cmax表示达峰浓度。
2.4 甲砜霉素在大菱鲆中组织的代谢特征
甲砜霉素在大菱鲆的肌肉、肝脏和肾脏组织中的药时曲线(图3)显示,甲砜霉素在这3种组织中广泛分布,达峰浓度(Cmax)分别至22.346、27.128和47.718 μg/g。除了肝脏中达峰时间较快(4 h),在肌肉和肾脏组织中均在9 h时达峰。在3种组织中的非房室药动学参数(表2)显示,甲砜霉素在肾脏中的达峰浓度(Cmax=47.718 μg/g)和药时曲线下面积[AUC(0-∞)=517.768 mg/(L·h)]最大,表明肾脏对甲砜霉素的吸收能力最高;在肝脏中的平均滞留时间[MRT(0—∞)= 36.565 h]最长,结合消除半衰期(T1/2z=42.370 h),说明给药后48 h内甲砜霉素在肝脏中的消除较慢。

图3 单次口灌甲砜霉素后大菱鲆肌肉(A)、肝脏(B)和肾脏(C)中的药时曲线(n=5)Fig.3 Time-concent curve of TAP in muscle(A), liver(B) and kidney(C) of Scophthalmus maximus after single oral dose(n=5)
2.5 甲砜霉素的残留消除与休药期
甲砜霉素采用60 mg/kg的剂量口灌给药大菱鲆,第1天血浆、肌肉、肝脏和肾脏中的药物含量分别为2.776 μg/mL、3.480 μg/g、11.891 μg/g和13.531 μg/g,并分别在给药后第5、10、10和13天时降至MRL(0.05 μg/g)之下,此时含量分别是0.017 μg/mL、0.022 μg/g、0.029 μg/g和0.016 μg/g。甲砜霉素在大菱鲆血浆、肌肉、肝脏和肾脏中的残留消除药时数据,用WT软件的回归法计算(图4),所得的理论休药期(WDT)分别为8.90、10.64、18.19 和23.95 d,说明甲砜霉素在大菱鲆肾脏中的残留期较长。
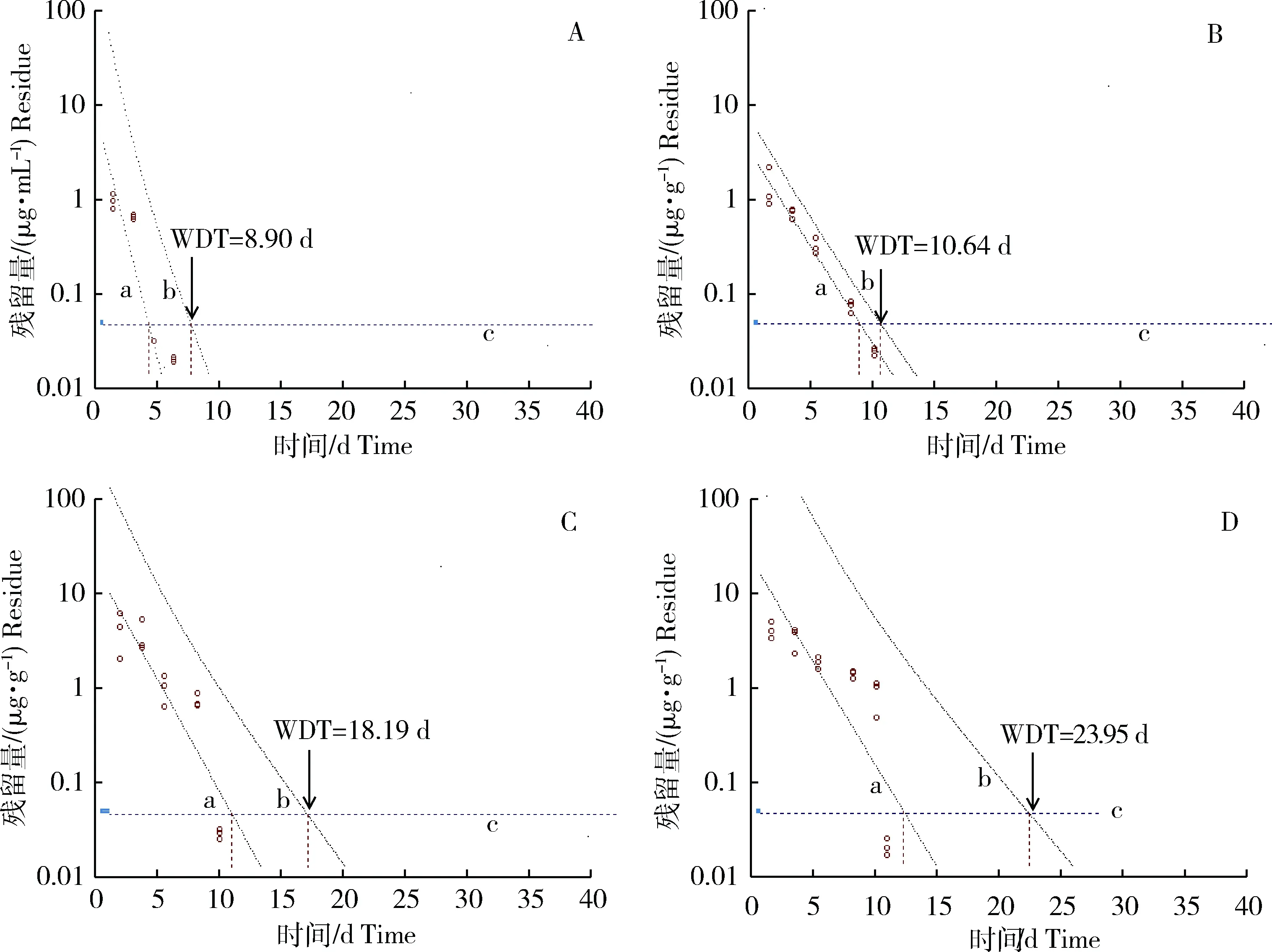
图4 甲砜霉素在大菱鲆各组织中的理论休药期(n=3)A:血浆;B:肌肉;C:肝脏;D:肾脏。a:拟合回归线;b:95%置信区间的上限;c:最高残留限量(MRL,0.05 μg·g-1)。Fig.4 The withdrawal time in theory calculated for TAP in different tissues of Scophthalmus maximus(n=3)A:Plasma;B:Muscle;C: Liver;D: Kidney.a :Linear regression line; b :Tolerance limit with 95% confidence;c :Maximum residual limit(MRL,0.05 μg·g-1).
3 讨论
3.1 甲砜霉素在大菱鲆体内的药动学特征
药代动力学参数Tmax越大,通常表明吸收速率越慢;Cmax越大,则表明吸收程度越高。本实验研究结果表明,甲砜毒素在肾脏中的达峰浓度和药时曲线下面积值最大,分别为47.718 μg/g和517.768 mg/(L·h);在血浆中的表观分布容积最大,为6.206 L/kg;在肾脏中的清除率最低,为0.058 L/(h·kg);在肝脏中的平均驻留时间最长,为36.565 h;在肝脏中的达峰时间较快(4 h),在血浆、肌肉、肾脏中的达峰时间为9 h;在血浆中的消除半衰期时间最长,为45.841 h。与已报道的甲砜霉素药动学研究相比(表3),在相同给药剂量(30 mg/kg)时,甲砜霉素在大菱鲆中的吸收速率远低于鲫、松浦镜鲤、家兔和鸡,但吸收程度较好。
半衰期(T1/2)反映药物在动物机体中的消除速率,甲砜霉素在鲫、松浦镜鲤、凡纳滨对虾、红笛鲷等动物体内的T1/2分别为16.71、77.29、10.66和50.09 h,而本实验中大菱鲆的T1/2为45.841 h,表明了甲砜霉素在大菱鲆体内的消除较为缓慢,维持有效浓度时间较长(表3)。

表3 口灌给药方式下甲砜霉素在不同动物血浆中的药动学参数Tab.3 Pharmacokinetic parameters of TAP in the plasma of different animals following oral administration
注:—表示未提供。
3.2 给药方案和休药期建议
抗菌药物能否在体内维持一定时间的治疗往往取决于达峰浓度/最小抑菌浓度(Cmax/ MIC)能否达到10[28]。甲砜霉素对鳖、鱼类和贝类中常见病原菌的MIC多报道为0.39~1.6 μg/mL[29-31],在本次研究中甲砜霉素在大菱鲆血浆中的Cmax为21.968 μg/mL,通过计算Cmax/ MIC的值在13.7~56.3之间,说明了以30 mg/kg的剂量对于常见的病原菌是有效的。本次研究中甲砜霉素在大菱鲆体内的消除较为缓慢,消除半衰期T1/2z(45.841 h)大于24 h,而在24 h时血浆中甲砜霉素含量仅为1.563 μg/mL,结合半衰期及血药浓度,建议投喂方案为30 mg/kg的剂量,一日一次。
药物残留消除规律的研究对于水产动物食品安全具有重要的理论价值。本研究在19 ℃水温下,采用高剂量(60 mg/kg)单次口灌的给药方式,采集了30 d内甲砜霉素在大菱鲆各组织中的残留数据,结合甲砜霉素的最高残留限量(50 μg/kg)[27]计算理论休药期,如果只考虑把肌肉作为主要食用部分,建议休药期为11 d;如果考虑所有组织,则以消除最慢的肾脏代谢数据为参照,建议休药期为24 d。
4 结论
甲砜霉素以30 mg/kg的剂量单次混饲口灌后,在大菱鮃体内的药动学参数显示,达峰浓度(Cmax)和达峰时间(Tmax)分别为21.968 μg/mL和9 h,平均滞留时间MRT(0—∞)和消除半衰期(T1/2z)分别为33.984 h和45.841 h。参考现有甲砜霉素的药效学数据,在大菱鲆常见细菌病的治疗中,甲砜霉素建议的给药方案为:30 mg/kg,混饲给药,一日一次。
考虑多次给药的药物累积作用,甲砜霉素以60 mg/kg的高剂量单次混饲口灌后计算理论休药期。结果显示,甲砜霉素在大菱鲆血浆、肌肉、肝脏、肾脏中的理论休药期分别为8.90、10.64、18.19、23.95 d。因此,建议甲砜霉素用药后的理论休药期应在24 d以上。
参考文献:
[1]杨洪波,王荻,卢彤岩. 甲砜霉素在鲫体内的药物代谢动力学研究[J]. 淡水渔业, 2013, 43(3):72-76.
[2]韩飞,张曼,张周,等. 甲砜霉素临床应用及残留检测的研究进展[J]. 陕西农业科学, 2014, 60(7):55-58.
[3]陈杖榴.兽药药理学[M].第三版.北京:中国农业出版社, 2009: 252-253.
[4]王荻,杨洪波,卢彤岩. 甲砜霉素在鲤鲫鱼体内组织蓄积规律的研究[J]. 江西农业大学学报, 2013, 35(5):1030-1035.
[5]中华人民共和国农业部.农业部第1435号公告:兽药试行标准转正标准目录[EB/OL]. (2010-8-23)[2017-7-28].http://www.moa.gov.cn/zwllm/tzgg/gg/201008/t20100823_1622639.htm.
[6]申雪艳,孔杰,宫庆礼,等. 大菱鲆种质资源研究与开发[J]. 海洋水产研究, 2005, 26(6):94-100.
[7]李明春. “毒鱼致癌”,根据何在?——多宝鱼药物残留事件的思考[J]. 海洋世界, 2007, 14(2):14-17.
[8]徐贇霞. 养殖大菱鲆常见疾病概述[J]. 天津水产, 2010, 32(2):5-10.
[9]Al-Nazawi M H. Pharmacokinetics and tolerance of thiamphenicol in camels and sheep [J]. Int J Phamacol,2005,1(1):25-28.
[10]Gamez A,Perez Y,Marti G,et al. Pharmacokinetics of thiamphenicol in veal calves [J]. Brit Vet J,1992,148(6):535-539.
[11]Mestorino N,Landoni M F,Alt M,et al. The pharmacokinetics of thiamphenicol in lactating cows[J]. Vet Res Commun,1993,17(4):295-303.
[12]邢晓玲,王妲妲,袁小秋,等. 甲砜霉素及HP-β-CD甲砜霉素在家兔体内的药代动力学比较研究[J]. 湖南农业科学,2009,32(12):11-14.
[13]郭桂芳,杨大伟,李勇军,等. 甲砜霉素在感染多杀性巴氏杆菌鸡体内的药物动力学[J]. 中国兽医学报, 2010, 30(6):815-817.
[14]Haritova A,Lashev L,Pashov D. Pharmacokinetics of thiamphenicol in pigs[J]. J Vet Phamacol Ther, 2002, 25(6):464-466.
[15]韩冰,杨洪波,王荻,等. 甲砜霉素在鲤鱼及鲫鱼体内的残留研究[J]. 中国农学通报, 2013, 29(26):25-30.
[16]杨洪波,王荻,卢彤岩. 甲砜霉素在松浦镜鲤体内的药物代谢动力学研究[J]. 大连海洋大学学报, 2013, 28(3):298-302.
[17]陈玉露. 甲砜霉素和氟甲砜霉素在凡纳滨对虾体内的药代动力学和对药酶影响的研究[D]. 雅安:四川农业大学, 2009.
[18]秦青英,汤菊芬,黄郁葱,等. 甲砜霉素在红笛鲷体内的组织分布和药代动力学研究[J]. 中国兽药杂志, 2013, 47(11):31-36.
[19]黄郁葱,汤菊芬,秦青英,等. 甲砜霉素在眼斑拟石首鱼体内的药代动力学研究[J]. 广东海洋大学学报, 2017, 37(1):52-57.
[20]黄聚杰,林茂,鄢庆枇,等. 氟苯尼考在花鲈体内的代谢及残留消除规律[J]. 中国渔业质量与标准, 2016, 6(3):6-13.
[21]曲晓荣. 诺氟沙星在大菱鲆体内药代动力学及残留消除规律的研究[D]. 乌鲁木齐:新疆农业大学,2006.
[22]唐锡招. 恩诺沙星在大菱鲆、鲫鱼和鲤鱼体内代谢产物研究[D]. 上海:上海海洋大学,2015.
[23]唐雪莲,王群,李健. 氯霉素在鲈鱼体内的药代动力学及残留的研究[J]. 海洋水产研究,2003,23(2):45-50.
[24]田丽粉. 氟苯尼考在牙鲆体内的药代动力学及残留消除规律研究[D]. 青岛:中国海洋大学,2009.
[25]刘秀红. 氯霉素和诺氟沙星在牙鲆体内的药代动力学及残留消除规律研究[D]. 青岛:中国海洋大学,2003.
[26]林茂,陈政强,纪荣兴,等. 不同温度下氟苯尼考在鳗鲡体内药代动力学的比较[J]. 上海海洋大学学报, 2013, 22(2):225-231.
[27]中华人民共和国农业部. 中华人民共和国农业部第235号公告: 动物性食品中兽药最高残留限量[EB/OL].(2008-3-4)[2017-7-29]. http://www.moa.gov.cn/zwllm/nybz/200803/t20080304_1028649.htm.
[28]湛嘉,李佐卿,康继韬,等. 影响水产动物药代动力学的因素[J]. 中国兽药杂志, 2003, 49(12):38-41.
[29]Walker R D. The use of fluoroquinolones for companion animal antimicrobial therapy[J]. Aust Vet J,2000,78(2):84-90.
[30]Ho S P, Hsu T Y, Chen M H, et al. Antibacterial effect of chloramphenicol, thiamphenicol and florfenicol against aquatic animal bacteria[J]. J Vet Med Sci, 2000, 62(5): 479-485.
[31]杨洪波. 甲砜霉素在鲤体内的代谢规律及毒性研究[D]. 上海:上海海洋大学,2014.
