运输暂养水体中丁香酚残留检测研究进展
2018-04-12王正全崔云云倪玲陈力黄宝勇刘源汪立平赵勇王锡昌谢晶
王正全,崔云云,倪玲,陈力,黄宝勇,刘源,汪立平,赵勇,,王锡昌,,谢晶,
(1.上海海洋大学食品学院,上海201306; 2.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306;3.北京市农业环境监测站,农业部农产品质量安全环境因子风险评估实验室(北京),北京 100029; 4.农业部冷库及制冷设备质量监督检验测试中心(上海),上海 201306)
丁香酚(eugenol,C10H12O2)是从芳香植物的精油中提取得到的,在常温下呈黄色或透明的油状苯丙类化合物。丁香酚具有局部麻醉、防腐、镇痛、抗炎和抗菌的作用,通过作用于生物体弓状核区的敏感神经元,影响其放电作用及相关细胞通路,从而产生局部降温等作用,是清凉油等驱蚊虫药物的有效成分[1]。日本最早发现丁香酚对水产动物具有麻醉作用并应用于景观鱼运输,随后世界各国学者也发现丁香酚独特的麻醉效果,且受试动物能够快速复苏,开发出专用剂型应用于食用水产动物的高密度运输[2-3]。但是,含有丁香酚的运输水长时间浸泡水产动物会导致其在动物体内蓄积并污染环境。有研究显示,因丁香酚的芳香烃结构具有脂溶性特点,使其在水产动物中可以稳定存在96h以上;丁香酚麻醉鱼体20d后仍可被检测,在500℃以上才会明显降解;其前处理提取物有4d的稳定期,可以积蓄在水产动物体内[4-7]。含有丁香酚的废水最终排放入大海后,能严重干扰珊瑚的繁殖,其对海洋环境的危害不可轻视[8]。
目前国际上流行3种丁香酚麻醉剂,即丁香油(cloveoil)、香精油(essentialoil)和AQUI-S®20E(10%丁香酚活性成份复配麻醉剂,仅限美国地区使用),其中后者应用最广泛且相关研究最多[9-15],而国内流行使用的是纯丁香油(医用丁香酚)[16-18]。有学者指出,有效成分为丁香酚的复配制剂AQUI-S®20E一旦使用,必定会检出丁香酚残留,甚至在水产动物表皮也能检测到[11]。更有研究指出,使用AQUI-S®20E麻醉鲈需要50h~7d的时间才可以代谢干净,并且这种麻醉剂的残留会出现累积效应,最终建议捕捞前休药2d且运输结束后再需要暂养休药7d才可食用,这是仅有的关于丁香酚在水产动物麻醉后休药期的研究报道[12]。美国、欧盟等国家和地区还允许使用推荐剂量的鱼安定(甲磺酸三甲酯,MS-222)作为鱼类麻醉剂,该麻醉剂在中国较罕见。
调研发现,丁香酚作为一种渔用麻醉剂已在中国使用多年,特别是在水产动物运输环节常使用丁香酚对密集运输的鱼、虾、蟹类进行麻醉,可以有效减少甚至避免水产动物运输过程中的机体损耗,进而减少鲜活水产品的死亡率,使养殖户和各级经销商获益。丁香酚麻醉水产动物的复苏时间相对较长,价格却比MS-222占优势,欧美等国家和地区多用MS-222,而日本、新西兰、澳大利亚、智利则多用丁香酚,中国的使用情况与亚太地区国家的大趋势一致[16]。丁香酚能有效使罗非鱼出现短暂呼吸停止,减少运输过程的应激反应,减少运输过程中的损失,实际运输中低水温会影响鱼体对麻醉剂的吸收效果,通常采用加大使用剂量(0.15mL/L)维持麻醉效果[17]。媒体曾报道丁香酚麻醉运输活鱼的案例,引起了消费者对食品安全的担忧和恐慌,特别是一线城市的水产动物运输过程长、暂养销售环节到餐桌的过程周期短、从业人员加药随意性大且缺少休药期概念,导致丁香酚残留安全风险陡升。总之,目前丁香酚残留检测监管存在执行难度大、风险排查困难多、标准检测方法尚未建立等问题,因此,迫切需要开发针对水产动物及其运输暂养水体等的快速、简单、准确、稳定、有效、灵敏的检验检测方法[18-26]。文章归纳了近年来国内外针对水体及类似基质中丁香酚的残留检测的方法,以期为中国渔用麻醉剂的监测和监管提供参考。
1 丁香酚作为麻醉剂的应用背景
丁香酚在水产动物高密度养殖时被用作麻醉剂的作用主要是降低新陈代谢和耗氧量,有研究发现养殖密度达到240 g/L时,使用30 mg/L的商用精油AQUI-S®20E(含10%丁香酚有效成分)可有效提升温水鱼(罗非鱼)和冷水鱼(黄鲈)的存活率[9]。 另一研究表明运输水中添加丁香酚精油可以有效降低水产动物血浆中的皮质醇含量,减少血液中Na+、K+、C1-的损失,显著降低运输终了时运输水中的总胺浓度,说明丁香酚可以在运输过程中降低鱼、虾等水产动物的代谢率,提高存活率[9-10]。
本实验室在2013—2016年间不间断地对沪浙闽三地水产动物批发市场的调研和排查中发现,样品从未监测出MS-222,而丁香酚在运输水和暂养水中则均有阳性检出,运输环节人工添加丁香酚行为归纳如图1所示。
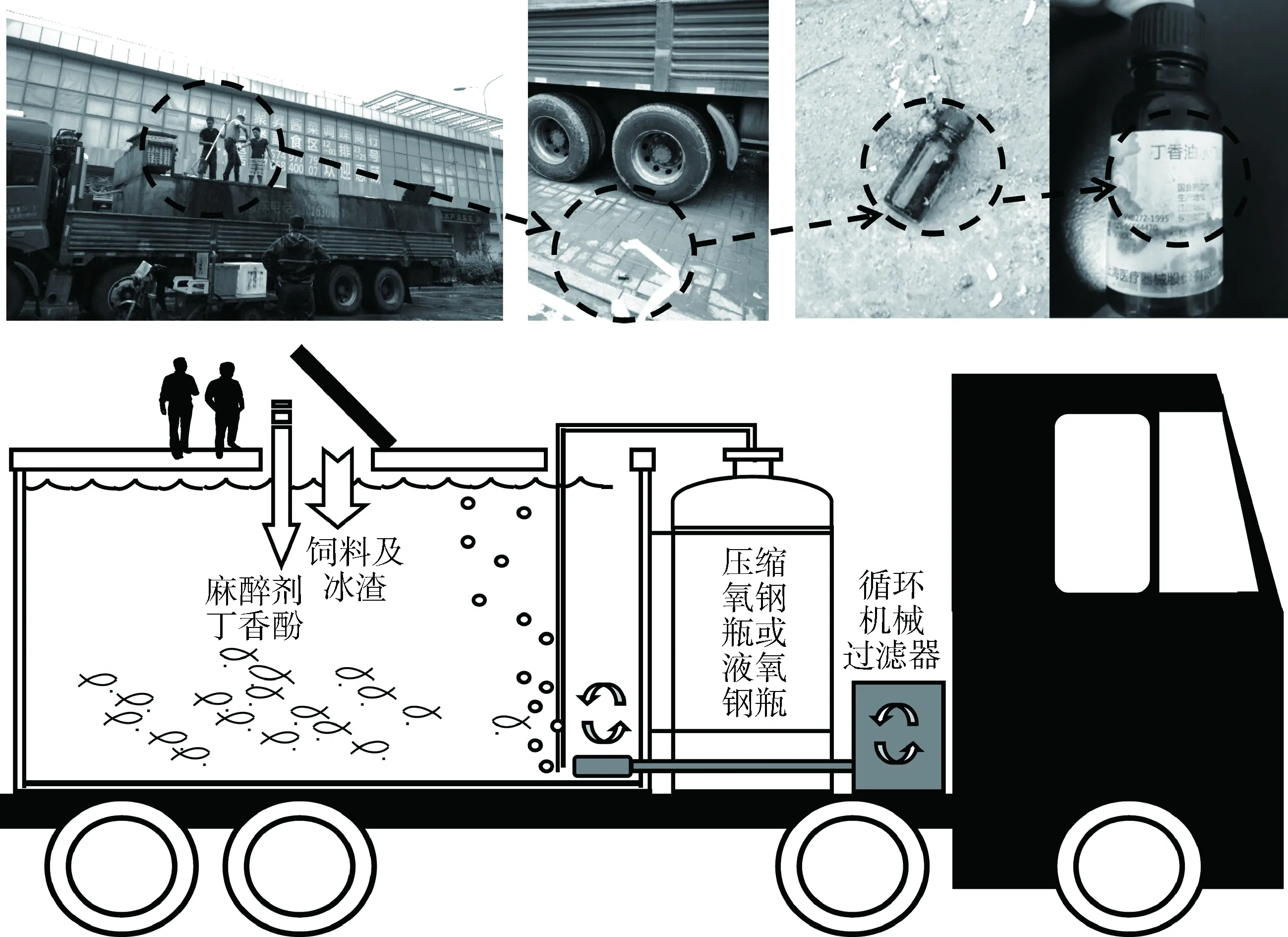
图1 独立的水产动物运输水箱加入丁香酚过程示意图Fig.1 Schematic of the addition of eugenol in a self-contained fish transport box
2 残留检测方法国内外研究进展
2.1 国外研究概况
目前丁香酚的毒性机理和毒害作用尚未形成一致结论,国际上对其应用的普遍性存在争议,研究关注水产动物及其运输和暂养环节的水生动物产品、血清、精油、茶水、豆粉和环境水等基质中的丁香酚含量或残留检测,如表1所示。

表1 外文文献关于丁香酚的残留检测现状Tab.1 Current status of residual analysis of eugenol in foreign literatures
注: LOD(limit of detection)为检测限;LOQ(limit of Quantity)为定量限;HPLC(high-performance liquid chromatography)为高效液相色谱;GC-MS/MS(gas chromatography-triple quadrupole mass spectrometry)为三重四级杆气质色谱仪;UV(ultra violet detectior)为紫外检测器;LSC(liquid scintillation counter)为液体闪烁计数器;SIDA(stable isotope dilution assay)为稳定同位素稀释测定;FID(flame ionization detector)为火焰离子化检测器。—表示文献未记录,下同。
国际上的相关研究多关注以丁香酚为主要功效成分的商业配方或者精油,如AQUI-S®20E、Aqui-S (10%异丁香酚)等的麻醉机理、麻醉效果、残留稳定性、代谢规律和环境影响等方面,研究的样品基质则多针对于水产动物及其相关水样[4, 7-15, 28, 30, 34]。以丁香酚及其同系物纯品为研究对象的文献并不多见,研究关注的样品基质也并不局限于水产动物[6, 27-32]。另外,外文文献中研究的样品基质差异非常大,既有简单的水产动物肌肉组织匀浆样品,又有环境水、茶水等均匀样品,还有复杂的血清、血浆基质,甚至还包括原始精油成分的常量分析,这些方法的检出限、回收率的研究并不很全面,主要是辅助逻辑性推理和原理性推断,检验检测仅为手段而非文献的最终研究目的。
对于水产动物的丁香酚研究,外文文献关注点在于多品种的淡水鱼[7]、高密度养殖的冷水鱼和温水鱼[9, 34]中的丁香酚残留或麻醉机理,也涉及某一种鱼类或其他水产动物模型的可食性带皮肌肉组织[7, 11, 35],针对性较强。Becker等[10]发现丁香酚及由白棘枝提炼的精油同样可以在运输银鲢和克林雷氏鲶的过程中有效地减少紧张素,降低运输过程中氧气的消耗和二氧化碳与总胺的积累程度,可以保障更长的运输时间后银鲢不因总胺含量急速上升而死亡。Kaiser等[14]专门研究了丁香油在长途运输鲜活维多利亚丽池鱼过程中有效减轻鱼类的压力反应的作用,发现丁香油搭配选择性铵离子交换沸石可控制总氨水平降幅达82%,另外关于长距离运输鲜活水产品的研究还可以借鉴参考大鼠血浆、人血清和茶水为基质的研究[29-31]。
2.2 国内研究概况
鉴于丁香酚作为麻醉剂的风险性以及国标和残留限量值的空缺现状(仅有地标DB22/T 1988—2013水产品中丁香酚的测定高效液相色谱法),中国近年也涌现出大量针对水产动物以及运输、暂养水体中丁香酚残留检测的研究。目前常见的检测方法包含有固相萃取-高效液相色谱-荧光法(SPE-HPLC-FLD)、固相萃取-高效液相色谱-质谱法(SPE-HPLC-MS)、基质固相分散萃取-气相色谱法(d-SPE-GC)、液液萃取-高效液相色谱-紫外法(LLE-HPLC-UV)、固相萃取-气相色谱质谱法(SPE-GC/MS)和固相微萃取-气相色谱质谱法(SPME-GC/MS)法等,丁香酚残留检测研究进展如表2所示。国内仪器设备倾向于选用更加优越的三重四级杆串联技术(MS/MS),而国际研究则倾向于选用更加基础的紫外(UV)和单四极杆(MS)检测设备,国内研究明显检测限更低、基质更全面、应用更广泛,残留检测已经处于世界领先水平。

表2 中文文献关于丁香酚的残留检测现状Tab.2 Current status of residual analysis of eugenol in domestic literatures
目前国内关于丁香酚在水体及水产品中残留检测的研究尚处于起步阶段。文献调查显示,常量分析[20, 36]、灵敏度不高的UV检测器[21-23]、过于粗放的前处理方法[26]、稳定性不佳的外标法[23]占国内研究主体。也有一些文献的方法学研究做的比较完善,如针对鱼肉组织和暂养水、环境水的研究比较深入,方法建立的比较完善,可供借鉴[18-19, 24]。
3 前处理技术研究概况
3.1 检测方法的基质
残留检测方法的开发都是基于实际应用中的社会需求所开展的,除药物滥用外,丁香酚主要是供鲜活水产动物的运输使用,所以国内外主要关注的研究基质为水产动物可食性肌肉组织和运输及暂养水体[4, 6-7, 10-15, 17-20, 22-28, 30-31, 35],还有少数研究关注代谢过程中的血液样品的丁香酚残留情况[9, 21, 29-30, 36]。但水样基质的方法开发的较少,仅有部分以血液、茴香茶和环境水样品为基质的方法开发[27, 29-31]。国内针对液体样品基质的方法相对数量多且更加具体,反映出国内强烈的检测需求和更细化的领域关注,如赵东豪等[19]和刘海新等[25]开发的养殖水体中丁香酚残留的HPLC-MS/MS检测法和不确定度分析,柯常亮等[24]使用GC-MS/MS检测纯净水中丁香酚的残留。然而HPLC-MS/MS虽然检测速度快却消耗太多有机试剂,既不经济又不环保,而GC-MS/MS的研究相对简单,可深入优化。
3.2 前处理方法的研究
所有丁香酚残留检测方法在抛去差异化的仪器设备和研究基质的因素外,最大的区别就在于前处理技术。外文文献主要选用LLE、SPE、UE、SPME、HS及几种方法的串联技术做丁香酚的残留检测前处理手段,使用的辅助吸附剂涵盖丹磺酰氯、过滤棉和氯化钾等,萃取溶剂则多使用甲醇、乙腈、正己烷、氢氧化钠、丙酮和乙醇等[6-7, 27-28, 30-32, 35, 37-38]。国内文献则主要选用SPE、d-SPE、SPME和LLE方法,较少使用串联的方法,辅助吸附剂多选择PSA、C18、石墨化碳黑(GCB)、中性氧化铝和硅胶等,萃取溶剂则多使用甲醇、乙腈、乙酸乙酯、正己烷等[18-26, 36],国内研究比国外研究在残留检测设备仪器和新型萃取技术方面有优势,但在传统的前处理技术的串联和方法细化方面还有一些差距。
目前,丁香酚的残留检测最常用的净化方法如表3所示,可知SPE和液液萃取(liquid-liquid extraction, LLE)是研究中最常使用的前处理方式也是最稳定方法,超声萃取作为一种基本的前处理操作也可以用于丁香酚的残留分析。

表3 丁香酚净化方法评价Tab.3 The purification method reference table of eugenol and evaluation
注: LLE(liquid to liquid extraction)为液液萃取;UE(ultrasonic extraction)为超声萃取;HS(headspace)为微波辅助萃取;SPE(solid-phase extraction)为固相萃取;SPME(solid-phase microextraction)为固相微萃取;d-SPE(dispersive solid phaseextraction)为基质分散固相萃取。
关于3种常见的水产动物前处理方法的流程图如图2所示。LLE是最经典的萃取方法,但是因为消耗有机溶剂量大且萃取效率较低,被SPE法逐步取代。目前最经典的从肌肉组织和水体中萃取有机物的前处理方式就是SPE,但SPE小柱作为实验耗材比较昂贵。近年来国际流行的趋势着眼于开发简单、快速、有效、经济、节省的前处理技术,基质分散固相萃取(dispersive solid phaseextraction, d-SPE)方法因此诞生,该方法的优点是需要的样品量较少,可以有效萃取浓缩净化复杂基质中的目标物,缺点是方法稳定性有限,更适合于做科学研究,而针对大批量的样品检测,还应选择经典的SPE方法提高准确率和效率。
3.3 检测设备仪器
丁香酚的残留检测方法按照检测设备划分可分为3大类:第一类是气相色谱类,使用的设备涵盖GC-MS、GC-FID、GC-MS/MS、HS-GC/MS等,后两者较为先进和精准;第二类是液相色谱类,使用的设备主要有HPLC-UV、HPLC-MS、HPLC-MS/MS这三种,后者最为精准和先进;第三类是非常规设备类,包含有流通液体闪烁计(LSC)和同位素稀释测定仪(SIDA)等稀有设备[11, 27],条件较为苛刻,且大多数检测机构不具备条件,参考价值低,如表1和表2所示。但是在检测水产动物中14C标记的丁香酚的暴露水平和代谢途径方面,非常规设备可以发挥出其无可替代的作用[35]。
3.4 气相色谱内标法的内标物选择及其质谱参数
质谱检测已经成为主流的残留检测的手段,国内研究机构多使用MS/MS技术提高检测方法灵敏度和定性定量检测准确度,该技术可有效排除丁香酚残留检测过程中的基质干扰[39],在气相和液相色谱法检测丁香酚的残留时都可以选用内标法以避免引入系统误差,而对于可精准定量的液相色谱法则可选用外标法来降低选择合适内标物的难度,对于常量分析或成分分析则可使用更简单的归一化法[11-12, 19-25, 27-31, 35-36]。由于气相色谱法具有最经济、环保、定性定量准确、易操作等优点,最适合丁香酚的残留检测,相关文献研究数目也最多,应用最为广泛,其中常用内标物质的结构式和质谱参数总结如图3和表4所示。
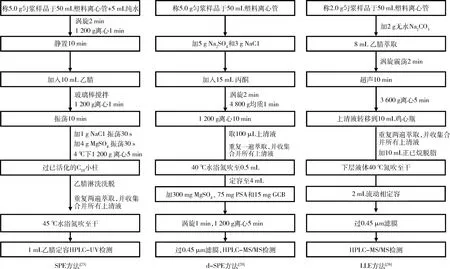
图2 三个典型水产动物基质中丁香酚前处理方法对比Fig.2 Comparison of 3 pretreatment methods of eugenol residues in aquatic animals
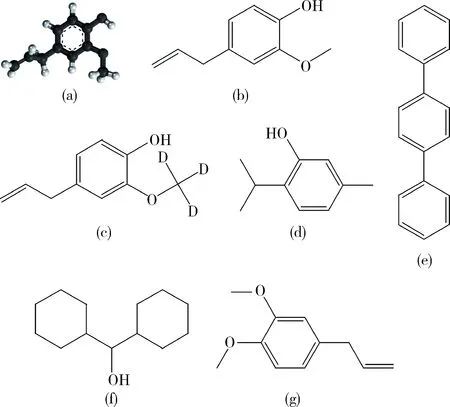
图3 丁香酚三维结构图以及丁香酚残留检测常用内标物质的化学结构图(a)丁香酚3D;(b)丁香酚;(c)d3-丁香酚;(d)百里香酚;(e)对二苯基苯;(f)二环己基甲醇;(g)甲基丁香酚。Fig.3 Chemical structures of eugenol and internal standards(a) eugenol 3D; (b) eugenol; (c) d3-eugenol;(d) thymol; (e) p-diphenylbenzene; (f) dicyclohexyl methanol;(g) methyl eugenol.
异丁香酚作为内标物时会发生随储存时间延长而转化为丁香酚的情况,甲基丁香酚在特定条件下也可以转化为丁香酚,这两种内标物质在选用时需要每次实验重新配置母液。对二苯基苯、百里香酚和二环己基甲醇与丁香酚结构差异大,虽然也可以精准定量,但存在基质不同时响应与丁香酚不同步的可能性。d3-丁香酚和14C-丁香酚是丁香酚的氘代内标,是最好的内标物质候选项,但也存在着价格昂贵等缺点,具体操作可根据需求选用合适的内标物质。
4 结语
丁香酚麻醉剂因具有毒性低、效率高、成本低等特点被应用于水产动物运输环节,但是丁香酚残留对水产品质量和人体健康可能存在潜在危害。由于丁香酚残留的毒性没有持久性环境污染物和农药残留危害大,相关的方法学研究还不够丰富。建议进一步加强针对水产动物的运输和暂养水体检验检测方法的开发、实际样品的检测、麻醉机理的研究等。该研究为运输环节的丁香酚合理使用提供了参考,对不同基质样品的检验检测提供了借鉴方法,对检测设备应用和参数设置情况提供了理论支撑。通过有效利用串联四级杆技术配合内标法与合适的前处理技术检测水体基质中丁香酚残留,提高水产动物存活率、提升水产品的质量、增加经济效益[40-42]。

表4 丁香酚残留检测常用内标物质及其质谱参数Tab.4 Mass spectrometric acquisition parameters of the internal standard for measuring eugenol byGC/HPLC-MS/MS in SRM mode
注:*为定量离子。
参考文献:
[1]杨亚军, 刘希望, 赵晓乐, 等. 丁香酚解热作用机理研究进展[J]. 中兽医医药杂志, 2016(5) : 24-27.
[2]Endo T, Ogishima K, Tanaka H, et al. Studies on the anesthetic effect of eugenol in some fresh water fishes[J]. Nihon-suisan-gakkai-shi, 1972, 38(7) : 761-767.
[3]李晋成, 刘欢, 王群, 等. 水产品中丁香酚的残留风险评估研究进展[J]. 食品安全质量检测学报, 2014,5(11) : 3598-3602.
[4]Liaw S S, Perez V H, Zhou S, et al. Py-GC/MS studies and principal component analysis to evaluate the impact of feedstock and temperature on the distribution of products during fast pyrolysis[J]. J Analy Appl Pyrol, 2014, 109: 140 - 151.
[5]Saran S, Menon S, Shailajan S, et al. Validated RP-HPLC method to estimate eugenol from commercial formulations likeCaturjataChurna,LavangadiVati,JatiphaladiChurna,SitopaladiChurna, and clove oil[J]. J Pharm Res, 2013, 6(1): 53 - 60.
[6]Li J, Zhang J, Liu Y. Optimization of solid-phase-extraction cleanup and validation of quantitative determination of eugenol in fish samples by gas chromatography-tandem mass spectrometry[J]. Anal Bioanal Chem, 2015, 407(21): 6563 - 6568.
[7]Meinertz J R, Schreier T M, Porcher S T, et al. Evaluation of a method for quantifying eugenol concentrations in the fillet tissue from freshwater fish species[J]. J Aoac Int, 2016, 99(2): 558 - 564.
[8]Boyer S E, White J S, Stier A C, et al. Effects of the fish anesthetic, clove oil (eugenol), on coral health and growth[J]. Exp Mar Biol Ecol, 2009, 369(1): 53 - 57.
[9]Cupp A R, Hartleb C F, Fredricks K T, et al. Effectiveness of eugenol sedation to reduce the metabolic rates of cool and warm water fish at high loading densities[J]. Aquac Res, 2016, 47(1): 234 - 242.
[10]Becker A G, Parodi T V, Heldwein C G, et al. Transportation of silver catfish,Rhamdiaquelen, in water with eugenol and the essential oil ofLippiaalba[J]. Fish Physiol Biochem, 2012, 38(3): 789 - 796.
[11]Meinertz J R, Porcher S T, Smerud J R, et al. Determination of the exposure parameters that maximise the concentrations of the anaesthetic/sedative eugenol in rainbow trout (Oncorhynchusmykiss) skin-on fillet tissue[J]. Food Addit Contam A, 2014, 31(9): 1522 - 1528.
[12]Kildea M A, Allan G L, Kearney R E. Accumulation and clearance of the anaesthetics clove oil and AQUI-S from the edible tissue of silver perch (Bidyanusbidyanus)[J]. Aquaculture, 2004, 232(1): 265 - 277.
[13]Juell R A. The physiological stress response of bighead carpHypophthalmichthysnobilis, and the efficacy of three chemical anaesthetics in bighead carp fingerlings[D]. Trondleim:Norwegian University of Science and Techology,2013.
[14]Kaiser H, Brill G, Cahill J, et al. Testing clove oil as an anaesthetic for long-distance transport of live fish: the case of the Lake Victoria cichlidHaplochromisobliquidens[J]. J Appl Ichthyol, 2010, 22(6): 510 - 514.
[15]Zeppenfeld C C, Toni C, Becker A G, et al. Physiological and biochemical responses of silver catfish,Rhamdiaquelen, after transport in water with essential oil ofAloysiatriphylla(L′Herit) Britton[J]. Aquaculture, 2014, 418/419: 101-107.
[16]吕书为, 雷红涛, 孙远明. 鱼用麻醉剂安全性研究进展[J]. 食品科学, 2012, 33(1): 267 - 270.
[17]梁政远, 安丽娜, 董在杰, 等. 丁香油对罗非鱼的麻醉作用及其对血液指标和激素水平的影响[J]. 上海海洋大学学报, 2009, 18(5): 629 - 635.
[18]付晓苹, 彭婕, 李晋成, 等. 流通环节水产品及暂养水中孔雀石绿和麻醉剂风险监测[J]. 食品安全质量检测学报, 2016, 7(12): 5040 - 5045.
[19]赵东豪, 王强, 王旭峰, 等. 超高效液相色谱-串联质谱法检测鱼肉和暂养水中丁香酚残留量[J]. 食品科学, 2016, 37(24): 252 - 256.
[20]陈焕, 黄和, 高平, 等. 分散固相萃取-气相色谱法同时测定水产品中六种丁香酚类麻醉剂的残留量[J]. 食品工业科技, 2015, 36(8): 88 - 92.
[21]焦亚琴, 吕世明, 谭艾娟, 等. 高效液相色谱法测定鲤鱼血浆中丁香酚含量[J]. 基因组学与应用生物学, 2016, 35(8): 2022 - 2026.
[22]陈焕, 黄和, 高平, 等. 高效液相色谱法测定水产品中丁香酚类麻醉剂的残留量[J]. 食品与发酵工业, 2014, 40(12): 156 - 160.
[23]高平, 黄和, 刘文侠,等. 固相萃取-高效液相色谱-荧光检测法测定水产品中4种丁香酚类化合物[J]. 中国食品卫生杂志, 2016, 28(1): 56 - 61.
[24]柯常亮, 刘奇, 陈洁文, 等. 气相色谱-串联质谱联用法测定水中丁香酚残留[J]. 中国渔业质量与标准, 2014, 4(4): 49 - 55.
[25]刘海新, 余颖, 汤水粉, 等. 气相色谱质谱法测定养殖水体中丁香酚含量不确定度评定[J]. 渔业研究, 2016, 38(4): 310 - 317.
[26]芦智远, 刘辰乾, 冯歆轶, 等. 超高效液相色谱-串联质谱法鱼肉丁香酚的残留量测定[J]. 科学养鱼, 2016(7): 76 - 77.
[27]Li J, Liu H, Wang C, et al. Determination of eugenol in fish and shrimp muscle tissue by stable isotope dilution assay and solid-phase extraction coupled gas chromatography-triple quadrupole mass spectrometry[J]. Anal Bioanaly Chem, 2016, 408(24): 6537 - 6544.
[28]Ye L. Development and validation of a LC-MS/MS method for the determination of isoeugenol in finfish[J]. Food Chem, 2017, 228:70 - 76.
[29]Beaudry F, Guénette S A, Vachon P. Determination of eugenol in rat plasma by liquid chromatography-quadrupole ion trap mass spectrometry using a simple off-line dansyl chloride derivatization reaction to enhance signal intensity[J]. Biome Chromatogr BMC, 2006, 20(11): 1216 - 1222.
[30]Schulz K, Schlenz K, Malt S, et al. Headspace solid-phase microextraction-gas chromatography-mass spectrometry for the quantitative determination of the characteristic flavouring agent eugenol in serum samples after enzymatic cleavage to validate post-offence alcohol drinking claims[J]. J Chromatogr A, 2008, 1211(1): 113 - 119.
[31]Bilia A R, Flamini G, Taglioli V, et al. GC-MS analysis of essential oil of some commercial Fennel teas[J]. Food Chem, 2002, 76(3): 307 - 310.
[32]Li Y H, Sun Z H, Zheng P. Determination of vanillin, eugenol and isoeugenol by RP-HPLC[J]. Chromatographia, 2004, 60(11/12): 709 - 713.
[33]Meinertz J R, Hess K R. Evaluation of analytical techniques to determine AQUI-S®20E (eugenol) concentrations in water[J]. Aquaculture, 2014, 418/419:62- 66.
[34]Cupp A R, Fredricks K T, Porcher S T, et al. Survival and behavioural responses of cool and warm water fish sedated with AQUI-S®20E (10% eugenol) at high loading densities[J]. Aquacul Res, 2016: 1 - 14.
[35]Meinertz J R, Schreier T M, Porcher S T, et al. Depletion of eugenol residues from the skin-on fillet tissue of rainbow trout exposed to14C-labeled eugenol[J]. Aquaculture, 2014, 430: 74 - 78.
[36]张子为, 刘广学, 谢德媚, 等. 顶空-固相微萃取-气相色谱-质谱联用技术对灌胃细辛后小鼠脑、肝和血液中7个挥发性主要成分的定量分析研究[J]. 中国中药杂志, 2016, 41(2): 285 - 293.
[37]Meinertz J R, Greseth S L, Schreier T M, et al. Isoeugenol concentrations in rainbow trout (Oncorhynchusmykiss)skin-on fillet tissue after exposure to AQUI-STMat different temperatures, durations, and concentrations[J]. Aquaculture, 2006, 254(1/2/3/4): 347 - 354.
[38]Wang Z, Wang Q, Yang B, et al. GC-MS method for determination and pharmacokinetic study of four phenylpropanoids in rat plasma after oral administration of the essential oil ofAcorustatarinowiiSchott rhizomes[J]. J Ethnopharmacol, 2014, 155(2): 1134 - 1140..
[39]李晋成, 刘欢, 马兵, 等. 丁香酚的电喷雾负离子质谱裂解规律研究[J]. 中国渔业质量与标准, 2013, 3(4): 11 - 14.
[40]苏明明, 孙兴权, 杨春光, 等. 渔用麻醉剂MS-222、丁香酚在鲜活水产品运输中的应用及检测方法研究进展[J]. 食品安全质量检测学报, 2015,6(1): 25 - 29.
[41]Harmon T S. Methods for reducing stressors and maintaining water quality associated with live fish transport in tanks: a review of the basics[J]. Rev Aquacult, 2010, 1(1): 58-66.
[42]李晋成, 刘欢, 吴立冬, 等. 动物体内麻醉剂残留检测技术研究进展[J]. 食品科学, 2014, 35(5): 251-256.
