海水养殖中水产动物主要致病弧菌研究进展
2018-04-12王凤青孙玉增任利华姜向阳姜芳崔艳梅刘丽娟
王凤青, 孙玉增,任利华,姜向阳,姜芳,崔艳梅,刘丽娟
(山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006)
中国水产养殖产量占世界水产养殖总产量的65%[1],为世界水产业的发展做出了重大的贡献。2005—2015年,中国的海水养殖面积年均增长率为3.61%,海水养殖总产量年均增长率为3.25%[2]。随着海水养殖业迅速发展和集约化养殖规模逐渐扩大,海水养殖病害也呈多发趋势。在海水养殖感染的病原菌中,弧菌属(Vibrio)细菌(以下简称“弧菌”)占有相当大的比例,致病性弧菌被认为是海水鱼类和贝类养殖产业的“灾祸之源”[3],如2011年发生在山东省境内的流行性传染病造成红鳍东方鲀(Takifugurubripes)大量死亡,Wu等[4]从死亡的红鳍东方鲀中分离到哈维氏弧菌(V.harveyi)、轮虫弧菌(V.rotiferianus)和欧文斯氏弧菌(V.owensii);Levican和Avendaňo-Herrera[5]在大量死亡的红鳗幼体中,分离出鳗弧菌(V.anguillarum)和奥氏弧菌(V.ordalii);鲨鱼弧菌能造成鲨鱼网状内皮的囊泡化,体表出血[6];病海鱼弧菌(V.ordalii)能够造成鲑产生严重的炎症反应[7]。
弧菌是一类革兰氏阴性细菌,化能异养、兼性厌氧,细胞呈现短杆状、弯曲状、S形或螺旋形等多形态;大部分弧菌都靠鞭毛运动,多为单端极生鞭毛,但也有一端可见多根鞭毛的现象,如费氏弧菌(V.fischeri)[8]。弧菌在2216E平板上可以生长,菌落呈乳白色、有凸起、边缘光滑。在硫代硫酸柠檬酸胆盐蔗糖(TCBS)选择培养基上,能发酵蔗糖产酸的弧菌菌落呈黄色,如霍乱弧菌(V.cholerae)和溶藻弧菌(V.alginolyticus);不能发酵蔗糖产酸的弧菌菌落呈绿色,如创伤弧菌(V.vulnificus)和副溶血弧菌(V.parahaemolyticus)。
截至2016年,弧菌属共发现126个种和2个亚种,其中近100种弧菌为水生环境土著细菌[9],国内外公认的致病性弧菌约有20种[10]。本文选择鳗弧菌(V.anguillarum)、哈维氏弧菌(V.harveyi)、副溶血弧菌(V.parahaemolyticus)和溶藻胶弧菌(V.alginolyticus)4种中国海水养殖中常见的致病性弧菌,分别介绍其菌体形态结构、生物学特性、引发疾病类型及危害、致病机理和分子生物学研究进展,以期为海水养殖中弧菌性疾病防治研究提供参考。
1 鳗弧菌
1.1 生物学特性
鳗弧菌(V.anguillarum)呈弯曲杆状,具单生或周身鞭毛(图1)。分离于海洋环境,温度高于40 ℃或无氯化钠时不生长。化能异养,氧化酶阳性,于TCBS培养基上培养24 h可形成黄色菌落,而后慢慢转变成绿色[11]。
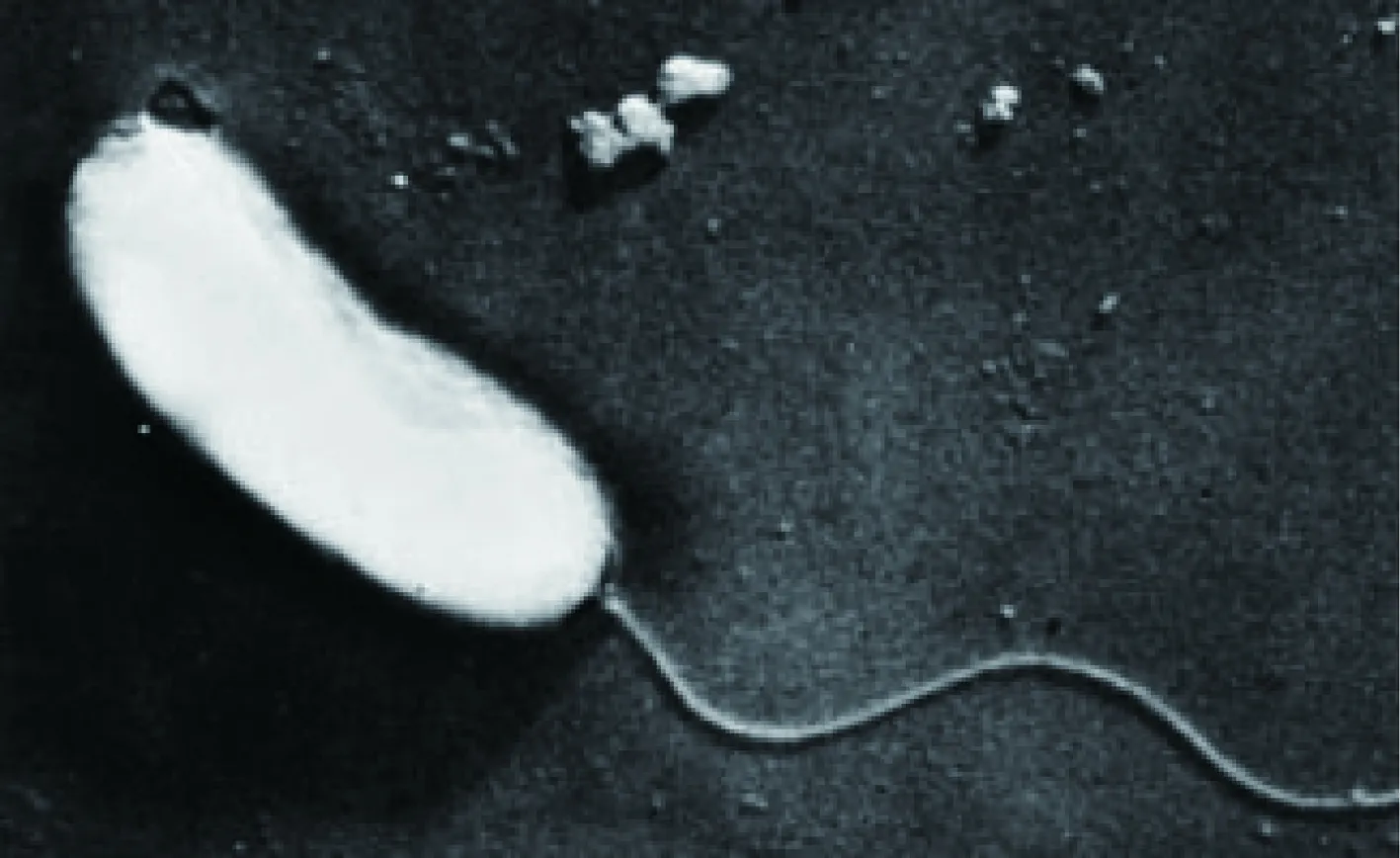
图1 鳗弧菌细胞形态[12]Fig.1 Cellular morphology of V. anguillarum[12]
1.2 流行病学特征
鳗弧菌是第一个被鉴定的鱼类病原菌[13],可引起鳗鲡感染出血性败血症,发病鱼体表有明显出血现象,鳃苍白、皮下组织水肿、眼球突出、肠道膨胀并且充满黏稠液体[3]。鳗弧菌主要是经由皮肤或口腔摄入感染鱼体[14]。现今证实,鳗弧菌可引起太平洋鲑、大西洋鲑、虹鳟、大菱鲆、鲈、海鲤、条纹鲈、鳕和香鱼等50多种鱼类发病[11, 15]。
1.3 致病机理
鳗弧菌有23个血清类型(O1~O23),只有O1、O2和少部分O3血清型的鳗弧菌可以致病[16],其他血清型的鳗弧菌为环境微生物,与鱼类的致病几乎没有相关性。O1、O2血清型鳗弧菌的分布比较广泛,O3血清型鳗弧菌仅可感染鳗鲡和香鱼[14]。鳗弧菌的致病过程包括吸附、侵袭、体内增殖及产生毒素等步骤。鳗弧菌通过吸附并入侵鱼体的通道主要包括皮肤、鳃、侧线和肠道[17],目前已经发现毒力因子有鞭毛[18]、铁捕获系统[19]、外膜蛋白[20]、蛋白酶[21]和溶血素[22]等。
1.4 分子生物学研究现状
对于鳗弧菌而言,鞭毛除提供动力侵入细胞外,还可产生黏附素,有助于细菌在细胞的表面吸附以及侵袭和定居。鞭毛的主动运动可协助细菌在体外和体内入侵细胞[23]。鳗弧菌鞭毛鞘主要成分为脂多糖(LPS),即内毒素,一般由3个部分共价连接而成:O-特异性多糖链、核心多糖和类脂A,其中类脂A是脂多糖的毒性成分。对O1型和O2a血清型鳗弧菌,光滑型LPS的菌株对鱼体有致病力,而粗糙型菌株对鱼体无致病力。宿主细胞和海水环境的盐浓度有所不同,鳗弧菌外膜蛋白在适应这种渗透压的变化中起着至关重要的作用,提供特异和非特异的通道供养分和离子通过,调节细菌细胞内外渗透压平衡,防止细胞裂解,执行着细菌吸附、侵袭等功能[24]。目前为止,鳗弧菌中发现两种铁载体依赖系统,一个是由质粒pJM1调节,质粒pJM1为65 kb,包含了铁载体-弧菌素合成和转运蛋白的大部分编码基因[25],弧菌素系统只存在携带病原质粒的O1血清型鳗弧菌中[26]。另一系统存在于O2血清型和缺少质粒的O1血清型鳗弧菌中[27]。
溶血素是单一的多肽分子,可溶解红细胞,释放出胞内血红蛋白,具有细胞毒性和动物致死性[28]。除血红细胞外,溶血素还可以溶解其他细胞,如肥大细胞、嗜中性细胞和多形核白血球等[24]。Li等[29]发现能导致鳗弧菌溶血的毒素操纵子rtx(包括rtxA、rtxB、rtxC、rtxD、rtxE和rtxH6个基因),其中rtxA编码rtx毒素,rtxC编码rtx毒素激活蛋白,rtxH编码一个保守假定蛋白,rtxB,rtxD和rtxE编码rtx毒素的运输者。vah1基因簇可以调节溶血素的毒力作用,当鳗弧菌的vah1位点发生突变时溶血性减弱[30]。
2 哈维氏弧菌
2.1 生物学特性
哈维氏弧菌(V.harveyi)是一种在海洋中分布广泛的革兰氏阴性细菌,于1963年被发现,不能够形成荚膜,无芽孢,能够产H2S,但不能产生吲哚,单端极生鞭毛[31],能够发出荧光且生活需要氯化钠[32],是常见的海洋动物致病菌[33]。在TCBS培养基上能够形成较大且边缘平滑的黄色菌落。
2.2 流行病学特征
哈维氏弧菌一般流行于夏季,主要感染对象是对虾、虹鳟、大西洋鲑、牙鲆、黑石斑鱼和大菱鲆等[34-35]。Alvarez等[36]针对1993年至1996年期间委内瑞拉病死的对虾进行调查,实验证明哈维氏弧菌的感染是导致该时期内委内瑞拉养殖鱼类和对虾的高死亡率主要因素;Pizzutto等[37]报道了哈维氏弧菌导致澳大利亚的斑节对虾(Penaeusmonodon)大量死亡。也有报道菲律宾斑节对虾虾苗孵化场感染哈维氏弧菌并且导致虾苗大量死亡的案例[38]。2015年山东省某地混合养殖的石斑鱼中曾被报道因感染哈维氏弧菌而暴发石斑鱼皮肤溃疡病。哈维氏弧菌引起的病症症状各不相同,但一般都会有厌食、眼球突出、体表出血的症状[10],更有甚者会出现鳞片脱落、皮肤及肌肉溃烂、脾脏膨胀等症状。
2.3 致病机理
目前研究发现,哈维氏弧菌致病相关因子主要包括蛋白酶[39]、溶血素[40]、外毒素[41]和脂多糖[42]等胞外产物(extracellular products, ECP)。哈维氏弧菌的鞭毛除了行使运动功能外,还可以起到吸附的作用。大部分细菌的致病作用是从吸附开始的,黏附素和受体是参与黏附的主要物质[43]。除此之外,哈维氏弧菌的致病性可能与噬菌体有关,噬菌体可以介导毒力基因的转移[10]。
2.4 分子生物学研究现状
Castillo等[44]自希腊克里特岛感染弧菌病的幼年杜氏鲥(Serioladumerili)中分离到菌株VH2和VH5,并对这两株菌的全基因组序列进行了比较分析。菌株VH2基因组G+C含量为45 mol%,包含5 079个编码基因、33个tRNA、38个假基因和3个rRNA;菌株VH5包含5 254个编码基因、93个tRNA、56个假基因和3个rRNA。发现菌株毒力因子与编码黏附素、降解胆汁、产生Ⅴ型大肠杆菌素等活动相关。有趣的是,在菌株VH5基因组中发现了霍乱毒素编码基因和小带联结毒素编码基因。Yu等[45]对分离自中国大亚湾患病斜带石斑鱼(Epinepheluscoioides)的哈维氏弧菌E385进行了全基因组序列分析。菌株E385基因组G+C含量为44.8 mol%,有119个预测蛋白属于U家族(与胞内运输、分泌、膜泡运输相关),77个预测蛋白属于V家族(与防卫机制相关),通过在线预测分析发现了85个毒力基因,这些数据显示该菌株对宿主有较强的毒力作用。
哈维氏弧菌的快速检测技术一直倍受关注,Gomez等[46]通过扩增3个保守蛋白编码基因(topA、ftsZ和mreB),简单、快速的鉴定区分亲缘关系较近的病原菌(包括哈维氏弧菌)。Cao等[47]根据哈维氏弧菌的toxR基因序列设计两对引物,利用环介导等温扩增技术快速、高特异性地检测海水养殖环境中的哈维氏弧菌。Li等[48]利用增强化学发光底物替代蛋白质印迹分析中传统的四甲基联苯胺,建立了快速高灵敏性检测哈维氏弧菌的方法。
3 副溶血弧菌
3.1 生物学特性
副溶血弧菌(V.parahaemolyticus)是一种多态杆状或轻微弯曲杆状细菌,菌体单端极生鞭毛,运动活泼,无芽孢、无荚膜。广泛分布于海洋、河口及海湾[49-50],兼性厌氧,嗜盐嗜温,最适生长温度为30~37 ℃,4 ℃时进入活的非可培养状态(viable but nonculturable, VBNC)。能够发酵葡萄糖、甘露糖,不能发酵蔗糖、乳糖。在TCBS培养基上形成蓝绿色菌落,边缘不整齐,表面有隆起、湿润不透明。
3.2 流行病学特征
副溶血弧菌流行于夏季,可导致贝类[51]、甲壳类[52]、鱼类[53]等发病。发病的虾类主要表现为红腿病或者烂鳃病,进食减少或者停止进食、运动活力下降,有的会伴随出现肠炎症状。
3.3 致病机理
研究表明,副溶血弧菌的致病过程包括黏附、侵袭、体内增殖及产生毒力因子等步骤[54]。黏附作用的本质是致病菌外膜的特殊结构与宿主表面相应受体相互作用,致使病原菌选择性的黏附于宿主细胞。已经发现的与副溶血弧菌黏附作用相关的因子主要为纤毛和细胞血凝素(cell-associated hemagglutinin, CHA)[55]。副溶血弧菌的毒力因子主要有溶血性毒素、黏附蛋白、耐热直接溶血素(thermostable direct hemolysin, TDH)、溶血相关毒素蛋白(TDH-related Hemolysin, TRH)和Ⅲ型分泌系统(the type III secretion system, T3SS)等[56]。
3.4 分子生物学研究现状
TDH和TRH免疫学性质相近,二者分别由tdh和trh基因编码,tdh和trh基因同源性达70%[57]。TDH是一种造孔毒素,有溶血活性、细胞毒性、心肌毒性和肠毒素等活性,能够在血红细胞膜上造成孔洞[58],一定大小的孔洞能够改变肠道细胞膜的离子流,造成腹泻等症状。副溶血弧菌流行病学调查发现,环境分离菌株和水产品菌株极少携带tdh和trh,所以自然界中大多副溶血弧菌为非致病菌[59]。TDH和TRH并不能完全解释副溶血弧菌的致病机制,研究发现部分致病性副溶血弧菌并没有携带tdh或者trh基因但依然能够导致宿主致病,Nishibuchi等[60]从临床病例中分离到一株致病副溶血弧菌,研究发现该菌株并不产TDH。据Pendru等[61]报道,缺少tdh和trh基因的致病性副溶血弧菌能够产生胞外蛋白酶、生物膜、嗜铁素和细胞毒素等毒性因子,导致宿主患病。
T3SS与许多革兰氏阴性病原菌毒性因子的分泌有关,全基因组测序分析数据显示两个基因簇T3SS1和T3SS2编码了Ⅲ型分泌系统,其中T3SS1位于大染色体上,T3SS2位于小染色体上[50]。目前研究发现T3SS1可转位4个效应蛋白(VopQ、VopR、VopS和VPA0450),导致细胞毒性,使细胞裂解,内容物外流[62-64]。Park等[65]敲除T3SS1结构蛋白VcrD1基因后,副溶血弧菌对HeLa细胞的毒性降低,将VcrD1基因互补表达后副溶血弧菌的毒性恢复。
4 溶藻胶弧菌
4.1 生物学特性
溶藻胶弧菌(V.alginolyticus)是短杆状革兰氏阴性细菌,菌体首尾相连可呈现“C”或“S”形。溶藻胶弧菌是革兰氏阴性海生弧菌,无芽孢、荚膜,嗜盐嗜温、兼性厌氧,在TCBS培养基上培养可生成黄色菌落。
4.2 流行病学特征
溶藻胶弧菌能够使大菱鲆、大黄鱼、石斑鱼等致病,夏季多发,发病鱼的主要症状是运动力下降、皮肤灰暗、鳞片松散并且会伴随体表溃疡,解剖后会发现肝脏、肠壁毛细血管和消化道等充血、充水的明显症状[10]。除了可以引起鱼类、虾类和贝类致病以外,溶藻胶弧菌还可引起珊瑚白化病[66]。
4.3 致病机理
溶藻胶弧菌的致病性主要取决于宿主所在环境与菌体本身的关系。研究表明,来源于健康宿主的溶藻胶弧菌与来源于发病宿主的溶藻胶弧菌菌体间存在差异,最明显的表现就是二者在TCBS培养基上形成的菌落形态不同[66]。溶藻胶弧菌的致病过程包括吸附、侵袭、体内增殖等步骤,致病作用主要是通过产生致病因子对宿主机体细胞产生损害以及对新陈代谢产生干扰而发生的。溶藻胶弧菌致病因子包括黏附素、胞外产物、脂多糖、外膜蛋白及铁载体等[10]。细菌的吸附过程除了与菌体自身的特性如运动性、趋向性等有关外,还与宿主细胞表面特异性受体相关。Balebona等[67]对溶藻胶弧菌胞外产物进行了研究,发现其具有酪蛋白酶、淀粉酶、明胶酶和磷脂酶等酶活性,并且对多种鱼类细胞具有较强的毒性。溶藻胶弧菌引起珊瑚白化病的致病机制尚需进一步研究。
4.4 分子生物学研究现状
致病性溶藻胶弧菌存在种内差异,在被检测的致病性溶藻胶弧菌中,53%不携带质粒,其余47%检测出12种质粒,分属8个类型[68]。Xie等[69]在对分离自中国广东省近海海水养殖环境的72株溶藻胶弧菌毒力基因的研究中,并没有发现毒力基因与致病性的相关性。例如4株溶藻胶弧菌GS03008、GS03011、GS03023和GS03024具有致病性,但没有检测到任何毒力基因;相反,在菌株ZJ03010、RP04102及RP04109等溶藻胶弧菌中检测到了毒力基因,而这些菌株并没有表现出致病性,这说明溶藻胶弧菌可能具有一套独特的毒力基因和致病机制。
5 展望
中国具有相对优越的海水养殖条件,大陆海岸线长达18 000 km,管辖在内的海域面积达300万km2之余,10 m等深线以内的海滩和浅海海域面积达1.0×105km2,其中,适合海水养殖的海域面积达1.3×104km2[70]。据统计,2014年中国水产品总产量为64 615 174 t,其中,海水养殖总产量为18 126 481t[2],占水产品总产量的28.05%。随着水产养殖品种的增加和养殖规模的扩大,弧菌病害对海水养殖的负面影响越发不容忽视,水产养殖过程中弧菌病防治的研究越来越受重视。近年来,随着分子生物学和转录组、基因组及宏基因组等分析技术的不断发展,弧菌的致病机制越来越清晰。
目前,全球都将目光聚焦在构建生态和谐、环境友好上。在各种致病菌治疗手段的研究中,生态友好类的治疗方式越来越受关注,在现存的化学、物理和生物防治手段中,应用生物手段防治细菌性疾病的优势明显。因此,在未来的研究中,应更加关注致病性细菌的抗生素敏感性,检测现有的治疗手段是否对环境造成了危害;研发弧菌疫苗,通过高效的弧菌疫苗替代污染性高的化学抑菌方法,在减少对环境破坏的同时有效抑制致病性弧菌;通过抑菌圈检测等方法筛选可杀死或者抑制致病性弧菌的菌株,研究其抗菌或抑菌机制,分离与之相关的次级代谢产物,研发新的高效无污染的微生物防治产品,以期在水产弧菌病的防治方面有新的突破。具有捕食功能的菌体,尤其是对致病性菌具有捕食功能的菌体,极有可能开发成微生态制剂,利用微生态制剂防治水产养殖中的相关疾病,将是解决以上问题的一个很好的途径。蛭弧菌在水产养殖中的使用就是一个成功的案例。蛭弧菌对诸多水产品的病原菌(沙门菌属、志贺菌属、埃希菌属、气单胞菌属、假单胞菌属、欧文菌属、变形杆菌属和弧菌属球菌)均具有较强的裂解活性,特别是对弧菌属、沙门菌属和志贺菌属。不仅可以预防疾病,而且能改善养殖环境,有望成为抗生素的替代品,作为一种“生物渔药”在水产动物的健康养殖中发挥极其重要的作用,产生良好的经济效应和社会效应[71]。
参考文献:
[1]马昊楠. 现实与理性的选择——业内资深人士谈水产养殖业抗生素使用问题[J]. 首都食品与医药, 2015, 19(3): 37-38.
[2]农业部渔业渔政管理局. 中国渔业统计年鉴[M].北京:中国农业出版社, 2015: 28-29, 56.
[3]Austin B, Austin D A. Bacterial fish pathogens: disease of farmed and wild fish[M]. New York-Chichester: Springer-Praxis Publishing, 2007: 99.
[4]Wu F, Tang K, Yuan M,et al. Studies on bacterial pathogens isolated from diseased torafugu (Takifugurubripes) cultured in marine industrial recirculation aquaculture system in Shandong Province, China[J]. Aquac Res, 2015, 46(3): 736-744.
[5]Levican A,Avendaňo-Herrera R. Bacteria associated with mass mortality of post-larvae of red conger eel (Genypteruschilensis) cultured in a Chilean farm[J]. Bull Eur Assoc Fish Pathol, 2015, 35(5): 162-169.
[6]Rodgers C J, Furones M D. Disease problems in cultured marine fish in Mediterranean[J]. Fish Pathol, 1998, 33(4): 157-164.
[7]Muroga K, Tatani M.Vibrioordaliiisolated from diseased ayu (Plecoglossusaltivelis) and rockfish (Sebastesachlegeli)[J]. Fish Pathol, 1986, 21(4): 239-243.
[8]Reichelt J L, Baumann P. Taxonomy of the marine, luminous bacteria[J]. Arch Microbiol, 1973, 94(4): 283-330.
[9]Gomez-Gil B, Thompson C C, Matsumura Y,et al. The familyVibrionaceae[M]//Prokaryotes-Gammaproteobacteria. Germany: Springer, 2014: 659-747.
[10]张晓华. 海洋微生物学[M]. 第二版. 北京: 科学出版社, 2016: 256.
[11]MacDonell M T, Colwell R R. Phylogeny of theVibrionaceae, and recommendation for two new genera,ListonellaandShewanella[J]. System Appl Microbial, 1985, 6(2): 171-182.
[12]Actis L A, Tolmasky M E, Crosa J H. Fish diseases and disorders. Volume 3: viral, bacterial and fungal infections[M]//Woo P T K, Bruno D W. Fish diseases and disorders. United Kingdom: CAB International Publishing, 2011: 523-558.
[13]Austin B. Taxonomy of bacterial fish pathogens[J]. Vet Res, 2011, 42(1): 20.
[14]Alicia E T, Beatriz M, Jesús L R. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture, 2005, 246(1/2/3/4): 37-61.
[15]Toranzo A E, Barja J L. A review of the taxonomy and seroepizootiology ofVibrioanguillarum, with special reference to aquaculture in the northwest of Spain[J]. Dis Aquat, 1990, 9(1): 73-82.
[16]Pedersen K, Grisez L, Houdt R, et al. Extended serotyping scheme forVibrioanguillarumwith the definition of seven provisional O-serogroups[J]. Curr Microbiol, 1999, 38(3): 183-189.
[17]Tnakai T, Muroga K. Scanning electron microscopy on the skin surface of ayuPlecoglossusaltivelis infected withVibrioanguillarum[J]. Dis Aquat Organ, 1990, 8(1): 73-75.
[18]Naka H, Crosa J H. Genetic determinants of virulence in the marinefish pathogenVibrioanguillarum[J]. Fish Pathol, 2011, 46(1): 1-10.
[19]Welch T J, Crosa J H. Novel role of the lipopolysaccharide O1 side chain in ferric siderophore transport and virulence ofVibrioanguillarum[J].Infect Immun, 2005,73(9): 5864-5872.
[20]Croxatto A, Lauritz J, Chen C, et al.Vibrioanguillarumcolonization of rainbow trout integument requires a DNA locus involved in exopolysaccharide transport and biosynthesis[J]. Environ Microbiol, 2007, 9(1): 370-382.
[21]Mo Z, Guo D, Mao Y, et al. Identification and characterization of theVibrioanguillarumprtVgene encoding a new metalloprotease[J]. Chin J Oceanol Limnol, 2010, 28(1): 55-61.
[22]Mou X,Spinard E J, Driscoll M V, et al. H-NS is a negative regulator of the two hemolysin/cytotoxin gene clusters inVibrioanguillarum[J]. Infect Immun, 2013, 81(10): 3566-3576.
[23]Ormonde P, horstedt P, O′Toole R. Role of motility in adherence to and invasion of a fish cell line byVibrioanguillarum[J]. Bacteriol, 2000, 182(8): 2326-2328.
[24]Frans I, Michiels C W, Bossier P, et al.Vibrioanguillarumas a fish pathogen: virulence factors, diagnosis and prevention[J]. J Fish Dis, 2011, 34(9): 643-661.
[25]Naka H, Liu M, Actis L A, et al. Plasmid- andchromosome-encoded siderophore anguibactin systems found in marinevibrios: biosynthesis, transport and evolution[J]. Biometals, 2013, 26(4): 537-547.
[26]Li Y, Ma Q. Iron acquisition strategies ofVibrioanguillarum[J].Front Cell Infect Microbiol, 2017, 7:342.
[27]Balado M, Osorio C R, Lemos M L. A gene clusterinvolved in the biosynthesis of vanchrobactin, a chromosome-encodedsiderophore produced byVibrioanguillarum[J]. Microbiol-Sgm, 2006, 152(12): 3517-3528.
[28]Zhang X, Austin B. Haemolysins inVibriospecies[J]. J Appl Microiol, 2005, 98(5): 1011-1019.
[29]Li L, Rock J L, Nelson D R. Identification and characterization of a repeat-in-toxin gene cluster inVibrioanguillarum[J]. Infect Immun, 2008, 76(6): 2620-2632.
[30]Rock J L, Nelson D R. Identification and characterization of a hemolysingene cluster inVibrioanguillarum[J]. Infect Immun, 2006, 74(5): 2777-2786.
[31]Johnson F H, Shunk I V. An interesting new species ofLuminousBacteria[J]. J Bacteriol, 1936, 31(6): 585-593.
[32]Austin B, Zhang X.Vibrioharveyi: a significant pathogen of marine vertebrates and invertebrates[J]. Lett Appl Microbiol, 2006, 43(2): 119-124
[33]Turner J W,Good B,Cole D. Plankton composition and environmental factors contribute toVibrioseasonality[J]. ISME J, 2009, 3(9): 1082-1092.
[34]Zhang X, Austin B. Pathogenicity ofVibrioharveyito salmonids[J]. J Fish Dis, 2000, 23(2): 93-102.
[35]Zhou J, Fang W, Yang X, et al. A nonluminescent and highly virulentVibrioharveyistrain is associated with ‘bacterial white tail disease’ ofLitopenaeusvannameishrimp[J]. PLoS One, 2012, 7(2): e29961.
[36]Alvarez J D, Austin B, Alvarez A M, et al.Vibrioharveyi: a pathogen of penaeid shrimps and fish in Venezuela[J]. J Fish Dis, 1998, 21(4): 313-316.
[37]Pizzutto M, Hirst R G. Classification of isolates ofVibrioharveyivirulent to Penaeus monodon larvae by protein profile analysis and M13 DNA fingerprinting[J]. Dis Aquat Organ, 1995, 21(1): 61-68.
[38]Lavilla-Pitogo C R, Albright L J, Paner M G, et al. Studies on the source of luminescentVibrioharveyiinPenaeusmonodonhatcheries[M]// Shariff I M. Subaslnghe R P, Arthur J R. Diseases in Asian aquaculture. Fish Health Section, Indonesia:Asian Fisheries Society, 1992: 157-164.
[39]沈锦玉, 李新华, 潘晓艺, 等. 哈维氏弧菌的主要致病因子及其特性分析[J]. 浙江大学学报(农业与生命科学版), 2011, 37(2): 142-148.
[40]陈吉祥, 杨慧, 颜显辉, 等. 致病性哈维氏弧菌溶血素基因克隆及其检测 [J]. 中国水产学报, 2005, 12(5): 580-587.
[41]Liuxy P C, Lee K K, Chen S N. Pathogenicity of different isolates ofVibrioharveyiin tiger prawn,Penaeusmonodon[J]. Lett Appl Microbiol, 1996, 33(2): 129-132.
[42]Montero A B, Austin B. Characterization of extracellular products from an isolate ofVibrioharveyirecovered from diseased post-larvalPenaeusvannamei(Bonne) [J]. J Fish Dis, 2001, 22(5): 377-386.
[43]黄辉. 哈维弧菌表面抗原的克隆和真核表达[D].武汉: 华中农业大学, 2010.
[44]Castillo D, D′Alvise P, Middelboe M, et al. Draft Genome Sequences of the Fish PathogenVibrioharveyiStrains VH2 and VH5[J]. Genome Announce, 2015, 3(5): e01062-15.
[45]Yu M, Ren C, Qiu J, et al. Draft genome sequence of the opportunistic marine pathogenVibrioharveyiStrain E385[J]. Genome Announce, 2013, 1(6): e00677-13.
[46]Gomez A C, Høj L, Owens L, et al. A multiplex PCR-based protocol for identification and quantification ofVibrioharveyi-related species[J]. Aquaculture, 2015, 437(3): 195-200.
[47]Cao Y, Wu Z, Jian J, et al. Evaluationof a loop-mediated isothermal amplification method forthe rapid detection ofVibrioharveyiin cultured marine shellfish[J]. Lett Appl Microbiol, 2010, 51(1): 24-29.
[48]Li H, Zhou Y, Wang Q, et al. Sensitivity improvement of rapidVibrioharveyidetection with an enhanced chemiluminescent-based dot blot[J]. Lett Appl Microbiol, 2017, 65(3): 206-212.
[49]董雪, 王秋雨, 金莉莉, 等. 副溶血弧菌分子分型和检测研究进展[J]. 中国卫生检验杂志, 1999, 18(2): 379-381.
[50]祝儒刚. 海产品中致病性副溶血弧菌PCR快速检测体系建立及定量研究[D].沈阳: 沈阳农业大学, 2011.
[51]Lee K K, Liu P C, Huang C Y.Vibrioparahaemolyticus infectious for both humans and edible mollusk abalone [J]. Microb Infect, 2003, 5(6):481-485.
[52]Alapide-Tendencia E V, Dureza L A. Isolation ofVibriospp. fromPenaeusmonodon(Fabricius) with red disease syndrome[J]. Aquaculture, 1997, 154(2):107-l14.
[53]Hatai K, Yasumoto S, Yasunagac N.Vibriostrains isolated from cultured Japanese horse mackerel (Trachurusjaponicus) [J]. Fish Pathol, 1981, 16:111-118.
[54]田丽花. 副溶血弧菌免疫原性蛋白的鉴定及研究[D]. 杭州: 浙江理工大学, 2015.
[55]杨芳, 李秀娟, 徐保红. 副溶血弧菌分子致病机制研究进展[J]. 中华疾病控制杂志, 2010, 14(6): 562-565.
[56]Letchumanan V, Chan K G, Lee L H.Vibrioparahaemolyticus: a review on the pathogenesis, prevalence, and advance molecular identification techniques[J]. Front Microbiol, 2014, 5: 705.
[57]Kishishita M, Matsuoka N, Kumagai K, et al. Sequence variation in the thermostable direct hemolysin-related hemolysin (trh) gene ofVibrioparahaemolyticus[J]. Appl Environ Microbiol, 1992, 58(8): 2449-2457.
[58]Matsuda S, Kodama, Okada N, et al. Association ofVibrioparahaemolyticusthermostable direct hemolysin with lipid rafts is essential for cytotoxicity but not hemolytic activity[J]. Infect Immun, 2010, 78(2): 603-610.
[59]Li Y, Xie X, Shi X, et al.Vibrioparahaemolyticus, Southern Coastal Region of China, 2007—2012[J]. Emerg Infect Dis, 2014, 20(4): 685-688.
[60]Nishibuchi M, Taniguchi T, Misawa T, et al. Cloning and nucleotide sequence of the gene (trh) encoding the hemolysin relatedto the thermostable direct hemolysin ofVibrioparahaemolyticus[J]. Infect Immun, 1989, 57(9): 2691-2697.
[61]Pendru R. Roles of thermostable direct hemolysin (TDH) and TDH-related hemolysin (TRH) inVibrioparahaemolyticus[J]. Front Microbiol, 2015, 5: 805.
[62]Waddell B, Southward C M, Mckenna N, et al. Identification ofVPA0451 as the specific chaperone for theVibrioparahaemolyticuschromosome 1 type Ⅲ-secreted effectorVPA0450[J]. FEMS Microbiol Lett, 2014, 353(2): 141-150.
[63]Burdette D L, Yarbrough M L, Orvedahl A, et al.Vibrioparahaemolyticusorchestrates a multifaceted host cell infection by induction of autophagy, cell rounding, and then cell lysis[J]. P Natl Acad Sci USA, 2008, 105(34): 12497-12502.
[64]Ono T, Park K S, Ueta M, et al. Identification of proteins secreted viaVibrioparahaemolyticustype Ⅲ secretion system 1[J]. Infect Immun, 2006, 74(2): 1032-1042.
[65]Park K S, Ono T, Rokuda M, et al. Functional characterization oftwo type Ⅲ secretion systems ofVibrioparahaemolyticus[J]. Infect Immun, 2004, 72(11): 6659-6665.
[66]Xie Z, Ke S, Hu C Q, et al. First characterization of bacterial pathogen,Vibrioalginolyticus, forPoritesandrewsiWhite Syndrome in the South China Sea[J]. PLoS ONE, 2013, 8(9): e75425.
[67]Balebona M C, Morinigo M A, Borrego J J. Hydrophobicity and adhesion to fish cells and mucus ofVibriostrains isolated from infected fish[J]. Int Microbiol, 2001, 4(1): 21-26.
[68]Zorrilla I, Morinigo M A, Castro D, et al. Intraspecific characterization ofVibrioalginolyticusisolates recovered from cultured fish in Spain[J]. J Appl Microbiol, 2003, 95(5): 1106-1116.
[69]Xie Z, Hu C, Chen C, et al. Investigation of sevenVibriovirulence genes amongVibrioalginolyticusandVibrioparahaemolyticusstrains from the coastal mariculture systems in Guangdong, China[J]. Lett Appl Microbiol, 2005, 41(2): 202-207.
[70]Xie B, Qin J, Yang H, et al. Organic aquaculture in China: a review from a global perspective[J]. Aquaculture, 2013, 414(21): 243-253.
[71]黄华伟, 邓时铭, 廖伏初,等. 蛭弧菌的生物学特性及其在刺参养殖中的应用前景[J].河北渔业, 2008(5):1-4.
