铝胁迫下常绿杨根系有机酸和氨基酸的分泌
2018-04-11钱莲文李清彪孙境蔚
钱莲文,李清彪,孙境蔚,冯 莹
(1.厦门大学环境与生态学院,福建 厦门 361102;2.泉州师范学院资源与环境学院,福建 泉州 362000)
杨树(Populusspp.)是我国北方和长江中下游地区广泛栽培的造林树种,普遍认为适合在北方温带和北亚热带地区种植,在南方发展的意义不大.然而,不少地处热带和亚热带的国家如印度、南非、澳大利亚、巴基斯坦和巴西等,都有适合当地的杨树品种,杨树栽培占有一定地位[1].A-61/186(Populus×euramericanacv. A-61/186)是1987年中国林科院林业研究所郑世锴研究员从巴基斯坦引进的3个半常绿-常绿杨树无性系之一,这3个无性系均具有易繁殖、适应性强、造林成活率高、生长快、材质好的特点,适于营造用材林和“四旁”绿化.它们能适应我国南方气候,冬季不落叶或半落叶,生长时间长,在国内统称为常绿杨[2].近年来,面对我国木材供需矛盾和南方用材树种单一等带来的突出问题,人们开始重新认识杨树,杨树的栽培区逐渐向南扩展,新的南方型杨树栽培区种植品系也不断涌现[3-4].
我国南方土壤酸化问题日趋严重,由土壤酸化带来的植物铝毒害问题也尤为突出,许多重要的南方用材树种遭受铝毒害状况及其响应铝胁迫的机制均有报道[5-8].目前,关于杨树铝胁迫的研究较少且主要集中在不同无性系之间的耐铝性能对比上[9-10],关于杨树抗铝机制的研究还未见报道.为探究富铁铝化的酸性土壤是否会对杨树在亚热带地区的种植产生影响,本课题组前期以常绿杨A-61/186作为供试对象,研究发现酸性条件下铝胁迫对其生长及生理生态特性会产生一定影响[11-14].根系分泌物被认为是植物解铝毒的重要机制之一,其中根系分泌低分子质量有机酸螯合铝的研究最为成熟,几乎涵盖了所有植物不同品种间耐铝性能的差别,同时揭示了植物内外部的解毒机制[15-16],但铝胁迫下植物分泌物中低分子质量氨基酸的作用还不明确.本研究对不同浓度铝胁迫下常绿杨根系分泌物中氨基酸和有机酸的种类及含量变化进行分析,并探讨两者在解铝毒作用方面是否存在相加、协同或拮抗的关系,以期为研究杨树对铝胁迫的抗逆性机制提供参考.
1 材料与方法
1.1 取材与培养
剪取约15 cm长的常绿杨(A-61/186)树种一年生插条,扦插在白色泡沫箱内,箱内盛18 L培养液,用一泡沫浮于培养液面固定插条,每盆6株,随机排列,共24盆,用空气泵昼夜连续通气;扦插后先用自来水培养20 d,生根后挑选生长状况一致的植株分装18盆,每盆3株,用Hoagland全素营养液培养,参照影响其他植物生理生态特性的铝浓度[12,17-18],并结合本研究预实验结果,加入不同浓度的AlCl3·6H2O,设置对照组(K0)及5个铝处理组(K1~K5)浓度依次为0,0.074,0.222,0.370,0.518和0.666 mmol/L,用稀盐酸调整pH值为4.8,每个处理重复3次.在玻璃阳光大棚培养,自然温度和光照,每7 d更换一次培养液,培养90 d后进行相关指标的测定.
1.2 根系分泌物的测定
将胁迫处理的植株移出培养箱,先用自来水冲洗;再用超纯水清洗,冲洗干净的植株浸入800 mL已加入微生物抑制剂(百里酚)的营养液中,培养6 h后取出,再用超纯水淋洗其根部,共得到约1 L的根系分泌物.将收集的根系分泌物用0.45 μm滤膜抽滤,在40 ℃、0.1 kPa负压下旋转蒸发浓缩至5 mL,再用0.22 μm滤膜过滤[19-20].用PHS-4CT型数字显示精密台式酸度计(奥豪斯仪器有限公司)测定pH值;采用反相高效液相色谱法在2695型高效液相色谱仪(Waters公司)上测定有机酸种类及含量[21-22];用835-50型氨基酸自动分析仪(日立公司)测定氨基酸种类及含量.
1.3 数据处理及统计分析
采用SPSS 18.0软件进行相关性分析和显著性检验,用Sigmaplot 12.5软件制图.
2 结果与分析
2.1 铝胁迫下常绿杨根系分泌物的pH值
如图1所示:常绿杨根系分泌物为中性偏碱性,在无铝胁迫时pH值为8.17,随着铝胁迫浓度的升高pH值逐渐减小但均高于7,在最大浓度K5时pH值为7.30;对照组K0与不同浓度铝胁迫处理组的pH值均存在显著差异(p<0.05),但K1与K2之间、K3与K4之间差异不显著(p>0.05),最大浓度K5胁迫下的pH值与其他浓度下均差异显著(p<0.05).相关性分析结果表明,pH值和铝胁迫浓度呈显著负相关(r=-0.901,p=0.007<0.01).

不同小写字母表示差异显著,下同.图1 铝胁迫下常绿杨根系分泌物pH值的变化Fig.1 The pH value changes of the evergreen poplar root exudates under aluminum stress
2.2 铝胁迫下常绿杨根系分泌有机酸的含量
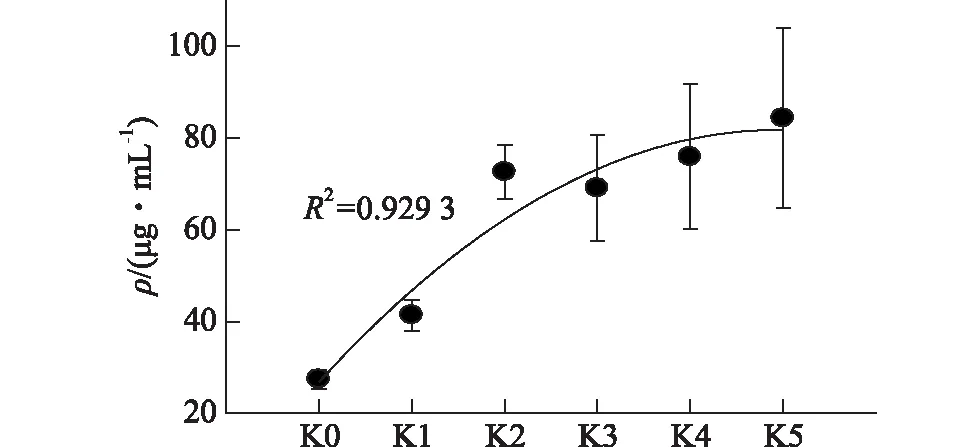
图2 铝胁迫下常绿杨根系分泌有机酸的总量变化Fig.2 The total content variation of organic acids in evergreen poplar root exudates under aluminum stress
如图2所示,铝胁迫下常绿杨根系有机酸分泌总量随着胁迫程度的加剧而增大,与铝胁迫浓度呈显著正相关(r=0.903,p=0.014<0.05),是杨树应对铝胁迫的一种响应机制.
参考目前已检测到的根系分泌物中常见有机酸种类[23-24],对铝胁迫下常绿杨根系分泌物中的马来酸、草酸、酒石酸、苹果酸、柠檬酸、琥珀酸、乳酸、乙酸、甲酸、丁酸这10种有机酸进行了检测,只有5种有机酸在无铝胁迫和铝胁迫下均有分泌,结果如图3所示:草酸和柠檬酸的含量随着铝胁迫浓度的升高而整体呈升高趋势;琥珀酸和乳酸的含量从K0到K2持续上升,最大值出现在铝胁迫浓度为K2时,之后随着铝胁迫浓度的升高而呈下降趋势;乙酸的含量只在低浓度K0到K2下检测到.相关性分析结果显示:草酸(r=-0.998)和柠檬酸(r=-0.918)的含量与铝胁迫浓度呈显著正相关(p<0.01),而其他3种有机酸的含量与铝胁迫浓度无显著相关性.

图3 铝胁迫下常绿杨根系分泌物中不同有机酸的含量Fig.3 The contents of different organic acid species in evergreen poplar root exudates under aluminum stress

图4 铝胁迫下常绿杨根系分泌不同有机酸的含量百分比Fig.4 The content percentages of different organic acid species in evergreen poplar root exudates under aluminum stress
从不同有机酸分泌量随铝胁迫浓度的变化分布来看(图4):草酸分泌量最大,在有机酸中所占百分比随着铝胁迫浓度的升高而增大,在K4和K5铝胁迫浓度下均超过了50%;乳酸和琥珀酸所占百分比随着铝胁迫浓度的升高而减小;柠檬酸所占百分比随着铝胁迫浓度的升高而增大,尤其从K1至K3增长明显;乙酸在无铝胁迫K0、较低浓度K1下分别占16.41%和16.48%,在K2下减小到8.00%,在K3至K5下无分泌.
2.3 铝胁迫下常绿杨根系分泌氨基酸的含量
从不同铝胁迫浓度下氨基酸总量的变化趋势来看(图5):氨基酸的分泌总量从K0到K2不断增大,到达K2后增长趋势趋于平缓,K2、K3、K4之间无显著差异,但增大到K5时氨基酸的分泌总量又下降.可见低浓度铝胁迫下,杨树通过分泌氨基酸来减轻铝毒害,但铝胁迫浓度过高后氨基酸分泌会受阻.

图5 铝胁迫下常绿杨根系分泌氨基酸的总量变化Fig.5 The total content variation of amino acids in evergreen poplar root exudates under aluminum stress
常绿杨根系分泌物中共检出17种氨基酸,分别是天门冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)、半胱氨酸(Cys)、缬草氨酸(Oxa)、甲硫氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、苯丙氨酸(Phe)、赖氨酸(Lys)、组氨酸(His)、精氨酸(Arg)和脯氨酸(Pro).从图6可以看出,常绿杨根系分泌的17种氨基酸随着铝胁迫浓度的变化呈现4种不同的变化趋势:1) 在胁迫初期随着铝胁迫浓度的增大而增大,在K2时达到峰值,在K3至K5持续下降,有Asp、Ser、Thr、Glu、Ala、Lys和Arg 7种(图6(a)~(g));2) 在胁迫初期随着铝胁迫浓度的增大而增大,在K2至K4时保持平台高值,K5时下降,有Gly、Oxa和His 3种(图6(h)~(j));3) 在胁迫初期随铝胁迫浓度增大而增大,在K4时达到最大,在K5时有所下降,有Cys、Met、Ile、Leu和Phe 5种(图6(k)~(o));4) 随铝胁迫浓度增大持续增大,在K4和K5时增长趋于平缓,有Tyr和Pro 2种(图5(p)和(q)).可见常绿杨根系分泌物中不同氨基酸响应铝胁迫的方式不同,所起的作用可能不同.

图6 铝胁迫下常绿杨根系分泌各种氨基酸的含量Fig.6 The contents of different amino acid species in evergreen poplar root exudates under aluminum stress
3 讨 论
3.1 铝胁迫下根系pH值对铝存在形态的影响
在铝胁迫下植物根尖容易富集铝,从而对植物产生毒害,并进一步影响植物根系的生长[25].但铝毒害作用程度与铝的存在形态密切相关,铝的化学形态随着环境条件不同有所差别:在碱性条件下,单体羟基铝发生聚合反应呈现一系列聚合羟基形态;在中性条件下,铝则形成Al(OH)3固体;碱性和中性条件下铝对生物毒性较小,但在酸性条件下,铝以Al3+、Al(OH)2+和Al(OH)2+形式存在,这些形态的铝对植物毒害作用很大[26].从根系分泌物的pH值来看,常绿杨根系分泌物为中性偏碱性,这一条件下铝多以聚合羟基形态和固体形态存在,在一定程度上减轻了铝对常绿杨的毒性;随着铝胁迫程度的增大,根系分泌更多的酸性物质使pH值降低.因此,根系pH值降低可能是常绿杨响应铝胁迫的一种反应机制.
3.2 铝胁迫下根系分泌有机酸的解毒作用
铝胁迫下植物根系分泌的低分子质量有机酸与铝螯合,形成植物难以吸收且无毒害的复合体,因而达到植物体外抗铝毒害的目的[15,27],根系分泌的有机酸种类主要有柠檬酸、苹果酸、草酸等.在常绿杨根系分泌物中测出的有机酸种类有草酸、柠檬酸、琥珀酸、乳酸、乙酸5种.草酸和柠檬酸的含量较大且与铝胁迫浓度呈显著正相关;琥珀酸和乳酸在低浓度铝胁迫下分泌量较大,随着铝胁迫浓度加大而分泌受阻,含量下降;乙酸只在低浓度铝胁迫下检测到;此外,有机酸分泌总量随着胁迫程度的加剧而增大,与铝胁迫浓度呈显著正相关.因此,杨树与其他植物对铝胁迫有着相同的解毒机制,即通过分泌有机酸与铝离子结合或者改变铝离子的存在形态,以减轻铝对植物根系的毒害.从本研究所测得的几种有机酸来看,草酸和柠檬酸在常绿杨抗铝胁迫中发挥主要作用,更多有机酸种类还需要进一步测定.
3.3 铝胁迫下根系分泌氨基酸对抗逆性的贡献
常绿杨根系分泌物共检出了17种氨基酸,随着铝胁迫浓度的变化呈现4种变化趋势:7种在浓度为0.222 mmol/L(K2)时达到最大,此后持续下降;3种在0.222~0.518 mmol/L(K2至K4)范围内保持高值平台,最大浓度0.666 mmol/L(K5)时下降;5种在铝胁迫浓度0.518 mmol/L(K4)时达到最大,最高浓度0.666 mmol/L(K5)胁迫下有所下降;2种在0.518和0.666 mmol/L (K4和K5)时达到高值.这4种趋势说明了根系分泌物中不同氨基酸响应铝胁迫的机制不同:第1种为低浓度铝胁迫下分泌就会受阻的类型;第2种和第3种为较高浓度铝胁迫下分泌才会受阻的类型;第4种为在高浓度铝胁迫下持续分泌的类型.因此,铝胁迫下常绿杨根系分泌物中不同氨基酸对铝胁迫的抗逆性贡献不同.17种氨基酸在无铝胁迫常绿杨根系中均有分泌,说明它们均不是常绿杨响应铝胁迫而产生的特异性分泌物,相比较而言,在较低浓度铝胁迫下分泌就受阻的氨基酸对铝胁迫的抗逆性更弱.从不同铝浓度下氨基酸分布总量的变化趋势来看,氨基酸的分泌量在低浓度铝胁迫下不断增大,在铝胁迫浓度较高时趋于稳定后又下降,但铝胁迫浓度最大时的分泌量仍大于无铝胁迫时的分泌量,因此,常绿杨根系分泌氨基酸也是响应铝胁迫的机制之一.目前关于铝胁迫下氨基酸与植物抗铝毒关系的研究还不深入,铝胁迫下植物根系分泌的许多氨基酸是否具有解铝毒的作用尚无定论[17].当植物遭受逆境胁迫时,根系分泌物会改变土壤中难溶性养分的形态以利于植物吸收并调节根际微生物活性,是植物应对逆境的机制之一[28].氨基酸是土壤有机氮的重要组成部分,是土壤中微生物的重要营养来源,微生物以氨基酸为原料合成调节和刺激植物生长的生长调节剂[29];而微生物的代谢产物又会对氨基酸的分泌产生影响[30].因此,铝胁迫下常绿杨根系分泌的氨基酸一方面可能与铝离子形成稳定的螯合物复合体,降低其活性;另一方面可能通过影响根际微生物的种类数量及生理活性等,在植物抗铝毒的过程中起营养补充的间接作用.这一机制需要进一步探讨论证.
3.4 铝胁迫下根系分泌有机酸和氨基酸的关系
根系分泌物会影响铝在植物根部的化学形态,铝的增加也会改变根系分泌物的分泌量和组成成分,从而减轻植物受毒害的程度,这是植物在逆境下的一种自我保护机制[31].草本植物,尤其是一些农作物如大豆(Glycinemax)、玉米(Zeamays)、小麦(Triticumaestivum)等存在根系分泌有机酸应对铝胁迫的机制[32-34];木本植物根系分泌有机酸的研究主要集中在少数喜酸性植物如龙眼(Dimocarpuslongana)、茶树(Camelliasinensis)等[24,35],龙眼根系分泌物中柠檬酸、苹果酸、草酸的含量随铝胁迫浓度的增大而增大[24],草酸、苹果酸和柠檬酸是铝胁迫下茶树根系分泌的3种主要有机酸[35];此外,马尾松(Pinusmassoniana)幼苗根系草酸和苹果酸的分泌量也随铝胁迫浓度的增大而增大[36].关于铝胁迫下根系分泌氨基酸的研究较少.龙眼根系氨基酸的分泌量在≤0.185 mmol/L铝浓度处理时增加,分泌氨基酸的种类在≤0.074 mmol/L铝浓度处理时增加,根系分泌的氨基酸总量和种类都随铝胁迫浓度的增大而减少[24];中低铝浓度下大豆根系分泌的氨基酸总量随铝浓度的增大而增加,而高铝浓度下氨基酸的种类减少,各种氨基酸分泌量变化不一致[37].对比以上研究可以看出,铝胁迫下常绿杨根系分泌有机酸和氨基酸的种类及变化趋势与其他植物相似,但因为不同植物的培养介质、处理时间以及最后计算单位不同,所以其根系分泌物绝对含量之间的可比性较差.在本研究中,随着铝胁迫浓度的变化,根系分泌有机酸的总量在27.42~84.20 μg/mL之间,分泌氨基酸的总量在4.85~12.84 μg/mL之间,氨基酸含量远低于有机酸含量,与其他植物的研究结果类似,这表明铝胁迫下根系分泌物中氨基酸所起的生态作用可能与有机酸不同.有机酸主要通过与铝离子结合或者改变铝离子的存在形态而减轻铝毒害;由于含量的微量性,氨基酸更多以营养作用为主,对铝离子的解毒作用为辅.进一步可以考虑研究铝胁迫下常绿杨体内氨基酸的变化规律,与体外根系分泌氨基酸的结果相结合来阐明铝胁迫下氨基酸在抗铝胁迫过程中所起的作用.此外,常绿杨根系生物量随着铝胁迫浓度的降低而下降[12],在生物量持续降低的情况下,有机酸和氨基酸的分泌量和种类呈现不同的变化规律,这进一步说明了铝胁迫下常绿杨根系有机酸和氨基酸的分泌是一种响应机制.
杨树普遍适合种植在中性偏碱性土壤上[2],从本研究的结果来看,碱性环境及根系分泌的有机酸和氨基酸减弱了铝对植物的毒害.后续研究中可通过加入外源有机酸或氨基酸来进一步探讨其作用以及常绿杨对铝胁迫的外部排斥和内部耐受机制.
参考文献:
[1]洪明生,郑世锴,李玉科,等.福州地区半常绿及落叶杨树无性系引种试验[J].林业科学研究,1998,11(4):108-111.
[2]郑世锴.杨树丰产栽培[M].北京:金盾出版社,2006:66-68.
[3]张晓虹.杨树优良品种选育及特性研究[J].安徽农业科学,2017,45(6):160-162,227.
[4]刘俊龙,吴中能,于一苏,等.江淮杨树新品系材性研究[J].安徽林业科技,2015,41(4):6-8.
[5]吴若菁,庄捷,黄婧,等.马尾松幼苗对模拟酸雨与铝胁迫的响应及其抗性机制[J].林业科学,2009,45(12):22-29.
[6]杨婉身,陈惠,王晓丽,等.酸铝对杉木磷吸收和代谢的影响[J].林业科学,2000,36(3):73-76.
[7]MUKHOPADYAY M,BANTAWA P,DAS A,et al.Changes of growth,photosynthesis and alteration of leaf antioxidative defence system of tea[Camelliasinensis(L.) O. Kuntze] seedlings under aluminum stress[J].Biometals,2012,25(6):1141-1154.
[8]CHEN L S,QI Y P,LIU X H.Effects of aluminum on light energy utilization and photoprotective systems inCitrusleaves[J].Annals of Botany,2005,96(1):35-41.
[9]STEINER K C,BARBOUR J R,MCCORMI L H.Res-ponse ofPopulushybrids to aluminum toxicity[J].Forest Sci,1984,30:404-410.
[10]ERNEST S,DHIRAJ N,JONATHAN R C.Genotypic variation in aluminum resistance,cellular aluminum fractions,callose and pectin formation and organic acid accumulation in roots ofPopulushybrids[J].Environmental and Experimental Botany,2011,72(2):182-193.
[11]钱莲文,龚吉蕊,孙境蔚.铝胁迫对常绿杨幼苗光系统Ⅱ的影响[J].北京师范大学学报(自然科学版),2015,51(3):261-266.
[12]钱莲文,吴文杰,孙境蔚,等.铝胁迫对常绿杨生长及叶肉细胞超微结构的影响[J].林业科学,2016,52(11):39-46.
[13]吴文杰,钱莲文.铝毒对杨树根质体超微形态的影响[J].应用与环境生物学报,2015,21(6):1044-1048.
[14]吴文杰,王文卿,钱莲文,等.铝胁迫对常绿杨叶绿素荧光和叶绿体超微结构的影响[J].厦门大学学报(自然科学版),2015,54(1):52-58.
[15]MA J F.Role of organic acids in detoxification of aluminum in higher plants[J].Plant Cell Physiology,2000,41(4):383-390.
[16]MATSUMOTO H.Metabolism of organic acids and metal tolerance in plants exposed to aluminum[M]∥PRASAD M N V,STRZALKA K.Physiology and biochemistry of metal toxicity and tole-rance in plants.Netherlands:Springer,2002:95-109.
[17]王芳,黄朝表,刘鹏,等.铝对荞麦和金荞麦根系分泌物的影响[J].水土保持学报,2005,19(2):106-109.
[18]杨梅,黄寿先,方升佐,等.酸铝胁迫下4个速生桉优良无性系的生长反应[J].植物营养与肥料学报,2001,17(1):195-201.
[19]肖祥希.龙眼幼苗铝吸收特性的研究[J].林业科学,2005,41(3):43-47.
[20]LU H L,YAN C L,LIU J C.Low-molecular-weight organic acids exuded by mangrove (Kandeliacandel(L.) Druce) roots and their effect on cadmium species change in the rhizosphere[J].Environmental & Experimental Botany,2007,61(2):159-166.
[21]CAWTHRAY G R.An improved reversed-phase liquid chromatographic method for the analysis of low-molecular mass organic acids in plant root exudates[J].Journal of Chromatography A,2003,1011(1/2):233-240.
[22]CHEN Z L,TANG C,YU J C.Simultaneous determination of inorganic anions and organic acids in environmental samples by capillary zone electrophoresis with indirect UV detection[J].Journal of Separation Science,2015,22(7):379-385.
[23]QIU J.Statistics aided optimization for high-performance liquid chromatographic analysis of organic acids in tobacco[J].Journal of Chromatography A,1999,859(2):153-158.
[24]万泉.铝胁迫对龙眼幼苗根区分泌物的影响[J].林业科学,2007,43(11):21-26.
[25]SAMUELS T D,KUCUKAKYUZ K,MAGALY R Z.Al partitioning patterns and root growth as related to Al sensitivity and Al tolerance in wheat[J].Plant Physiology,1997,113(2):527-534.
[26]杨小弟,章福平,王先龙,等.环境与生物体系中铝形态分析技术的新进展[J].分析化学,2003,31(9):1131-1138.
[27]田聪,张烁,粟畅,等.铝胁迫下大豆根系有机酸积累的特性[J].大豆科学,2017,36(2):256-261.
[28]朱建华,耿明建,曹享云,等.硼对棉花不同品种根系吸收活力、根系分泌物和伤流液组分的影响[J].棉花学报,2001,13(3):142-145.
[29]张强,陈明昌,程滨,等.植物与土壤的氨基酸营养研究进展[J].山西农业科学,2001,29(1):42-44.
[30]PHILLIPS D A,FOX T C,KING M D,et a1.Microbial products trigger amino acid exudation from plant roots[J].Plant Physiology,2004,136(1):2887-2894.
[31]吴佳,涂书新.植物根系分泌物对污染胁迫响应的研究进展[J].核农学报,2010,24(6):1320-1327.
[32]杨列耿,杨曙,张永先,等.铝离子胁迫下大豆根尖柠檬酸的分泌及SGA1基因的表达[J].作物学报,2015,41(4):666-670.
[33]吴柳杰,张永先,凌桂芝,等.铝胁迫下黑麦和小麦根尖分泌有机酸的研究[J].广西植物,2014,34(4):455-459.
[34]高小凤,郭添香,唐新莲,等.铝胁迫诱导根系分泌异羟肟酸及其对玉米抵御铝毒害的作用[J].中国农业科学,2016,49(11):2063-2071.
[35]刘腾腾,郜红建,宛晓春,等.铝对茶树根细胞膜透性和根系分泌有机酸的影响[J].茶叶科学,2011,31(5):458-462.
[36]王水良,王平,王趁义.铝胁迫下马尾松幼苗有机酸分泌和根际pH值的变化[J].生态与农村环境学报,2010,26(1):87-91.
[37]徐根娣,金婷婷,刘鹏,等.铝胁迫下大豆根系分泌有机酸和氨基酸的特性[J].生态环境,2008,17(3):1204-1209.
