N-苯基富勒烯吡咯烷的合成及其光伏性能
2018-04-11鲁旭斋李姝慧湛新星邓林龙谢素原黄荣彬郑兰荪
鲁旭斋,李姝慧,湛新星,王 坦,邓林龙,谢素原,黄荣彬,郑兰荪
(1.厦门大学 化学化工学院,固体表面物理化学国家重点实验室,2.厦门大学萨本栋微米纳米科学技术研究院,福建 厦门 361005)
聚合物太阳能电池因具有加工工艺简单、成本低、质量轻、可制成柔性器件等优点[1-3]而备受研究人员关注.目前,聚合物太阳能电池的最高能量转换效率已达12.2%[4],其研究主要集中在聚合物给体材料,而针对电子受体材料的研究则相对较少[5].目前,聚合物太阳能电池常用的电子受体材料主要是C60的衍生物[6,6]-苯基-C61-丁酸甲酯(PC61BM)[6]以及相应的C70的衍生物PC71BM[7].尽管PC61BM和PC71BM的光伏性能优异,但仍存在可见光区吸收不足、最低未占分子轨道(LUMO)能级较低、成本高等问题.为了进一步提高聚合物太阳能电池的能量转换效率和降低成本,需要开发高效率低成本的新型电子受体材料.
目前,PC61BM 基本采用以C60、4-苯甲酰基丁酸和对甲苯磺酰肼为原料,通过多步反应合成的方法[8].该方法步骤多且整体产率不高,导致PC61BM价格昂贵.因此,开发合成路线简单且光伏性能和PC61BM接近的新型富勒烯受体材料,可以有效地降低富勒烯受体材料的成本,有利于聚合物太阳能电池的商业化.
富勒烯吡咯烷是一种常见的富勒烯衍生物,它是通过富勒烯与亚胺叶立德的1,3-偶极环加成反应(Prato反应[9])合成的.此类化学反应的特点是:可得到单取代的[6,6]闭环产物,反应所需前驱体大多可通过商业途径获得或易于制备,两种取代基可同时引入吡咯环中以获得结构丰富的化合物[10-15].富勒烯吡咯烷衍生物具有电荷传输特性良好、电子亲和性高、合成分离简单、易于进行化学修饰、化学稳定性高等特点[16-19],因此,人们合成了大量的富勒烯吡咯烷衍生物[20],并研究其在聚合物太阳能电池中的应用.
以聚(3-己基噻吩)(P3HT)为给体,富勒烯吡咯烷衍生物为受体的聚合物太阳能电池的能量转换效率大多不高,基本在3%以下[20].虽然有少数富勒烯吡咯烷衍生物的效率超过3%[21-22],但其合成所需的前驱体较为复杂,导致成本较高.本研究以结构简单、成本较低的N-苯基甘氨酸和甲氧基取代的苯甲醛为前驱体,采用一锅法合成得到C60的N-苯基富勒烯吡咯烷衍生物,对其结构进行表征;并进一步研究了以P3HT为给体,N-苯基富勒烯吡咯烷衍生物为受体的聚合物太阳能电池的光伏性能.
1 实验部分
1.1 试 剂
氧化铟锡(ITO)导电玻璃,深圳南玻显示器件科技有限公司;P3HT和聚(3,4-乙烯二氧噻吩)∶聚苯乙烯磺酸盐(PEDOT∶PSS),上海翰丰化工科技有限公司;C60,濮阳市永新富勒烯科技有限公司;N-苯基甘氨酸、2-甲氧基苯甲醛、3-甲氧基苯甲醛、4-甲氧基苯甲醛、二异丙氧基双乙酰丙酮钛(TIPD),阿法埃莎(中国)化学有限公司;甲苯、丙酮、异丙醇、1,2-二氯苯、乙腈,国药集团化学试剂有限公司.所用试剂均为分析纯.
1.2 仪 器

图1 富勒烯吡咯烷衍生物的合成路线Fig.1 Synthetic route for fulleropyrrolidine derivatives
核磁共振(NMR)波谱:采用Bruker AV400型和AV500型NMR仪,氘代试剂为含有内标四甲基硅烷(TMS)的氘代三氯甲烷(CDCl3).质谱(MS):采用Bruker Esquire HCT 型MS仪,电离源为大气压化学电离源(APCI),负离子模式检测.紫外-可见吸收光谱:采用Varian Cary 5000 UV-Vis-NIR分光光度计,溶剂为甲苯,扫描波长范围为200~1 100 nm.
循环伏安曲线测试:采用CHI-660C型电化学工作站;以Pt电极作为工作电极,Pt丝作为对电极,Ag/Ag+电极(0.01 mol/L硝酸银,0.09 mol/L六氟磷酸四丁铵的乙腈溶液)作为参比电极;在浓度为0.1 mol/L 六氟磷酸四丁铵的1,2-二氯苯/乙腈(体积比5∶1)溶液中进行测试,扫描速率为100 mV/s.
1.3 富勒烯吡咯烷衍生物的合成与表征
采用一锅法合成富勒烯吡咯烷衍生物,合成路线如图1所示:将C60(102 mg,0.14 mmol)、N-苯基甘氨酸(87 mg,0.56 mmol)和甲氧基苯甲醛(78 mg,0.56 mmol)溶于100 mL无水甲苯,在氮气保护下于115 ℃加热回流12 h.反应液浓缩后用硅胶柱色谱分离,洗脱剂为甲苯/石油醚.各化合物的命名如下:N-苯基-2-(2-甲氧基苯基)[60]富勒烯吡咯烷(FP1),N-苯基2-(3-甲氧基苯基)[60]富勒烯吡咯烷(FP2),N-苯基2-(4-甲氧基苯基)[60]富勒烯吡咯烷(FP3).
1.3.1FP1的表征
最后得到黑褐色固体26 mg,产率20% (以C60的量为基准,下同),纯度99%.1H-NMR (500 MHz,CDCl3/CS2)δ7.74 (dd,J=7.7,1.6 Hz,1H),7.38~7.20 (m,5H),7.01 (t,J=6.8 Hz,1H),6.92 (m,2H),6.82 (s,1H),5.67 (d,J=9.9 Hz,1H),5.17 (d,J=9.9 Hz,1H),3.78 (s,3H).13C-NMR (125 MHz,CDCl3/CS2)δ157.30,153.66,147.45,147.39,146.36,146.30,146.25,146.12,146.09,146.07,146.02,145.72,145.60,145.51,145.34,145.28,145.17,144.59,144.52,143.11,142.70,142.64,142.40,142.25,142.22,142.12,142.09,141.91,141.83,141.70,141.65,140.36,140.24,136.50,136.33,129.27,126.95,121.29,119.88,110.84,68.71,55.13.采用APCI-MS测得[M]-的m/z=945.4(计算值为945.1).
1.3.2FP2的表征
最后得到黑褐色固体64 mg,产率48%,纯度99%.1H-NMR (400 MHz,CDCl3)δ7.43~7.33 (m,7H),7.07 (m,1H),6.79 (d,J=8.2 Hz,1H),6.05 (s,1H),5.68 (d,J=9.9 Hz,1H),5.00 (d,J=10.0 Hz,1H),3.74 (s,3H).13C-NMR(100 MHz,CDCl3)δ159.83,155.82,153.81,153.45,153.30,147.37,146.72,146.37,146.27,146.23,146.16,146.11,146.04,145.98,145.73,145.62,145.58,145.46,145.28,145.15,144.70,144.61,144.45,143.17,143.03,142.71,142.61,142.24,142.16,142.12,142.06,141.91,141.82,141.72,141.59,140.28,140.17,139.84,139.44,139.39,136.55,136.40,135.74,135.66,129.86,129.71,129.18,128.60,126.42,122.32,121.26,121.11,114.37,113.58,76.51,68.46,68.16,55.33.采用APCI-MS测得[M]-的m/z=945.3(计算值为945.1).
1.3.3FP3的表征
最后得到黑褐色固体66 mg,产率50%,纯度99%.1H-NMR (500 MHz,CDCl3)δ7.70 (m,2H),7.36 (m,4H),7.07 (m,1H),6.87 (m,2H),6.04 (s,1H),5.66 (d,J=9.9 Hz,1H),4.98 (d,J=9.9 Hz,1H),3.76 (s,3H).13C-NMR (125 MHz,CDCl3)δ159.28,156.06,153.84,153.67,153.52,147.42,146.69,146.40,146.32,146.25,146.19,146.14,145.99,145.76,145.60,145.49,145.30,145.17,144.73,144.66,144.48,143.20,143.05,142.73,142.63,142.32,142.28,142.18,142.15,142.08,141.96,141.86,141.74,141.59,140.29,140.18,139.94,139.51,136.59,136.53,135.75,129.78,129.14,122.36,121.61,114.18,100.00,76.20,68.60,68.12,55.15.采用APCI-MS测得[M]-的m/z=945.6 (计算值为945.1).
FP1~FP3均易溶于甲苯、氯苯、1,2-二氯苯、三氯甲烷、二氯甲烷、二硫化碳等有机溶剂,溶解度大小为FP3≈FP2>FP1.
1.4 器件的制备与测试

图2 体异质结型聚合物太阳能电池的结构Fig.2 Device structure of bulk-heterojunction polymer solar cells
聚合物太阳能电池的器件结构为ITO/PEDOT∶PSS/P3HT∶fullerene/Ca/Al,如图2所示.将刻蚀好的ITO导电玻璃(方块电阻为15 Ω/□)分别用洗液、去离子水、丙酮、异丙醇超声清洗15 min后,用电吹风吹干,放入烘箱在150 ℃下处理5 min.放入紫外臭氧清洗器中处理15 min,然后在ITO表面旋涂一层 PEDOT∶PSS,放入烘箱中在150 ℃下处理15 min,再放入手套箱中旋涂活性层.事先将一定比例的P3HT和富勒烯衍生物溶于1,2-二氯苯中,以合适的转速旋涂于PEDOT∶PSS上面,溶剂退火约2 h,之后在加热板上于150 ℃下退火15 min.再刮掉部分活性层,露出ITO作为公共电极,然后放入真空镀膜机,于约2×10-4Pa下在活性层上蒸镀一层20 nm厚的金属Ca和60 nm厚的金属Al.
聚合物太阳能电池的测试在手套箱中进行,光伏性能表征在AM 1.5G太阳光模拟器(100 mW/cm2)下进行,电流-电压特性使用Kiethley2420电流源计测试.电池的外量子效率在Merlin(Oriel)型测试仪上进行,测试系统由光源、单色器、锁相放大器及探测器等部分组成,每个波长的光强通过标准单晶硅光伏电池校正.电子迁移率测试所采用的器件结构为ITO/TiO2/P3HT∶fullerene/Ca/Al,其制备过程与聚合物太阳能电池的制备过程基本一致,电子迁移率的计算采用空间电荷限制电流方法[23-24].
2 结果与讨论
2.1 富勒烯吡咯烷衍生物的合成
本研究利用Prato反应[9],通过一步反应即可得到富勒烯吡咯烷衍生物FP1~FP3,用硅胶柱为分离载体对反应混合物进行纯化,获得纯度约为99%的目标产物.通过1H-NMR、13C-NMR、APCI-MS等测试手段对FP1~FP3的结构进行了表征,证明其为目标产物.实验结果表明,FP1的产率(20%)较低,低于文献报道的PC61BM的产率(35%,以C60的量为基准)[8].相比之下,FP2和FP3的产率显著提升,达到50%左右,明显高于PC61BM的产率;且FP2和FP3的合成步骤只有1步,而PC61BM的合成步骤有4步.尽管FP1~FP3的结构比较接近,但产率并不相同.从反应机理上分析,C60和甲氧基取代的苯甲醛、N-苯基甘氨酸发生的是[2+3]环加成反应:1) 甲氧基取代的苯甲醛与N-苯基甘氨酸在加热条件下反应生成1,3-偶极子中间体亚胺叶立德,2) 亚胺叶立德再与C60发生[2+3]环加成反应得到目标产物.因此,FP1~FP3的产率不同可能与反应中间形成的亚胺叶立德的量有一定关系.在实验中发现FP1的反应混合物中含有大量的双加成产物,导致FP1的产率不高,这可能是由于反应中间形成的亚胺叶立德的量较大,导致FP1进一步反应,生成了双加成产物.而FP2和FP3在反应中间形成的亚胺叶立德的量比较合适,主要生成单加成产物,因此产率较高.
2.2 富勒烯吡咯烷衍生物的紫外-可见吸收光谱
富勒烯吡咯烷衍生物FP1~FP3在甲苯中的紫外-可见吸收光谱如图3所示:FP1~FP3的谱图非常相似,这是因为它们的分子结构非常相似;FP1~FP3和PC61BM在300~400 nm都有明显的吸收,这主要是由碳笼的π-π*电子跃迁决定的;FP1~FP3在433和704 nm有2个相对较弱的特征吸收峰,这表明它们是在富勒烯碳笼上进行[6,6]加成得到的产物[25-26];在400~490 nm的可见光范围内,FP1~FP3的吸收均比PC61BM要强些.

图3 FP1~FP3和PC61BM在甲苯溶液中的紫外-可见吸收光谱Fig.3 UV-Vis absorption spectra of FP1-FP3 and PC61BM in toluene solutions
2.3 富勒烯吡咯烷衍生物的电化学性能
在室温下,以1,2-二氯苯/乙腈(体积比5∶1)作溶剂,六氟磷酸四丁铵作电解质,在氮气保护下测定富勒烯吡咯烷衍生物的循环伏安特性.FP1~FP3的循环伏安曲线如图4所示,其相应的还原电位、起始还原电位和LUMO能级列于表1.可以看出,FP1~FP3的循环伏安曲线非常相似,在0~-2.2 V的扫描范围内,FP1~FP3均出现3对可逆的氧化还原峰.与PC61BM相比,FP1~FP3的第一还原电位(E1)、第二还原电位(E2)和第三还原电位(E3)均往负方向有小幅的移动.PC61BM和FP1~FP3的起始还原电位分别为-0.80,-0.84,-0.82,-0.82 V,相应的LUMO能级分别为-3.91,-3.87,-3.89,-3.89 eV.FP1的LUMO能级比FP2、FP3和PC61BM的高,由此推测基于FP1的器件具有较高的开路电压.

图4 FP1~FP3和PC61BM的循环伏安图Fig.4 Cyclic voltammograms of FP1-FP3 and PC61BM

化合物E1/VE2/VE3/VEredon/VLUMO/eVPC61BM-0.89-1.31-1.82-0.80-3.91FP1-0.93-1.33-1.88-0.84-3.87FP2-0.92-1.33-1.87-0.82-3.89FP3-0.91-1.32-1.87-0.82-3.89
注:LUMO=-e (Eredon+4.71),式中,e是电子,Eredon是相对于Ag/Ag+电极的起始还原电位值[27].E1、E2、E3分别为第一、第二、第三还原电位.
2.4 富勒烯吡咯烷衍生物的光伏性能
对采用P3HT为给体,FP1~FP3和PC61BM为受体的聚合物太阳能电池的光伏性能进行了测试和比较,电池的电流密度-电压曲线如图5所示,相应的光伏性能数据列于表2.
由表2可知:FP1器件的开路电压比FP2、FP3以及PC61BM的高,这与FP1的LUMO能级较高相符;但FP1~FP3器件的短路电流密度均比PC61BM的低.FP1器件的填充因子比PC61BM的低,这使得它的能量转换效率比PC61BM的低;而FP2和FP3器件的填充因子分别是65.76%和64.20%,与PC61BM的比较接近,故它们的能量转换效率跟PC61BM接近,也与文献报道的P3HT∶PC61BM器件的能量转换效率(3.4%~3.88%)[28-30]差别不大.FP2和FP3器件的能量转换效率要显著高于FP1,说明不同位置的取代基对器件的光伏性能有显著影响,特定位置的甲氧基取代的N-苯基富勒烯吡咯烷衍生物具有更好的光伏性能.值得注意的是,文献[20]报道的以C60吡咯烷衍生物作为电子受体的聚合物太阳能电池的能量转换效率不高,但本研究所合成的3个富勒烯吡咯烷衍生物却具有较高的能量转换效率,这可以从分子结构与能级进行解释.从分子结构上看,文献[21-22,31-32]报道的C60吡咯烷衍生物大多在吡咯环的氮上连接的是烷基链,而本研究合成的则连接的是苯基.由于苯基具有π电子,能够与相邻的C60吡咯烷分子上的碳笼之间形成π-π作用,因此,N-苯基的引入,使得C60吡咯烷分子之间的π-π作用力增强,有利于获得较高的电子迁移率,提高器件的填充因子和能量转换效率.从能级上看,FP1~FP3的LUMO能级略高于PC61BM,因而具有较高的开路电压,这也有利于器件能量转换效率的提高.

图5 以P3HT为给体,富勒烯衍生物为受体的聚合物太阳能电池的电流密度-电压曲线Fig.5 Current density-voltage curves of polymer solar cells with P3HT as donor and fullerene derivative as acceptor
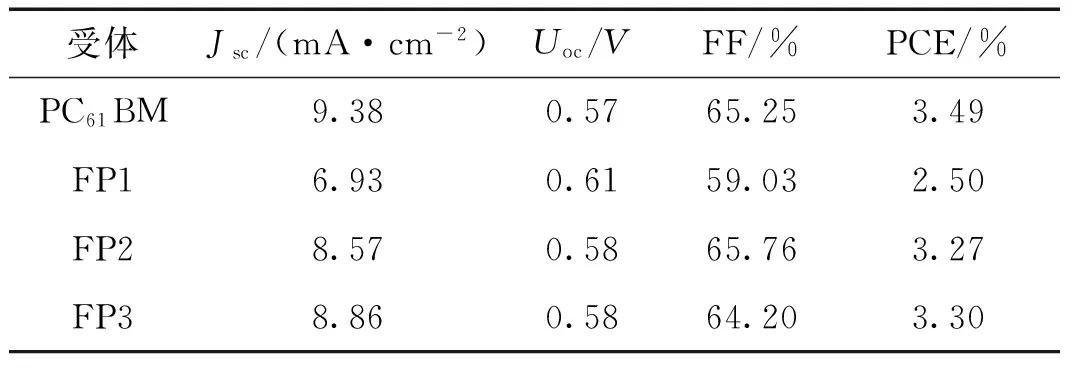
受体Jsc/(mA·cm-2)Uoc/VFF/%PCE/%PC61BM9.380.5765.253.49FP16.930.6159.032.50FP28.570.5865.763.27FP38.860.5864.203.30
注:Jsc为短路电流密度,Uoc为开路电压,FF为填充因子,PCE为能量转换效率.
以P3HT为给体,富勒烯衍生物为受体的聚合物太阳能电池的外量子效率如图6所示.FP1~FP3和PC61BM在约530 nm处的外量子效率分别为29.0%,40.3%,42.7%,48.8%.FP1的外量子效率较低,与它的短路电流密度较小相符.FP1~FP3在约530 nm处的外量子效率均小于PC61BM,故它们的短路电流密度都比PC61BM的要小.

图6 以P3HT为给体,富勒烯衍生物为受体的聚合物太阳能电池的外量子效率Fig.6 External quantum efficiencies of polymer solar cells with P3HT as donor and fullerene derivative as acceptor
2.5 富勒烯吡咯烷衍生物的电子迁移率

U-Ubl表示有效电压,其中U为外加电压,Ubl为建电场电压.图7 暗态条件下测得的P3HT∶fullerene电子传输型器件的空间电荷限制电流密度-电压特性曲线Fig.7 Measured space-charge limited current density-voltage characteristics of the P3HT∶fullerene devices under dark conditions for electron-only devices
为进一步阐明影响器件能量转换效率高低的因素,在暗态下测试P3HT∶fullerene的电流密度-电压曲线(图7)以得到P3HT∶fullerene共混膜的电子迁移率.实验测得P3HT∶PC61BM、P3HT∶FP1、P3HT∶FP2和P3HT∶FP3膜的电子迁移率分别为1.1×10-3,6.3×10-4,8.9×10-4,8.1×10-4cm2/(V·s).其中,P3HT∶FP2和P3HT∶FP3膜的电子迁移率与P3HT∶PC61BM膜接近,这可能与N-苯基的引入增强了富勒烯吡咯烷分子间的相互作用有关;而P3HT∶FP1膜的电子迁移率要明显小于P3HT∶PC61BM膜的电子迁移率,导致P3HT∶FP1器件的填充因子较低,影响了器件的能量转换效率.
3 结 论
本研究利用一锅法制备了3种N-苯基取代的富勒烯吡咯烷衍生物FP1~FP3,并利用1H-NMR、13C-NMR、APCI-MS对其进行表征.实验结果表明,FP1的产率(20%)较低,而FP2和FP3的产率较高,达到50%左右,明显高于文献[8]报道的PC61BM的产率(35%).FP1~FP3的紫外-可见吸收光谱非常相似,表明吡咯环上的取代基团对富勒烯吡咯烷衍生物的吸收光谱影响较小.循环伏安测试表明FP1~FP3的电化学性质非常相似,其LUMO能级与PC61BM相差不大.在研究以P3HT为给体,富勒烯吡咯烷衍生物为受体的聚合物太阳能电池的光伏性能时发现,不同位置的取代基对器件的光伏性能有显著影响,特定位置的甲氧基取代的聚合物太阳能电池器件具有更好的光伏性能.制备的P3HT∶FP2和P3HT∶FP3器件的能量转换效率分别达到3.27%和3.30%,已经达到文献[20]报道的以P3HT为给体,富勒烯吡咯烷衍生物为受体的器件的最高能量转换效率(3.19%),并且接近相同条件下本实验室制备的P3HT∶PC61BM的能量转换效率以及文献[28-30]报道的P3HT∶PC61BM器件的效率.这说明N-苯基富勒烯吡咯烷衍生物受体材料具有良好的光伏性能,并为以后研究高性能的富勒烯受体材料奠定了基础.
参考文献:
[1]BRABEC C J.Organic photovoltaics:technology and market[J].Sol Energy Mater Sol Cells,2004,83(2/3):273-292.
[2]ETXEBARRIA I,AJURIA J,PACIOS R.Solution-processable polymeric solar cells:a review on materials,strategies and cell architectures to overcome 10%[J].Org Electron,2015,19:34-60.
[3]SUN Y Y,ZHANG W H,CHI H J,et al.Recent development of graphene materials applied in polymer solar cell[J].Renewable Sustainable Energy Reviews,2015,43:973-980.
[4]ZHAO W C,LI S S,ZHANG S Q,et al.Ternary polymer solar cells based on two acceptors and one donor for achieving 12.2% efficiency[J].Adv Mater,2017,29(2):1604059.
[5]HE Y J,LI Y F.Fullerene derivative acceptors for high performance polymer solar cells[J].Phys Chem Chem Phys,2011,13(6):1970-1983.
[6]YU G,GAO J,HUMMELEN J C,et al.Polymer photovoltaic cells:enhanced efficiencies via a network of internal donor-acceptor heterojunctions[J].Science,1995,270(5243):1789-1791.
[7]WIENK M M,KROON J M,VERHEES W J,et al.Efficient methano [70] fullerene/MDMO-PPV bulk heterojunction photovoltaic cells[J].Angew Chem Int Ed,2003,42(29):3371-3375.
[8]HUMMELEN J C,KNIGHT B W,LEPEQ F,et al.Preparation and characterization of fulleroid and methanoful1lerene derivatives[J].J Org Chem,1995,60(3):532-538.
[9]MAGGINI M,SCORRANO G,PRATO M.Addition of azomethine ylides to C60:synthesis,characterization,and functionalization of fullerene pyrrolidines[J].J Am Chem Soc,1993,115(21):9798-9799.
[10]DELGADO J L,MARTIN N,DE LA CRUZ P,et al.Pyrazolinofullerenes:a less known type of highly versatile fullerene derivatives[J].Chem Soc Rev,2011,40(11):5232-5241.
[11]PRATO M,MAGGINI M.Fulleropyrrolidines:a family of full-fledged fullerene derivatives[J].Acc Chem Res,1998,31(9):519-526.
[12]TAGMATARCHIS N,PRATO M.The addition of azomethine ylides to [60] fullerene leading to fulleropyrrolidines[J].Synlett,2003(6):768-779.
[13]MATEO-ALONSO A,ILIOPOULOS K,COURIS S,et al.Efficient modulation of the third order nonlinear optical properties of fullerene derivatives[J].J Am Chem Soc,2008,130(5):1534-1535.
[14]GOURNIS D,JANKOVIC L,MACCALLINI E,et al.Clay-fulleropyrrolidine nanocomposites[J].J Am Chem Soc,2006,128(18):6154-6163.
[15]KHARISOV B I,KHARISSOVA O V,GOMEZ M J,et al.Recent advances in the synthesis,characterization,and applications of fulleropyrrolidines[J].Ind Eng Chem Res,2009,48(2):545-571.
[16]ZENG H P,WANG T,SANDANAYAKA A S,et al.Photoinduced charge separation and charge recombination in [60]fullerene-ethylcarbazole and [60]fullerene-triphenylamines in polar solvents[J].J Phys Chem A,2005,109(21):4713-4720.
[17]SEGURA J L,PRIEGO E M,MARTIN N,et al.A new photoactive and highly soluble C60-TTF-C60dimer:charge separation and recombination[J].Org Lett,2000,2(25):4021-4024.
[18]POSSAMAI G,MARCUZ S,MAGGINI M,et al.Synthesis,photophysics and photoresponse of fullerene-based azoaromatic dyads[J].Chemistry,2005,11(19):5765-5776.
[19]BLANCO G D,HILTUNEN A J,LIM G N,et al.Syntheses,charge separation,and inverted bulk heterojunction solar cell application of phenothiazine-fullerene dyads[J].ACS Appl Mater Interfaces,2016,8(13):8481-8490.
[20]GANESAMOORTHY R,SATHIYAN G,SAKTHIVEL P.Review:fullerene based acceptors for efficient bulk heterojunction organic solar cell applications[J].Sol Energy Mater Sol Cells,2017,161:102-148.
[21]MATSUMOTO K,HASHIMOTO K,KAMO M,et al.Design of fulleropyrrolidine derivatives as an acceptor molecule in a thin layer organic solar cell[J].J Mater Chem,2010,20(41):9226-9230.
[22]ZHANG X N,SUN L,ZHENG W,et al.The preparation and properties of bulk-heterojunction organic solar cells with indole-containing fulleropyrrolidine derivatives as acceptors[J].Tetrahedron,2013,69(46):9544-9550.
[23]NICOLAI H T,WETZELAER G A H,KUIK M,et al.Space-charge-limited hole current in poly(9,9-dioctylfluorene) diodes[J].Appl Phys Lett,2010,96(17):172107.
[24]LENES M,MORANA M,BRABEC C J,et al.Recombination-limited photocurrents in low bandgap polymer/fullerene solar cells[J].Adv Funct Mater,2009,19(7):1106-1111.
[25]MIKROYANNIDIS J A,KABANAKIS A N,SHARMA S S,et al.A simple and effective modification of PCBM for use as an electron acceptor in efficient bulk heterojunction solar cell[J].Adv Funct Mater,2011,21(4):746-755.
[26]KORDATOS K,ROS T D,PRATO M,et al.Absorption spectra of the mono-adduct and eight bis-adduct regio-isomers of pyrrolidine derivatives of C60[J].Chem Phys,2003,293(2):263-280.
[27]SUN Q J,WANG H Q,YANG C H,et al.Synthesis and electroluminescence of novel copolymers containing crown ether spacers[J].J Mater Chem,2003,13(4):800-806.
[28]ROSS R B,CARDONA C M,GULDI D M,et al.Endohedral fullerenes for organic photovoltaic devices[J].Nat Mater,2009,8(3):208-212.
[29]HE Y,CHEN H Y,HOU J,et al.Indene-C60bisadduct:a new acceptor for high-performance polymer solar cells[J].J Am Chem Soc,2010,132(4):1377-1382.
[30]HE Y,ZHAO G,PENG B,et al.High-yield synthesis and electrochemical and photovoltaic properties of indene-C70bisadduct[J].Adv Funct Mater,2010,20(19):3383-3389.
[31]LEE J K,FUJIDA K,TSUTSUI T,et al.Synthesis and photovoltaic properties of soluble fulleropyrrolidine derivatives for organic solar cells[J].Sol Energy Mater Sol Cells,2007,91(10):892-896.
[32]MI D,KIM H U,KIM J H,et al.Synthesis of a soluble fulleropyrrolidine derivative for use as an electron acceptor in bulk-heterojunction polymer solar cells[J].Syn Met,2012,162(5):483-489.
