2株耐铝细菌的脱氮性能研究
2018-04-11王家乐舒垚荣杨雨婷
秦 慧,季 斌,王家乐,舒垚荣,杨雨婷
(武汉科技大学城市建设学院,湖北 武汉 430065)
Al作为地壳中含量最丰富的金属元素,被广泛应用于高品质合金、涂料和电缆等众多消费品中.Al能引起细胞过氧化,低浓度下导致植物细胞程序性死亡,高浓度下引起细胞坏死,从而抑制植物根系生长[1].对于动物而言,长时间暴露于铝胁迫可导致脑衰老与神经退化等疾病[2].低于3 mmol/L的Al3+可抑制大肠杆菌(Escherichiacoli)生长、破坏植物结瘤以及扰乱细菌的光合作用和固氮作用[3].近年来,对荧光假单胞菌(Pseudomonasfluorescens)的耐铝性能[4]研究较深入;Kanazawa等[5]从酸性土壤中分离和鉴定了一批具有耐铝性能的酵母菌及霉菌,对Al3+有着极高的抗性;从土壤中筛选出来的菌株Acidocellaaluminiidurans也被证实有耐铝能力[6].目前大多数耐铝菌株的相关研究是针对土壤中的动、植物或真菌展开的,关于水环境中细菌的耐铝研究相对较少.
污水处理系统中通常添加铝盐来实现化学协同脱氮除磷和强化造粒[7].添加聚合氯化铝(PAC)可以大幅度提高对总磷的去除率[8],同时对化学需氧量(COD)的去除效果也有所改善[9].铝盐的添加可使活性污泥的沉降性能提高,活性降低,微生物种群数量减少[10],且对亚硝化细菌和异养菌的呼吸速率均存在抑制作用[11].高于60 mg/L剂量的明矾对自养细菌具有毒害作用,使氨氧化速率和总凯氏氮去除率显著降低[12].因此,筛选具有脱氮性能的耐铝菌株,研究其在污水处理中的方法与机制具有一定的应用前景.
本研究从湖北省武汉市黄家湖底泥中筛选出2株能耐受20 mmol/L Al3+的细菌,通过生理生化鉴定、扫描电镜(SEM)形态观察和16SrRNA基因序列分析对菌株进行鉴定,进而对其在不同Al3+浓度下的脱氮特性进行了研究,并通过X射线衍射(XRD)分析了Al元素在培养液中的形态分布,以期为这2株耐铝细菌应用于工程实践提供技术支持,为铝盐应用于化学协同脱氮除磷提供理论依据,并为其他耐铝生物脱氮工艺提供一些参考.
1 材料与方法
1.1 菌种来源和培养基
菌种取自湖北省武汉市黄家湖湖泊底泥,采用XDB-15型柱状土壤采样器采样.耐铝菌株的富集培养采用含20 mmol/L Al3+的牛肉膏蛋白胨培养基;分离纯化采用含20 mmol/L Al3+的营养琼脂培养基;耐铝菌株的脱氮性能检测采用改良的反硝化培养基[13],配方如下(g/L):NaAc 4.7,Na2HPO4·7H2O 7.9,KH2PO41.5,NH4Cl 0.3,MgSO4·7H2O 0.1,NaNO30.85和微量元素溶液2.0 mL.其中微量元素溶液的配方为(g/L):乙二胺四乙酸(EDTA)50,ZnSO42.2,CaCl25.5,MnCl2·4H2O 5.1,FeSO4·7H2O 5.0,CuSO4·5H2O 1.6,(NH4)6Mo7O2·4H2O 1.1和CoCl2·6H2O 1.6.
1.2 细菌的富集培养与分离纯化
取2 mL湖泊底泥悬浊液加入到100 mL灭菌的含20 mmol/L Al3+(以Al2(SO4)3·18H2O添加)的牛肉膏蛋白胨培养基,并调节pH值至7.2,在恒温摇床上培养2 d(150 r/min,30 ℃);然后将1 mL富集培养后的菌液接种到新的100 mL灭菌的含20 mmol/L Al3+的牛肉膏蛋白胨培养基中培养2 d,此过程重复3次.吸取100 μL扩大培养后的菌液涂布于灭菌的含20 mmol/L Al3+的营养琼脂培养基平板,将培养皿倒置在30 ℃的恒温培养箱中培养2 d;待菌落长出后,挑取单菌落于灭菌的含20 mmol/L Al3+的营养琼脂培养基平板上划线,直至得到纯化的单菌落.
1.3 菌株生理生化鉴定和形态特征观察
菌株生理生化特性鉴定参照《常见细菌系统鉴定手册》[14]和《伯杰氏细菌鉴定手册》[15]进行,主要包括革兰氏染色、葡萄糖发酵、淀粉水解、接触酶和硝酸盐还原试验.将分离的菌株接种于营养琼脂培养基上,30 ℃培养2 d 后,观察菌落的形状、大小、颜色以及挑起难易程度等,样品经预处理后通过SEM(Nova 400 Nano)观察菌体的形态和大小.样品预处理操作如下:挑取菌落于1 mL离心管中,先用磷酸盐缓冲液(PBS)清洗3次;然后用体积分数为2.5%的戊二醛溶液于4 ℃浸泡过夜,依次用体积分数为50%,70%,80%,90%,95%的乙醇分别浸泡脱水20 min,震荡混匀,保证样品充分与乙醇接触;最后用无水乙醇脱水2次,每次15 min;脱水后的样本常温干燥,经过抽真空喷金后,在场发射SEM下观察.
1.4 16S rRNA基因的系统发育分析
16SrRNA基因的PCR扩增纯化和测序由上海生工生物工程股份有限公司完成,按SK8255(细菌)试剂盒说明书提取基因组DNA,采用2720 Thermal Cycler型PCR仪(Applied Biosystems)进行PCR扩增纯化,然后用1%(质量分数)琼脂糖电泳(150 V,100 mA,20 min)进行检测,最后采用3730XL型测序仪(Applied Biosystems)测序.DNA片段的扩增采用细菌通用引物[16]:正向引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物 806R (5′-GGACTACHVGGGTWTCTAAT-3′).在GenBank数据库中对测序结果进行相关性搜索,用ClustalX 2.1软件进行多序列匹配,采用MEGA 6软件对鉴定的2株耐铝菌株与NCBI数据库(http:∥www.ncbi.nlm.nih.gov/)中已报道的同源菌株及其他耐铝菌株进行系统发育分析,用邻接(N-J)法构建并绘制系统发育树.
1.5 不同Al3+浓度下菌株的脱氮性能研究
设置反硝化培养基中Al3+浓度分别为0,5,10,15 mmol/L,pH=7.2,将1 mL菌液接种于200 mL灭菌的反硝化培养基中,在恒温摇床上培养3 d(150 r/min,30 ℃),测定培养液中总氮(TN)、硝酸盐氮(NO3--N)、氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)的浓度变化.相关测定方法[17]:TN采用碱性过硫酸钾消解法;NO3--N采用紫外分光光度法;NH4+-N采用纳氏试剂光度法;NO2--N采用N-(1-萘基)-乙二胺光度法.每组进行3次平行实验,结果以平均值±标准差表示,比较不同Al3+浓度下菌株的脱氮能力.
1.6 培养液中Al元素的化学形态分析
将在10 mmol/L Al3+条件下培养3 d后的细菌与铝盐形成的絮凝体用超纯水清洗3遍,烘干研磨成粉末,通过XRD(PANalytical X′Pert Pro)分析培养液中Al元素的化学形态.
2 结果与讨论
2.1 菌落形态特征与生理生化特性

图1 Q1(a)和Q3(b)菌株的菌落形态图Fig.1 The colony morphology of Q1 (a) and Q3 (b) strains

图2 Q1(a)和Q3(b)菌株的SEM图Fig.2 SEM micrographs of Q1 (a) and Q3 (b) strains
将富集纯化培养后的Q1和Q3菌株接种于营养琼脂培养基上,30 ℃培养2 d后观察菌落形态特征.如图1所示:Q1形成的菌落为淡黄色,圆形,表面光滑,凝胶状,难挑起;Q3形成的菌落为白色,圆形,边缘不光滑,易挑起.Q1和Q3的场发射SEM图像如图2所示:Q1为短杆状,宽1.2~1.5 μm,长1.5~4.0 μm;Q3为杆状,宽1.0~1.2 μm,长2.5~5.0 μm.2株菌株的生理生化特性试验结果如表1所示.

表1 Q1和Q3菌株的生理生化特性
注:+代表阳性,-代表阴性.
2.2 16S rRNA基因同源性比对及系统发育分析
对筛选出的2株菌株进行16SrRNA基因测序分析,将所得序列通过BLAST检索与GenBank中已知的基因序列进行比对,结果表明:Q1菌株与鞘氨醇杆菌(Sphingobacteriumsp.)B2菌株(JX941542)的相似度最高,Q3菌株与蜡状芽孢杆菌(Bacilluscereus)M15菌株(LN890101)的相似度为99%.Q1和Q3菌株的序列在NCBI数据库中的注册号分别为KY767658和KY767659.采用MEGA 6软件将Q1和Q3菌株与数据库中已报道的同源性菌株以及其他耐铝菌株进行系统发育分析,绘制系统发育树如图3所示.
2.3 不同Al3+浓度下菌株的脱氮性能
考察不同Al3+浓度下2株菌株的脱氮性能,结果如图4所示.
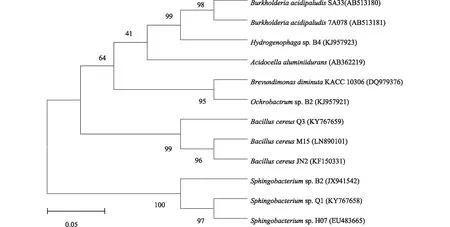
图3 用N-J法构建的基于16S rRNA基因序列的同源性菌株系统发育树Fig.3 N-J phylogenetic tree based on 16S rRNA gene sequences of the homological strains

图4 Q1和Q3菌株在不同Al3+浓度下的脱氮性能Fig.4 Nitrogen removal characteristics of Q1 and Q3 strains under different Al3+concentrations

由图4(e)~(h)可知:Q3在Al3+浓度为0,5,10,15 mmol/L条件下,对TN的去除率分别为44.11%,48.03%,30.42%和25.90%,对NH4+-N的去除率分别为89.51%,91.60%,85.43%和71.26%,较低浓度(5 mmol/L)和较高浓度(10和15 mmol/L)的Al3+相比,Q3对TN和NH4+-N的去除率均存在显著性差异(p<0.05),表现为较低浓度的Al3+对TN和NH4+-N的去除有一定促进作用,而较高浓度的Al3+则起抑制作用;Q3对NO3--N的去除几乎不受Al3+浓度的影响,去除率均在93.03%左右,未出现显著性差异(p>0.05),且均有较多的NO2--N积累,可能是由于Q3缺乏亚硝酸盐还原酶.总体来说,Q3的脱氮性能优于Q1,Al3+对Q1脱氮性能的影响大于Q3,可能是由于蜡状芽孢杆菌Q3的细胞壁较厚可以阻止部分Al3+进入细胞.
上述结果显示Q1和Q3菌株在不同Al3+浓度下均能实现对NO3--N和NH4+-N的去除,随着Al3+浓度升高,Q1对NH4+-N的去除率升高,对NO3--N的去除率降低,Q3对NH4+-N的去除率总体呈下降趋势,而对NO3--N的去除率影响不大.2株菌株都产生NO2--N积累,可考虑与其他反硝化细菌组合使用于短程硝化-反硝化系统中.Patureau等[18]在厌氧与好氧交替的条件下从废水中分离出的S.adnaesiva具有好氧反硝化能力,张艾晓[19]也分离出具有较好脱氮性能的Sphingobacteriumsp. CZ,在初始氮质量浓度为200 mg/L时,能实现对硝氮4.17 mg/(L·h)的去除速度,同时Sphingobacteriumsp.在多环芳烃(PAHs)及六六六(HCH)异构体的降解方面也有独特的优势[20].大部分蜡状芽孢杆菌都具有还原硝酸盐的作用:吴丽红等[21]筛选的B.cereusFC1和FH2,能在NO3--N质量浓度为400 mg/L 的条件下对NO3--N达到100%的去除,在偏碱性环境中生长良好,最适pH值为7.2~8.2;张小玲等[22]发现在温度为30 ℃时,当投菌浓度为2×104cfu/mL(cfu为菌落形成单位)时,Bacillussp. H2在48 h可将反硝化培养基中约140 mg/L的NO2--N完全降解,对TN的降解率达到68.10%;B.cereusHS-N25菌株[23]对人工废水中的NO3--N降解能力较好,在24 h 内降解率达到72.18%,在降解过程中有NO2--N的积累,低于本研究中Q1与Q3菌株在无Al3+条件下的去除率.周迎芹等[24]从污泥中筛选出一株门多萨假单胞菌(P.mendocina)TN-05,能在48 h内达到95%的NH4+-N去除率,略高于本研究中的Q1与Q3菌株.此外,本研究Q3对NO3--N的去除不受Al3+浓度的影响,约为93.03%,优于具有耐铝性能的噬氢菌(Hydro-genophagasp. B4)在36 h内对NO3--N达到76.8%的去除率[13].综上可见Q1和Q3菌株在处理污水方面有较好的应用前景.
2.4 培养液中Al元素的化学分布形态
通过XRD分析,确定Q1和Q3菌株培养液中Al元素的化学形态,所得谱图如图5所示.结果表明Q1中Al元素存在的主要形态为CaAl2Si2O8·4H2O和(Mg,Fe,Al)3-x(AlSiO5)(OH)4-2x,Q3中Al元素存在的主要形态为Al4(SO4)(OH)10·36H2O和Al0.47Si0.15P0.38O2.
Mg和Fe元素是细胞内辅酶的重要组成成分,Q1培养液中Al元素部分以(Mg,Fe,Al)3-x(AlSiO5)(OH)4-2x的形态存在,而正常情况下Al与Mg、Fe元素不易结合在一起,说明Al元素可以取代细菌所需的微量元素;而Q3具有较厚的细胞壁可以阻止部分Al元素的入侵.由于Al与腺苷三磷酸的结合能力比Mg高107倍,Al会取代Fe使得涉及柠檬酸循环和氧化磷酸化的多种酶活性降低[10],从而导致TN、NO3--N和NH4+-N的去除率降低.
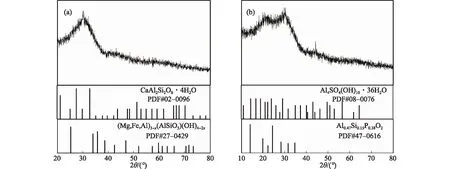
图5 Q1(a)和Q3(b)菌株培养液中Al元素化学形态的XRD谱图Fig.5 XRD diagrams of the chemical forms of aluminum in the culture media of Q1 (a) and Q3 (b) strains
3 结 论
1) 本研究中分离培养获得2株具有脱氮性能的耐铝菌株Q1和Q3.经生理生化鉴定、SEM形态观察和16SrRNA基因测序,确定菌株Q1为鞘氨醇杆菌(Sphingobacteriumsp.),Q3为蜡状芽孢杆菌(Bacilluscereus).
2) 分离得到2株菌株均能在20 mmol/L Al3+浓度下生长,且在15 mmol/L Al3+浓度下脱氮性能良好;但2株菌株的脱氮性能受Al3+的影响有一定差异,15 mmol/L Al3+对Q1的硝氮去除作用产生明显抑制而对Q3基本无影响.
3) XRD结果表明Q1中Al元素存在的主要形态为CaAl2Si2O8·4H2O和(Mg,Fe,Al)3-x(AlSiO5)(OH)4-2x,Q3中Al元素的存在的主要形态为Al4(SO4)(OH)10·36H2O和Al0.47Si0.15P0.38O2,说明部分Al元素可能通过取代细菌所需的部分微量元素进而影响菌株的脱氮性能.
.
参考文献:
[1]PAN J,ZHU M,CHEN H.Aluminum-induced cell death in root-tip cells of barley[J].Environmental & Experimental Botany,2001,46(1):71-79.
[2]BONDY S C.Prolonged exposure to low levels of aluminum leads to changes associated with brain aging and neurodegeneration[J].Toxicology,2014,315(1):1-7.
[3]AUGER C,HAN S,APPANNA V P,et al.Metabolic reengineering invoked by microbial systems to decontaminate aluminum:implications for bioremediation technologies[J].Biotechnology Advances,2013,31(2):266-273.
[4]LEMIRE J,MAILLOUX R,AUGER C,et al.Pseudomonasfluorescensorchestrates a fine metabolic-balancing act to counter aluminium toxicity[J].Environmental Microbiology,2010,12(6):1384-1390.
[5]KANAZAWA S,CHAU N T T,MIYAKI S.Identification and characterization of high acid tolerant and aluminum resistant yeasts isolated from tea soils[J].Soil Science & Plant Nutrition,2005,51(5):671-674.
[6]KUNITO T,OWAKI M,IHYO Y,et al.GeneraBurkholderiaandLipomycesare predominant aluminum-resistant microorganisms isolated from acidic forest soils using cycloheximide-amended growth media[J].Annals of Microbiology,2012,62(3):1339-1344.
[7]时文歆,王硕,于水利,等.铝离子对低温好氧颗粒污泥颗粒化的强化作用[J].同济大学学报(自然科学版),2012,40(11):1686-1690.
[8]JI B,YANG K,WANG H.Impacts of poly-aluminum chloride addition on activated sludge and the treatment efficiency of SBR[J].Desalination & Water Treatment,2015,54(9):2376-2381.
[9]柯水洲,涂家勇,朱佳,等.聚合铝水解形态对混凝效果及絮体特性的影响[J].环境工程学报,2017,11(2):733-738.
[10]季斌,陈威,樊杰,等.铝盐应用于污水生物化学协同除磷研究进展[J].现代化工,2017,37(5):30-32.
[11]侯艳玲,刘艳臣,邱勇,等.化学除磷药剂中三价铁铝对生物系统污泥活性影响的研究[J].给水排水,2010,36(6):38-41.
[12]ZAHID W M,EL-SHAFAI S A.Impacts of alum addition on the treatment efficiency of cloth-media MBR[J].Desalination,2012,301:53-58.
[13]JI B,CHEN W,ZHU L,et al.Isolation of aluminum-to-lerant bacteria capable of nitrogen removal in activated sludge.[J].Marine Pollution Bulletin,2016,106(1/2):31-34.
[14]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-373.
[15]布坎南 R E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:729-758.
[16]KUMAR P S,BROOKER M R,DOWD S E,et al.Target region selection is a critical determinant of community fingerprints generated by 16S pyrosequencing[J].PLoS One,2011,6(6):e20956.
[17]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:254-284.
[18]PATUREAU D,ZUMSTEIN E,DELGENES J P,et al.Aerobic denitrifiers isolated from diverse natural and managed ecosystems[J].Microbial Ecology,2000,39(2):145-152.
[19]张艾晓.脱氮细菌混合去除水相氮污染的条件与机理[D].杭州:浙江工业大学,2009:29-30.
[20]胡杰,何晓红,李大平,等.鞘氨醇单胞菌研究进展[J].应用与环境生物学报,2007,13(3):431-437.
[21]吴丽红,李晓惠,杨芳,等.蜡状芽孢杆菌生物强化反硝化脱氮研究[J].中国给水排水,2016,32(3):89-92,96.
[22]张小玲,张霞.好氧反硝化菌Bacillussp. H2脱氮特性研究[J].环境科学与技术,2011,34(10):53-57.
[23]杨希,刘德立,邓灵福,等.蜡状芽孢杆菌好氧反硝化特性研究[J].环境科学研究,2008,21(3):155-159.
[24]周迎芹,信欣,姚力,等.一株高效异养硝化-好氧反硝化菌的分离鉴定及脱氮性能[J].环境工程学报,2013,7(10):4127-4132.
