乳蛋白水包油乳液氧化稳定性影响因素研究
2018-04-11易建华宁建琴朱振宝
徐 丹, 郭 芮, 易建华, 宁建琴, 朱振宝
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
油脂氧化是导致食品腐败,改变产品风味、质地和营养价值,以及缩短油料食品货架期的主要因素之一[1].O/W乳液,例如牛奶,婴幼儿配方奶粉,沙拉酱等是食品中最常见的油脂存在形式之一.油脂氧化大多发生在油水交界面,研究表明,界面脂溶性和水溶性组分相互作用较为强烈,从而能够加速油脂氧化.
WPI和CS是乳蛋白的两种主要组分.乳蛋白具有乳化特性,能够吸附在油-水界面,降低乳滴界面张力提高乳液物理稳定性,因此,作为大分子乳化剂常应用于制备食品乳液体系[2].与此同时,蛋白质是一种天然抗氧化剂.已有研究表明,吸附于油-水界面的膜蛋白以及溶解于连续相的水相蛋白都能抑制油脂氧化[3].蛋白质的抗氧化活性可能机理:螯合促氧化过渡金属离子,通过氨基酸清除自由基,在界面形成粘弹性的薄膜抑制油脂与促氧化剂的相互作用[4,5].目前,已有许多乳液氧化稳定性的相关研究,如Hairan M等[6]研究表明,改性的CS可以提高亚麻籽油乳液的氧化稳定性;Phoon等[7]研究表明,经热处理的β-乳球蛋白影响水包鲱鱼油乳液中油脂的氧化,揭示了当β-乳球蛋白被加热至熔融状态时,它可以提高油脂氧化稳定性;Mei等[8]研究表明,酚醛类抗氧化剂增加铁离子的促氧化活性,在较低pH下加速油脂氧化.以上研究多数集中于经过预处理的WPI、CS或非蛋白类抗氧化剂对乳液氧化稳定性的影响.基于此,本文研究未经处理的WPI和CS,比较在水包核桃油乳液体系中不同因素对其抗氧化活性的影响.
既往研究表明,O/W乳液氧化稳定性受多种因素影响,水相环境(如水相pH、离子强度、乳化剂种类及浓度)以及界面特性(如界面厚度、带电特性等).本实验目的是比较研究WPI与CS及其浓度,pH,盐浓度对水包核桃油乳液中油脂氧化的影响,为乳蛋白同时作为乳化剂以及抗氧化剂应用于食品乳液提供理论与技术支持.
1 材料与方法
1.1 实验材料与仪器
1.1.1主要材料与试剂
乳清分离蛋白:Davisc WPI95,纯度为96.5%,酪蛋白(Casein):纯度为85.7%,上海福诺食品有限公司;磷酸氢二钠,磷酸二氢钠,叠氮钠,石油醚,异辛烷,异丙醇,正丁醇,甲醇,分析纯,天津科密欧试剂有限公司;三氯乙酸,硫代巴比妥酸,硫氰酸铵,分析纯,天津天力试剂有限公司;氢过氧化枯烯,1,1,3,3-四乙氧基丙烷,分析纯,阿达玛斯试剂有限公司;核桃油,实验室提取[9].
1.1.2主要实验仪器
精密pH计,PB-10型,赛多利斯科学仪器北京有限公司;旋转蒸发仪,RE-52A型,上海亚荣生化仪器厂;电子天平,BS323S型,赛多利斯科学仪器北京有限公司;磁力搅拌器,84-1型,上海梅颖浦仪器仪表制造有限公司;超细匀浆器,F6/10-10G型,上海弗鲁克流体机械制造有限公司;超高压均质机,HP-4L科研型,喜高精密流体机械有限公司;电热恒温鼓风干燥箱,GZX-GF101-1-BS型,上海跃进医疗器械有限公司;集热式恒温加热磁力搅拌器,DF-101S型,巩义市予华仪器有限责任公司;漩涡混合器,QL-901型,海门市其林贝尔仪器制造有限公司;离心机,D-16C型,赛多利斯实验设备有限公司;紫外可见分光光度计,UV759S型,上海荆和分析仪器有限公司.
1.2 实验方法
1.2.1O/W乳液的制备
参考文献[10]的方法,略有改动.将WPI和CS溶解于10 mmol/L pH 3.0或7.0磷酸氢二钠-磷酸二氢钠缓冲液(用去离子水溶解)中,加入0.02%叠氮钠防腐.室温下磁力搅拌2 h,放入4 ℃冰箱中冷藏过夜.乳液的制备分为两个阶段,首先,将5%的核桃油(油相)与95%的含乳化剂的缓冲液(水相)通过手持式超细匀浆器搅拌混合形成粗乳,搅拌速率为10 000 r/min,搅拌时间为1 min.然后用高压均质机,在50 MPa均质3次,得到乳化均匀的乳状液.
1.2.2油脂氢过氧化物(ROOH)含量的测定
参考文献[3,11]的方法,稍有改动.将乳液置于具塞试管中于50 ℃烘箱中氧化12 d,每天测定油脂ROOH浓度.取0.3 mL样品,与1.5 mL异辛醇/异丙醇(3∶1,v/v)混合液混合,用混合振荡器振荡3次,每次10 s.1000 r/min离心2 min,取200μL上层有机相溶液与2.8 mL甲醇/1-丁醇(2∶1,v/v)混合液混合,再加入50μL 3.94 mol/L硫氰酸铵溶液和50μL亚铁离子溶液(由0.132 mol/L氯化钡溶液和0.144 mol/L硫酸亚铁溶液按照体积比为1∶1混合而成),振荡混合20 min,在510 nm下测吸光度.以氢过氧化枯烯为标准物绘制标准曲线.
1.2.3硫代巴比妥酸结合物(TBARS)含量的测定
乳液中TBARS含量根据文献[3,12]方法测定.经12 d存放后,测定乳液中次级氧化产物TBARS的含量.
配制TCA-TBA-HCl(三氯乙酸-硫代巴比妥酸-HCl)混合溶液:15%(w/v)TCA、0.375%(w/v)TBA和0.25 mol/L盐酸溶液;2%BHA(丁基羟基茴香醚)乙醇溶液;TBA混合试剂:以100∶3的比例混合TCA-TBA-HCl溶液和BHA乙醇溶液.
取2 mL TBA混合试剂于试管中,加入1 mL样品,混合后,95 ℃水浴加热15 min,然后室温水浴冷却10 min,8 000 r/min离心20 min,静置10 min后于532 nm条件下测定吸光值.以1,1,3,3-四乙氧基丙烷为标准物绘制标准曲线.
1.2.4不同蛋白质及其浓度对乳液氧化稳定性的影响
分别将1.0、1.5、2.0 wt% WPI和CS溶于pH 7.0的磷酸盐缓冲溶液中作为水相,根据1.2.1制备WPI和CS稳定的水包核桃油乳液.分别将乳液在50 ℃强制氧化12 d,根据1.2.2和1.2.3,每天测定其ROOH和TBARS含量,研究两种蛋白质及其浓度对水包核桃油乳液氧化稳定性的影响.
1.2.5不同pH对乳液氧化稳定性的影响
分别将2.0 wt% WPI和CS溶于pH 7.0的磷酸盐缓冲液中,用0.1 mol/L HCl溶液或NaOH溶液调节体系的不同pH,分别为3.0、7.0、8.0、9.0,参照1.2.1方法,制备一系列乳液后,同1.2.4每天测其ROOH和TBARS含量,研究pH对乳液中油脂氧化稳定性的影响.
1.2.6不同浓度NaCl对乳液氧化稳定性的影响
分别将1.5 wt% WPI和CS分别溶于pH 7.0磷酸盐缓冲液中,根据上文研究的物理稳态下的钠盐浓度,磁力搅拌条件下,缓缓加入浓度为0、50和100 mmol/L NaCl,制备一系列乳液,同1.2.4,每天测其ROOH和TBARS含量,研究NaCl对乳液氧化稳定性的影响.
2 结果与讨论
2.1WPI与CS及其浓度对乳液油脂氧化稳定性的影响
不同浓度WPI和CS稳定的水包核桃油乳液中油脂的氧化速率如图1所示.从图1可看出,随着WPI和CS浓度的增加,乳液中油脂氧化的初级产物ROOH和次级氧化产物TBARS浓度均出现降低的趋势.乳液存放7 d,1.0 wt% WPI乳液ROOH浓度逐渐增大直至最大值(0.615±0.018 mmol/L 乳液),然后逐渐降低,其原因在于ROOH分解为次级氧化产物如丙二醛、丙醛、己醛等小分子[11].1.5、2.0 wt% WPI 乳液形成最高ROOH浓度的时间延迟至8 d,且形成的ROOH浓度低于1.0 wt%WPI稳定的乳液,表明提高WPI浓度有利于抑制乳液油脂氧化,这与Kellerby等[13]的研究结果一致.有研究表明,蛋白质浓度越大,更有效的蛋白质吸附导致更厚界面层的形成,因此提供更好的界面屏障阻止促氧化剂的攻击[14].还有研究表明,当油滴被蛋白质完全覆盖后,蛋白质主要以游离形式存在于水相,水相蛋白可以通过螯合金属离子与清除自由基等途径抑制油脂氧化.故而蛋白质浓度越大,乳液氧化稳定性越高[15].
比较图1(a)和图1(b)的研究结果可以发现,同浓度下,CS稳定的乳液形成的最高ROOH浓度(如1% CS,ROOH为0.666±0.022 mmol/L乳液)高于WPI乳液(如1% WPI,ROOH为0.615±0.018 mmol/L乳液).有研究[16]显示,CS是一种有弹性的生物聚合物,可以形成相对较厚的界面膜,能够在连续相促氧化剂(如过渡金属离子)和油脂之间形成更坚实的物理屏障,因此其乳液的氧化稳定性较WPI乳液更好.本文的研究结果与其不一致,分析可能的原因在于本实验所用的蛋白质纯度不同.本实验材料未经纯化处理,CS纯度(85.7%)低于WPI纯度(96.5%).

(a)WPI浓度对ROOH形成的影响

(b)CS浓度对ROOH形成的影响

(c)WPI浓度对TBARS形成的影响
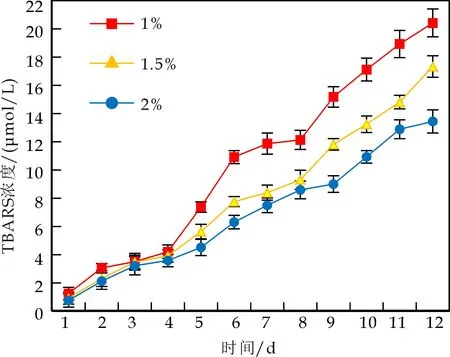
(d)CS浓度对TBARS形成的影响图1 不同蛋白质及其浓度对乳液油脂氧化稳定性的影响
2.2 水相pH对乳液油脂氧化稳定性的影响
不同水相pH对乳液中油脂氧化的影响如图2所示.由图2可看出,随着pH升高,WPI和CS稳定的水包核桃油乳液中油脂ROOH和TBARS含量也逐渐增大.pH分别为3.0和9.0,乳液存放7 d后,WPI乳液中油脂ROOH浓度分别为0.575±0.012、0.824±0.013 mmol/L 乳液(图2(a));存放12 d后,TBARS浓度分别为9.298±0.539、16.330±0.642μmol/L 乳液(图2(c)).由以上结果均可发现,当pH低于WPI等电点(pI=4.8)时,乳滴带正电荷,乳液的氧化稳定性更高,其原因可能是由于带正电的乳滴排斥促氧化过渡金属离子,从而抑制油脂的氧化.Mancuso等[17]以Tween20制备O/W乳液,研究发现相似的结论:pH 7.0时油脂氧化速率高于pH 3.0.
不同pH对CS乳液氧化稳定性的影响与WPI乳液基本一致.然而,比较图2(a)与2(b)以及图2(c)与2(d),在相同pH时,WPI乳液的氧化稳定性略高于CS乳液.
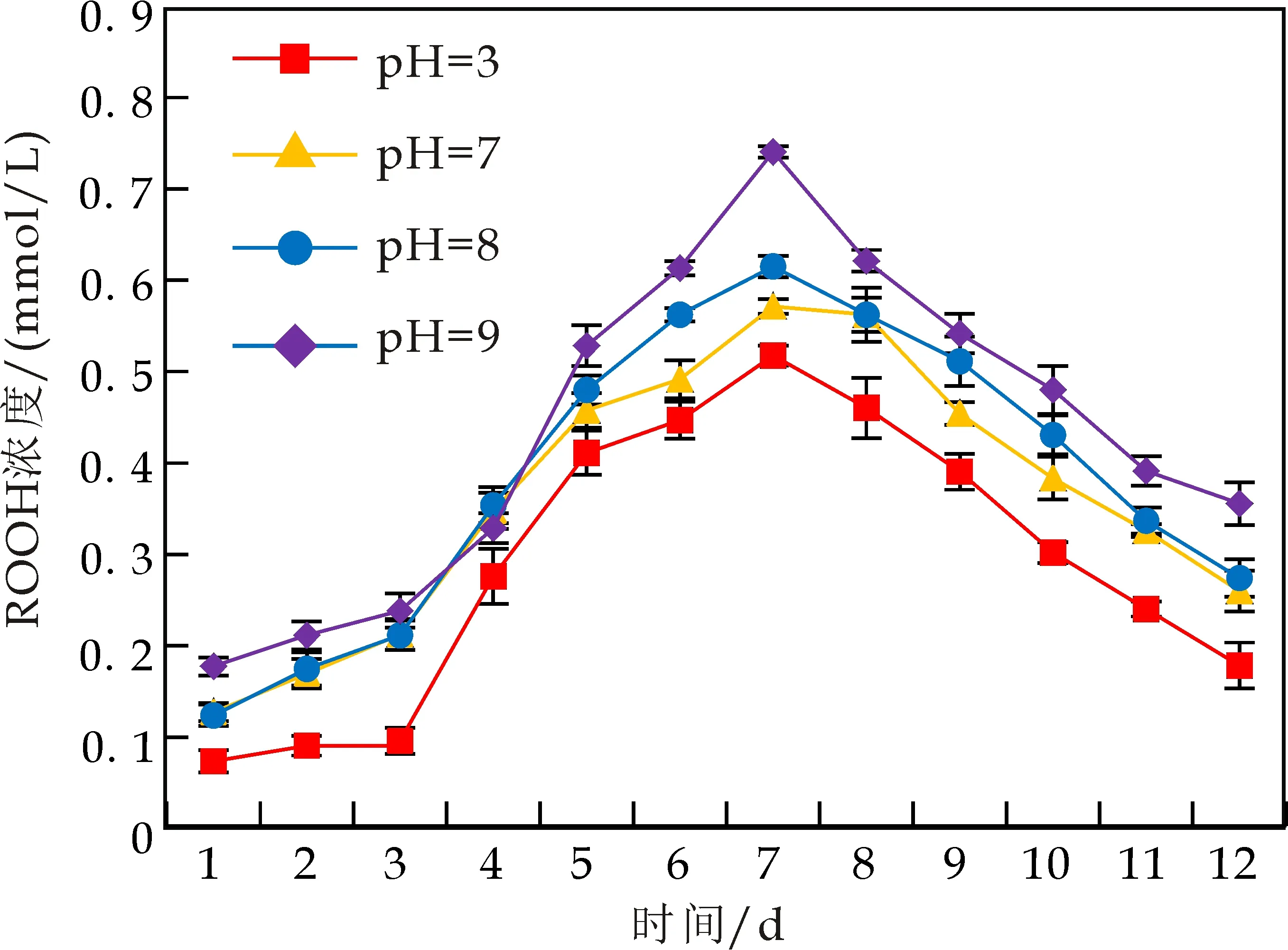
(a)pH对WPI乳液ROOH形成的影响

(b)pH对CS乳液ROOH形成的影响
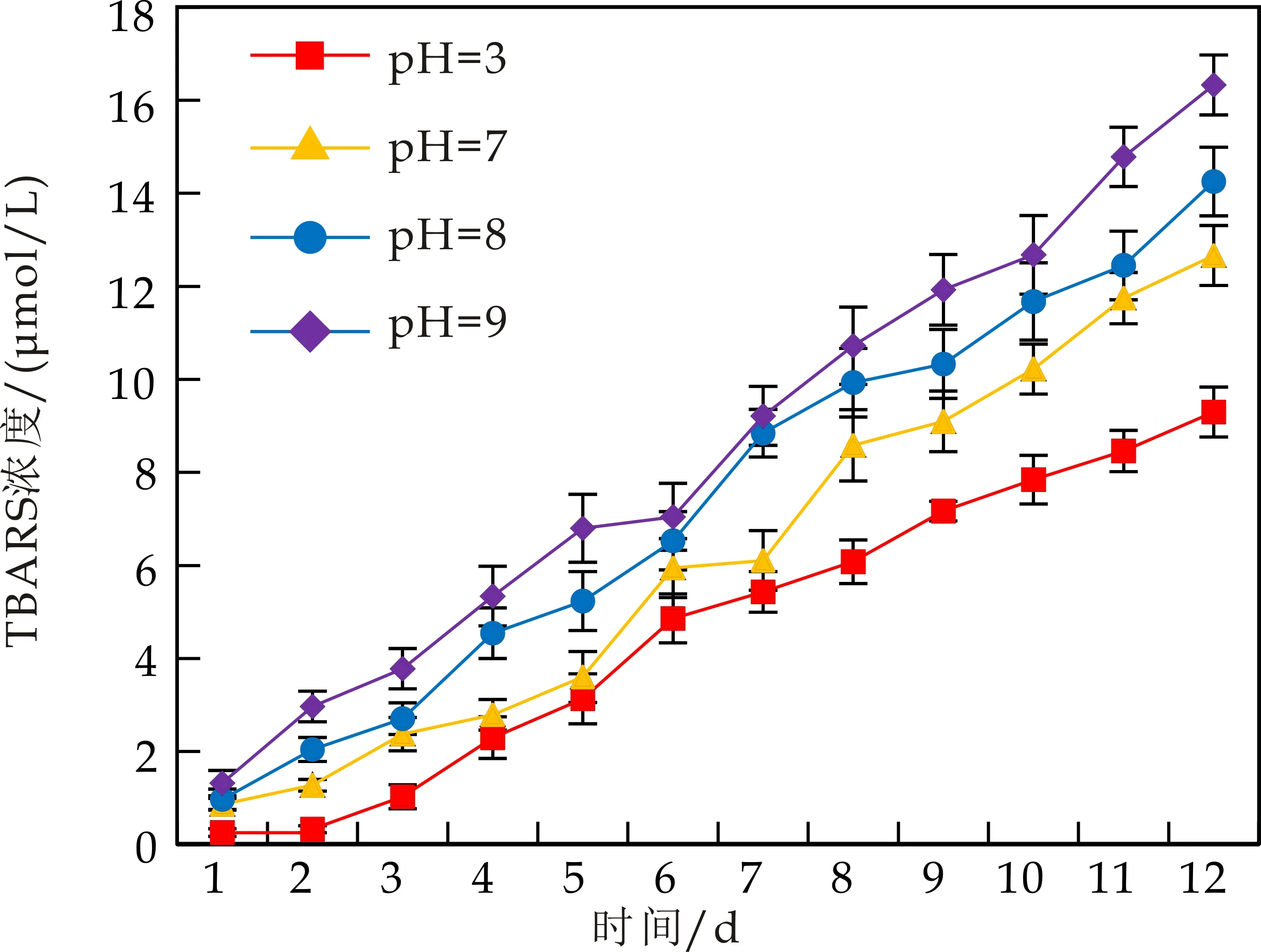
(c)pH对WPI乳液TBARS形成的影响

(d)pH对CS乳液TBARS形成的影响图2 不同 pH对乳液油脂氧化稳定性的影响
2.3 NaCl对乳液氧化稳定性的影响
己有研究[16]表明,pH会影响乳滴的带电性,而电荷的差异会对乳液的氧化稳定性产生一定影响.图3为pH 7.0 NaCl对WPI和CS乳液氧化稳定性的影响结果.
从图3可以看出,随着NaCl浓度的增大,WPI和CS乳液油脂ROOH浓度均表现为先减小后增大的趋势(图3(a)、3(b)).NaCl浓度为50 mmol/L时,一定程度地提高了乳液中油脂的氧化稳定性,由此可见,低浓度NaCl可以提高WPI和CS在乳液中的抗氧化活性;然而,NaCl浓度增加到100 mmol/L时,油脂ROOH增大,显示较高离子浓度抑制了WPI和CS在乳液中的抗氧化活性.次级氧化产物TBARS浓度的变化趋势和ROOH浓度一致(图3(c)、3(d)).Wit等[18]的研究表明,高盐浓度使乳滴负电荷的量减少,电荷屏蔽效应可能减弱蛋白质螯合金属离子的能力,因此导致抗氧化能力的减弱.从两种蛋白乳液油脂氧化的结果还可以看出,WPI乳液中油脂氧化稳定性较CS乳液略好,但不存在明显的差异.

(a)NaCl对WPI乳液ROOH形成的影响

(b)NaCl对CS乳液ROOH形成的影响
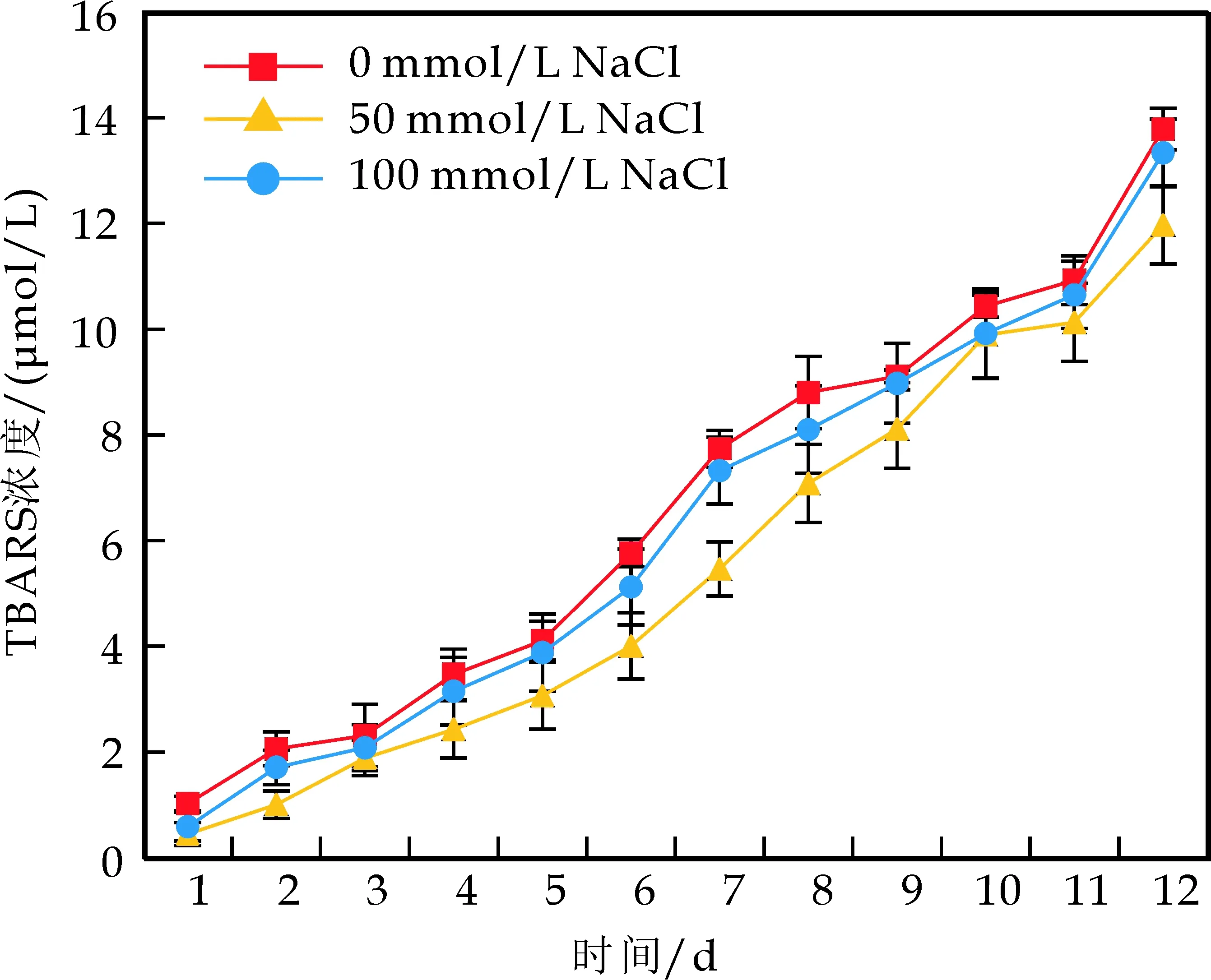
(c)NaCl对WPI乳液TBARS形成的影响

(d)NaCl对CS乳液TBARS形成的影响图3 NaCl对乳液油脂氧化稳定性的影响(pH 7.0)
3 结论
分别以WPI和CS两种蛋白质为乳化剂制备水包核桃油乳液,研究不同因素对体系油脂氧化稳定性的影响.结果发现,随着WPI和CS浓度的增加,乳液氧化稳定性均有不同程度的提高.水相pH对油脂的氧化稳定性影响较大,pH低于蛋白质等电点pI时,油脂氧化稳定性较高;pH高于pI时,油脂氧化稳定性较低.NaCl对水包核桃油乳液氧化稳定性有不同程度影响,低NaCl浓度可以提高WPI和CS在乳液中的抗氧化活性,高NaCl浓度抑制WPI和CS的抗氧化性.WPI乳液油脂的氧化稳定性高于CS乳液.
[1] Liu S,Liu F G,Xue Y H,et al.Evaluation on oxidative stability of walnut beverage emulsions[J].Food Chemistry,2016,203:409-416.
[2] Li M,Auty M A E,O′Mahony J A.Covalent labelling ofβ-casein and its effect on the microstructure and physico-chemical properties of emulsions stabilized byβ-casein and whey protein isolate[J].Food Hydrocolloids,2016,61:504-513.
[3] Elias R J,Mc Clements D J,Decker E A.Antioxidant activity of cysteine,tryptophan,and methionine residues in continuous phaseβ-lactoglobulin in oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2005,53:10 248-10 253.
[4] Tong L M,Sasaki S,Mc Clements D J,et al.Mechanisms of the antioxidant activity of a high molecular weight fraction of WPI[J].Journal of Agricultural and Food Chemistry,2000,48:1 473-1 478.
[5] Tong L M,Sasaki S,Mc Clements D J,et al.Antioxidant activity of whey in a salmon oil emulsion[J].Journal of Food Science,2000,65:1 325-1 329.
[6] Hairan M,Pirkko F,Petri K,et al.Transglutaminase catalyzed cross-linking of sodium caseinate improves oxidative stability of flaxseed oil emulsion[J].Journal of Agricultural and Food Chemistry,2012,60(24):6 223-6 229.
[7] Phoon P Y,Narsimhan G,Martin Gonzalez M F S.Effect of thermal behavior ofβ-lactoglobulin on the oxidative stability of menhaden oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2013,61:1 954-1 967.
[8] Mei L Y,Mc Clements D J,Decker E A.Lipid oxidation in emulsions as affected by charge status of antioxidants and emulsion droplets[J].Journal of Agricultural and Food Chemistry,1999,47:2 267-2 273.
[9] 周慧江.核桃蛋白源ACE抑制剂肽的酶法制备及分离、纯化[D].西安: 陕西科技大学,2013.
[10] Shao Y,Tang C H.Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions:Influence of ionic strength and heat pretreatment[J].Food Hydrocolloids,2014,37:149-158.
[11] Shantha N C,Decker E A.Rapid,sensitive,iron-based spectrophotometric methods for determination of peroxide values of food lipids[J].Journal of Aoac International,1994,77:421-424.
[12] Chen B C,Mc Clements D J,Decker E A.Role of continuous phase anionic polysaccharides on the oxidative stability of menhaden oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2010,58:3 779-3 784.
[13] Kellerby S S,Mc Clements D J,Decker E A.Role of proteins in oil-in-water emulsions on the stability of lipid hydroperoxides[J].Journal of Agricultural and Food Chemistry,2006,54(20):7 879-7 884.
[14] Kiokias S,Gordon M H,Oreopoulou V.Effects of composition and processing variables on the oxidative stability of protein-based and oil-inwater food emulsions[J].Critical Reviews in Food Science and Nutrition,2017,57(3):549-558.
[15] Kim H J,Decker E A,Mc Clements D J.Influence of protein concentration and order of addition on thermal stability ofβ-lactoglobulin stabilized n-hinexadecane oil-in-water emulsions at neutral pH[J].Langmuir,2005,21:134-139.
[16] Kellerby S S,Gu Y S,Mc Clements D J,et al.Lipid oxidation in a menhaden oil-in-water emulsion stabilized by sodium caseinate cross-linked with transglutaminase[J].Journal of Agricultural and Food Chemistry,2006,54:10 222-10 227.
[17] Mancuso J R,Mc Clements D J,Decker E A.The effects of surfactant type,pH and chelators on the oxidation of salmon oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,1999,47:4 112-4 116.
[18] Wit D,Kessel J N.The effects of ionic strenght on the solubility of whey protein products:A colloid chemistry approach[J].Food Hydrocolloids,1996,10:143-149.
