响应面法优化乳酸菌冻干保护剂配方
2018-04-11闫晓哲杜姣姣董腾达
杨 辉, 闫晓哲, 杜姣姣, 荆 雄, 董腾达
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
近年来人们对于乳酸菌的认识不断深入,其产品种类逐渐多样化[1],其中乳酸菌粉剂被广泛用作直投式发酵剂[2]、医药[3]和饲料[4]等产品的生产.本实验利用复合乳酸菌[5]发酵果渣浸提液过程中产生一定量副产物-乳酸菌泥[6],如果将其弃之则是浪费资源、污染环境,现通过冷冻干燥的方法将其冻干成粉,既对资源进行了有效利用也避免造成环境污染.
真空冷冻干燥是保护工业乳酸菌的存活率和功能活性的有效方法之一[7-9],它将预冻样品中的冰在真空条件下直接升华,达到低温条件下除去样品中水分的目的[10].水分的损失必然导致细胞的损伤,进而影响到菌种的活力[11,12].在冻干过程中乳酸菌细胞损伤主要包括机械损伤和溶质损伤[13],而其损伤的程度取决于细胞的生长条件、生长状态、技术参数及冻干保护剂等,其中冻干保护剂可以通过在细胞外形成蛋白膜,降低相变温度[14],增加细胞膜刚性和流动性等功效来预防或者减少在冻干期间细胞的损伤和死亡.根据保护剂能否通过细胞壁或细胞膜,可将其细分为:(1)能透过细胞壁和细胞膜的保护剂;(2)只能透过细胞壁的保护剂;(3)不能透过细胞壁和细胞膜的保护剂[13];不同保护剂其功能作用有所不同,所以通常将多种类型的保护剂复合使用来提高对菌种保护效果[15].
现在的冻干保护剂主要针对单一乳酸菌[16,17],有学者也研究复合乳酸菌冻干保护剂,陈贺佳等[18]将嗜热链球菌、保加利亚乳杆菌、嗜酸乳杆菌以3∶2∶1比例直接混合并冻干,使混合乳酸菌的冻干存活率达到89.1 %;张炎等[19]将Lactococcuslactissubsp.LactisQ8和LactobacilluscaseiG5以2∶1的比例接入到改良MRS培养基中生长并冻干,使混合乳酸菌的冻干存活率达到90.55%;本实验中采用的混合乳酸菌泥是乳酸菌发酵果渣浸提液的副产物,并不是5种菌种简单混合,也并未给菌种生长提供特殊的培养基,而是以处理混合乳酸菌发酵的副产物——5种乳酸菌菌泥为目的.在参考前人实验[16,17]的基础上选取了8种常用冻干保护剂,通过一系列试验对冻干保护剂配方进行优化,进而最大程度的保护冻干菌种,从而为乳酸菌饲料制备奠定技术基础.
1 材料与方法
1.1 材料与试剂
1.1.1菌株
嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、双歧杆菌、嗜热链球菌:由陕西科技大学食品与生物工程学院研究室保存.
1.1.2活化培养基
(1)MRS肉汤(北京陆桥技术有限责任公司):蛋白胨10.0 g/L、牛肉浸粉5.0 g/L、酵母浸粉4.0 g/L、葡萄糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸三铵2.0 g/L、乙酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.05 g/L、吐温80 1.0 g/L、pH值6.2±0.1;
(2)M17培养基(青岛高科园海博生物技术有限公司):大豆胨5.0 g/L、蛋白胨2.5 g/L、酪蛋白胨2.5 g/L、酵母浸粉2.5 g/L、牛肉浸粉5.0 g/L、乳糖5.0 g/L、抗坏血酸钠0.5 g/L、β-甘油磷酸钠19.0 g/L、硫酸镁0.25 g/L、pH值7.2±0.2.
1.1.3发酵培养基
调配的果渣浸提液[6].
1.1.4计数培养基
MRS培养基(北京陆桥技术有限责任公司):蛋白胨10.0 g/L、牛肉浸粉8.0 g/L、酵母浸粉4.0 g/L、葡萄糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸氢二铵2.0 g/L、乙酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.04 g/L、琼脂14.0 g/L、吐温80 1.0 mL/L、pH值6.5±0.2.
1.1.5试剂
低聚果糖、低聚木糖、低聚半乳糖、菊糖、磷酸氢二钾、蔗糖、海藻糖:北京嘉康源科技发展有限公司;NaHCO3:天津市天力化学试剂有限公司.
1.2 主要仪器
恒温培养箱(山东潍坊医疗器械厂),电子分析天平(赛多利斯(北京)科技有限公司),pHS-4C+酸度计(成都市方舟科技开发公司),DK-S24型电热恒温水浴锅(上海精宏实验设备有限公司),超净工作台(苏州净化设备工作厂),榨汁机(广东美的精品电器制造有限公司),YX-24LDJ型灭菌锅(江阴滨江医疗设备有限公司),LGJ-15D型冷冻干燥机(北京四环科学仪器厂).
1.3 实验方法
1.3.1菌泥产生、收集及冻干
菌泥产生、收集及冻干的工艺流程如图1所示.

图1 工艺流程图
1.3.2冻干存活率、单位质量菌粉活菌数的测定
本实验以冻干存活率为主要指标,其计算公式如式(1)所示;单位质量菌粉活菌数为次要指标,其计算公式如式(2)所示.
冻干存活率R1(%)=
(1)
单位质量菌粉活菌数R2(CFU/mL)=
(2)
1.4 保护剂配比的优化
1.4.1单因素实验
如表1所示,实验共选择8种常用保护剂进行三组平行单因素实验,其中包含了益生元(A、B、C、D);无机盐(E、F);糖(G、H);共3类,依据文献中给出的浓度范围,分别设置浓度梯度进行单因素实验.测定c1、c2、m1,计算R1、R2.
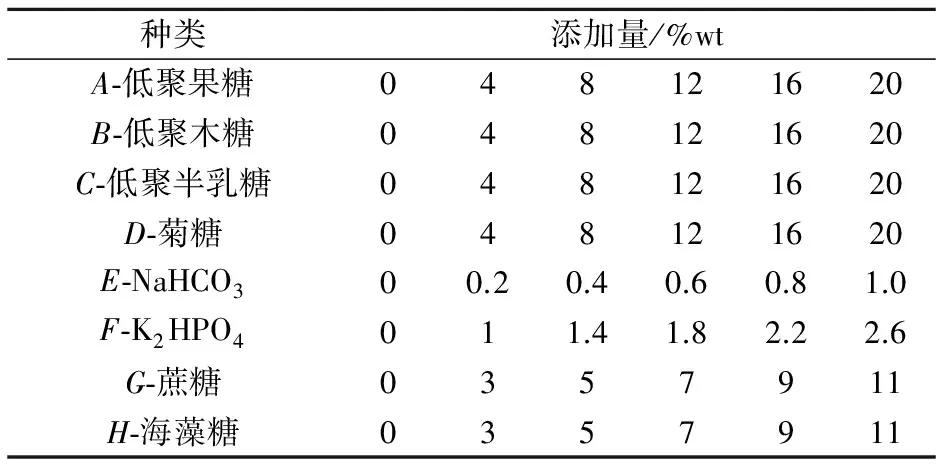
表1 单一保护剂质量浓度表
1.4.2筛选实验
本实验的冻干对象是由5种乳酸菌混合的菌泥,其细胞表面的官能团、蛋白质存在一定的差异,导致了单一冻干保护剂不能满足高存活率的要求.针对复合乳酸菌,复配的冻干保护剂在满足保护单一乳酸菌的基础上,也能对其他种类的乳酸菌进行保护.对单一乳酸菌而言,复配的保护剂之间可能存在协调作用,可以在很大程度上提高冻干保护的效率.因此,通过单因素实验确定冻干保护剂适宜添加量,在此基础上筛选出对于存活率影响显著的保护剂种类,并对其进行响应面优化.
1.4.3爬坡实验
响应面拟合方程在考察的临近领域内能够最大程度接近真实值,故在筛选实验基础上进行爬坡实验.在爬坡实验中,选取筛选实验中对于存活率影响显著的前三种保护剂的低水平为最后一步,选取适宜步长进行爬坡实验.
1.4.4响应面优化
根据爬坡实验确定响应面中心点,选取各因素高低水平进行响应面实验,并在得到较佳结果的基础上进行验证实验.
1.4.5使用软件
本实验所使用的软件主要有Design-Expert、Excel、Spss等.
2 结果与讨论
2.1 单因素实验
2.1.1糖类单因素实验
蔗糖和海藻糖在冻干保护中的作用机理可以解释为以下两种原因:
(1)水置换假说[20].在冷冻干燥过程中,由于水分子除去导致磷脂分子间范德华力作用增强,使细胞膜处于凝胶状态,脂质高度有序而且紧密,导致细胞膜通透性增大,更易损伤[21].蔗糖和海藻糖可以直接与干燥状态的脂质膜相互作用取代水分子,维持了相变温度的稳定,从而保持磷脂双分子层的通透性,防止细胞在脱水干燥、贮存期间泄漏和融合[22].Samuel B等[23]利用FTIR,通过1 550波数处的酰胺II带,监测蛋白质的一般状态发现,在没有添加蔗糖和海藻糖干燥的细菌中,酰胺II带向较低波数移动,表明这些细胞中蛋白质构象的变化,当存在海藻糖或蔗糖时,酰胺II带没有变化,说明了海藻糖或蔗糖在一定程度上保证了细胞膜上蛋白质结构的稳定性.Adriana M等[24]研究发现蔗糖可以推迟或者阻止膜结合蛋白的变性,海藻糖或蔗糖可能代替水分子结合到蛋白质的亲水结构域[11]来防止干燥和在水化期间蛋白质内和蛋白质间氢键断裂以保护干燥过程中细胞的完整性.
(2)“玻璃化”假说[23].在冻干时海藻糖和蔗糖可以避免结晶,从而减少损伤,此外,在冻干时海藻糖和蔗糖将包裹住生物分子,由于玻璃体粘度高,使分子运动和分子变性非常微弱,从而保护生物分子的空间结构[25].
图2显示了糖类保护剂添加量对冻干菌粉的影响.由图2(a)可以看出,此菌泥的蔗糖适宜添加量为7%,海藻糖添加量为9%.
2.1.2益生元类单因素实验
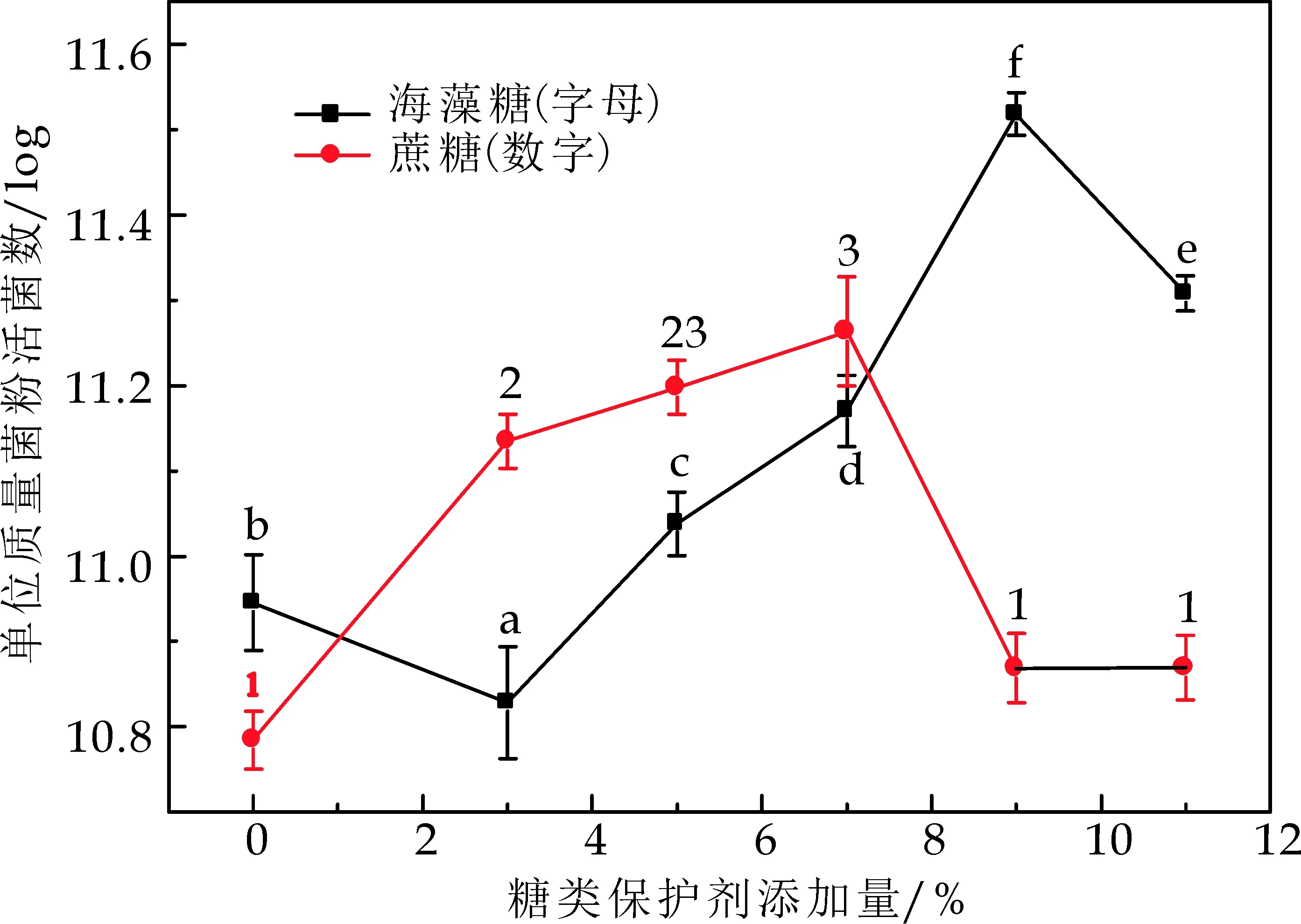
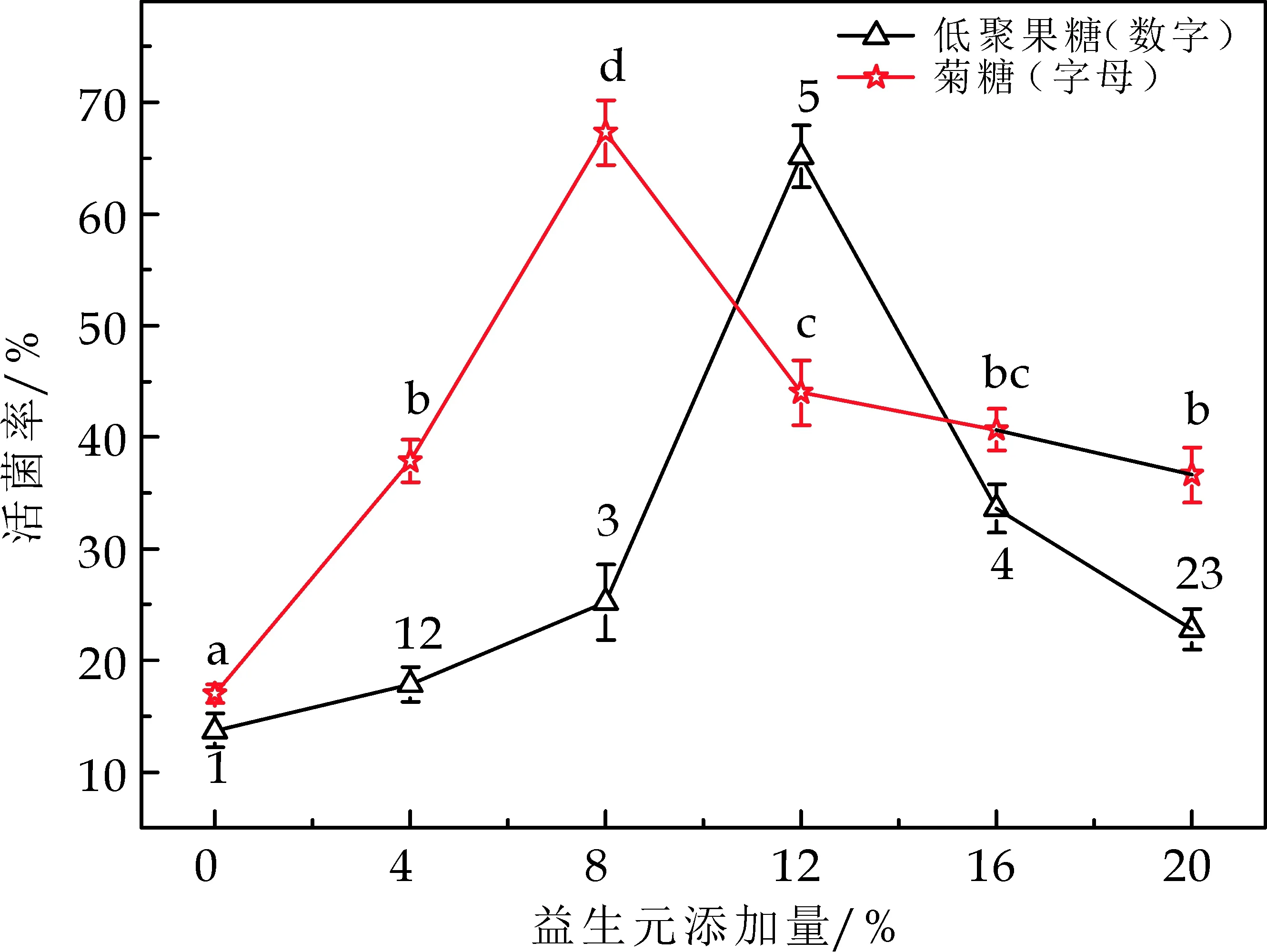
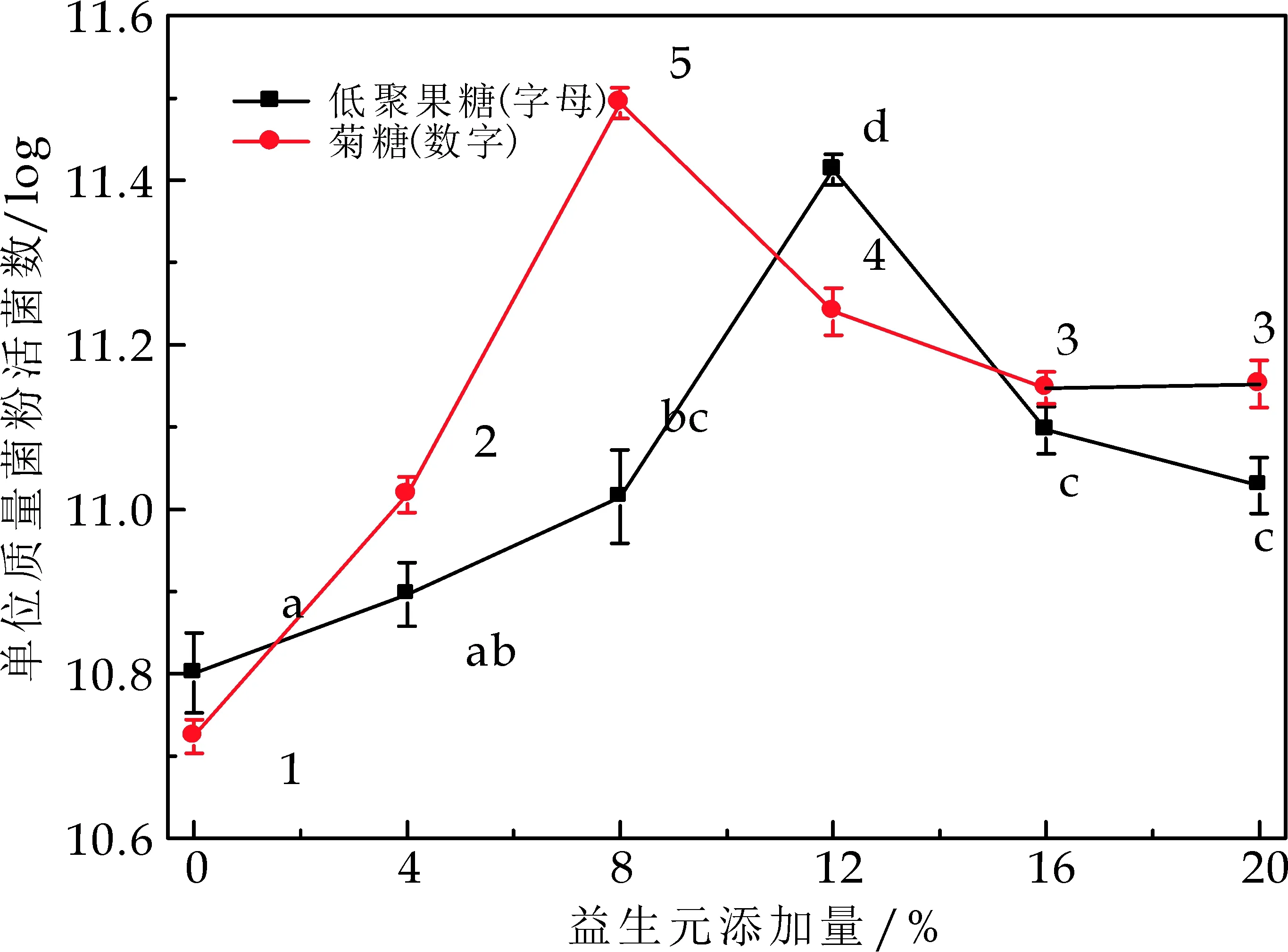
低聚半乳糖、低聚木糖、低聚果糖以及菊糖都的都具有益生元活性[26].益生元对于乳酸菌具有很好的保护作用,从化学角度来说,这四种益生元是多羟基化合物,它们对菌体的保护作用可以用水置换假说、玻璃化假说等来解释(在2.1.1已经说明).

(a)糖类保护剂添加量对冻干菌粉存活率的影响
(b)糖类保护剂添加量对单位质量菌粉活菌数的影响图2 糖类保护剂添加量对冻干菌粉的影响
此外,还有第三种机制提出:在水存在的条件下,益生元将会覆盖在生物分子表面,在一定程度上保持细胞表面的溶剂化和天然性质.这样益生元可以维持冷冻干燥的乳酸菌细胞中水的含量,从而适度保存和避免其不受伤害[27],研究发现试验中分子量最大为6 179.36的菊糖对菌体的保护效果最佳,而分子量分别为300、300.28的小分子量的低聚半乳糖、低聚木糖保护效果较差,在一定程度上说明了不同低聚糖的保护效果与其结构特征和链长有一定的关系.Tymczyszyn E E等[12]发现益生元的结构差异不仅在其与生物分子相互作用的能力中发挥重要作用,而且在其形成生物分子嵌入玻璃体的能力方面也至关重要.Tymczyszyn E E等[28]还发现益生元浓度对乳酸菌冻干和存储有一定影响,冻干所需浓度高,而存储所需浓度低.
图3结果表明:低聚半乳糖、低聚果糖、低聚木糖、菊糖添加量分别为:8%、12%、16%、8%,菊糖的保护作用最好,与上述分析的一致,不过本研究表明低聚半乳糖和低聚木糖对乳酸菌也具有较好的保护作用,对此还需做进一步的研究.
(a)低聚果糖、菊糖添加量对活菌率的影响
(b)低聚果糖、菊糖添加量对单位质量菌粉活菌数的影响
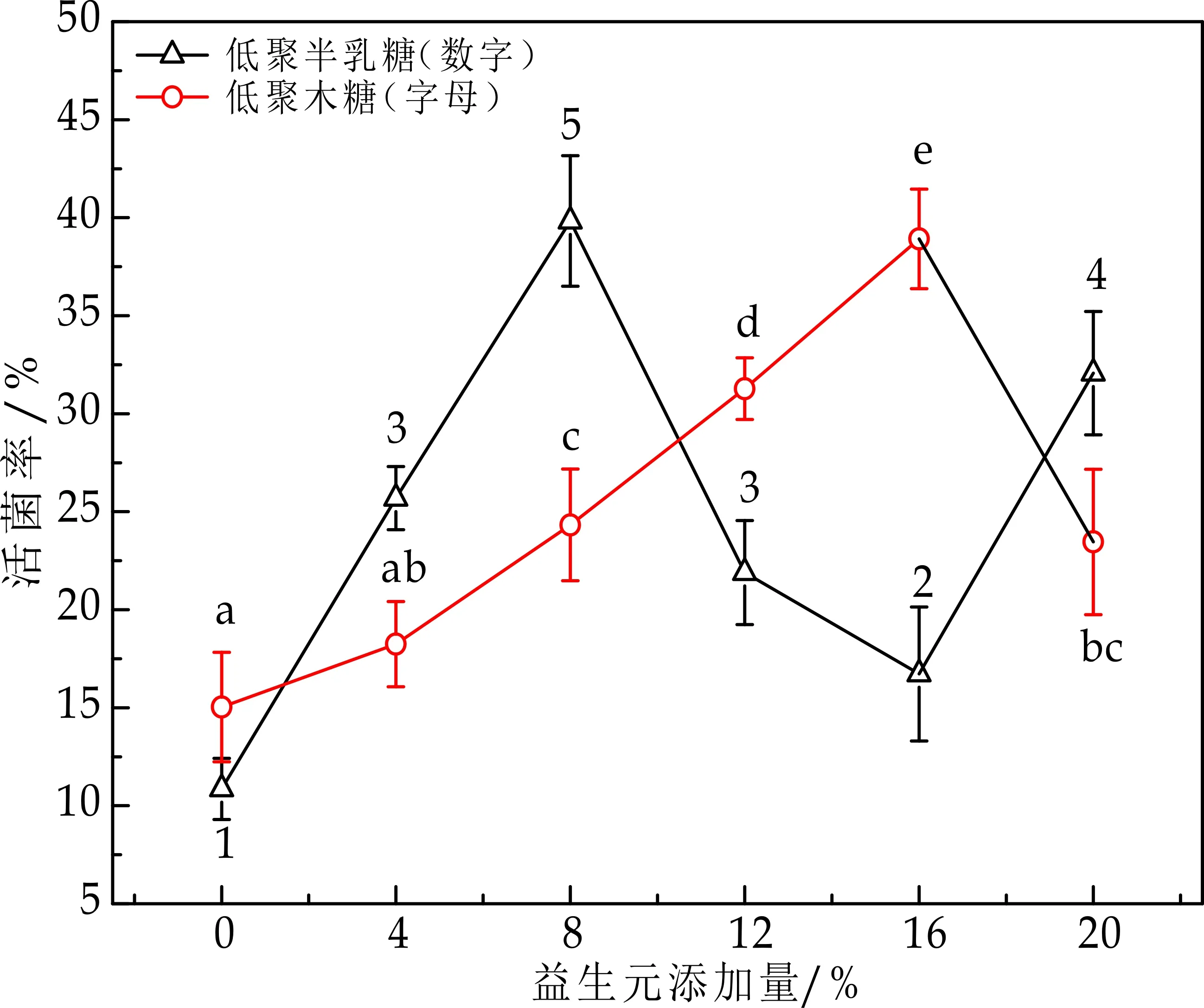
(c)低聚半乳糖、低聚木糖添加量对活菌率的影响
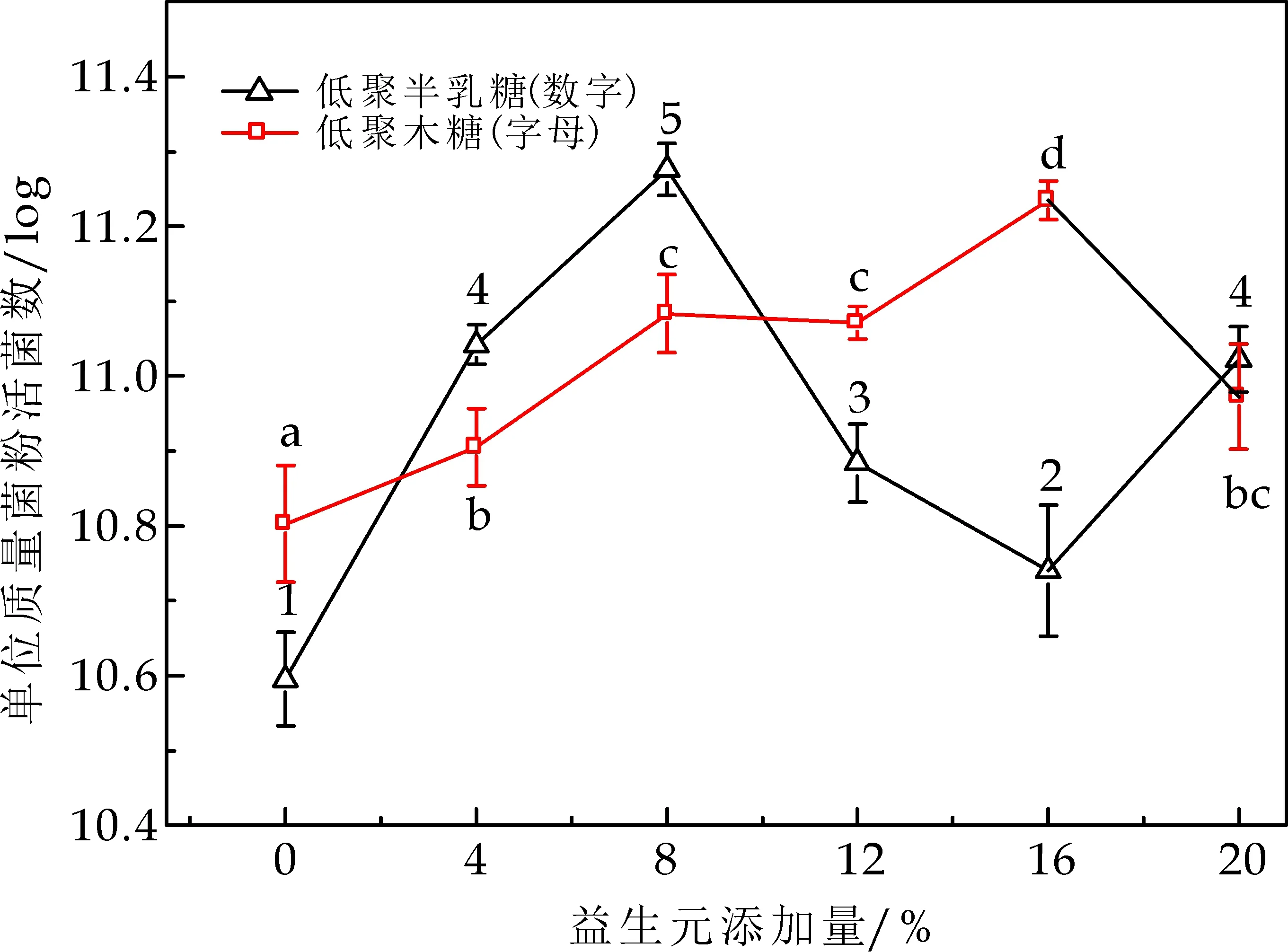
(d)低聚半乳糖、低聚木糖添加量对单位质量菌粉活菌数的影响图3 益生元类保护剂添加量对冻干菌粉的影响
2.1.3无机盐类单因素实验
由图4可知,无机盐类单因素实验所选无机盐类都含有单价金属阳离子,Adriana M等[24]研究发现,单价金属阳离子盐能够降低细胞膜的相变温度,使细胞膜保持液体状态,并增强细胞对于压力的抵抗性,同时,乳酸菌处于高渗条件下,使细胞内相容性溶质浓度提高,增强乳酸菌对高渗环境的适应性,也增加了对干燥、冷冻的耐受性,所以单因素实验中所选盐浓度较高.但盐浓度过高,渗透平衡会被打破,尽管单价金属阳离子不影响磷脂双分子层特性,但细胞膜上的蛋白质将发生不可逆变性,使细胞膜受损,进而导致细胞的亚致死损伤或死亡.故根据单因素实验结果选择碳酸氢钠添加浓度1.0%,磷酸氢二钾添加浓度1.4%.不同的盐离子对细胞内的离子浓度的提高程度不同,对细胞的保护作用不同,单一的无机盐保护效果并不是很理想,因此要配合其他种类保护剂共同使用.
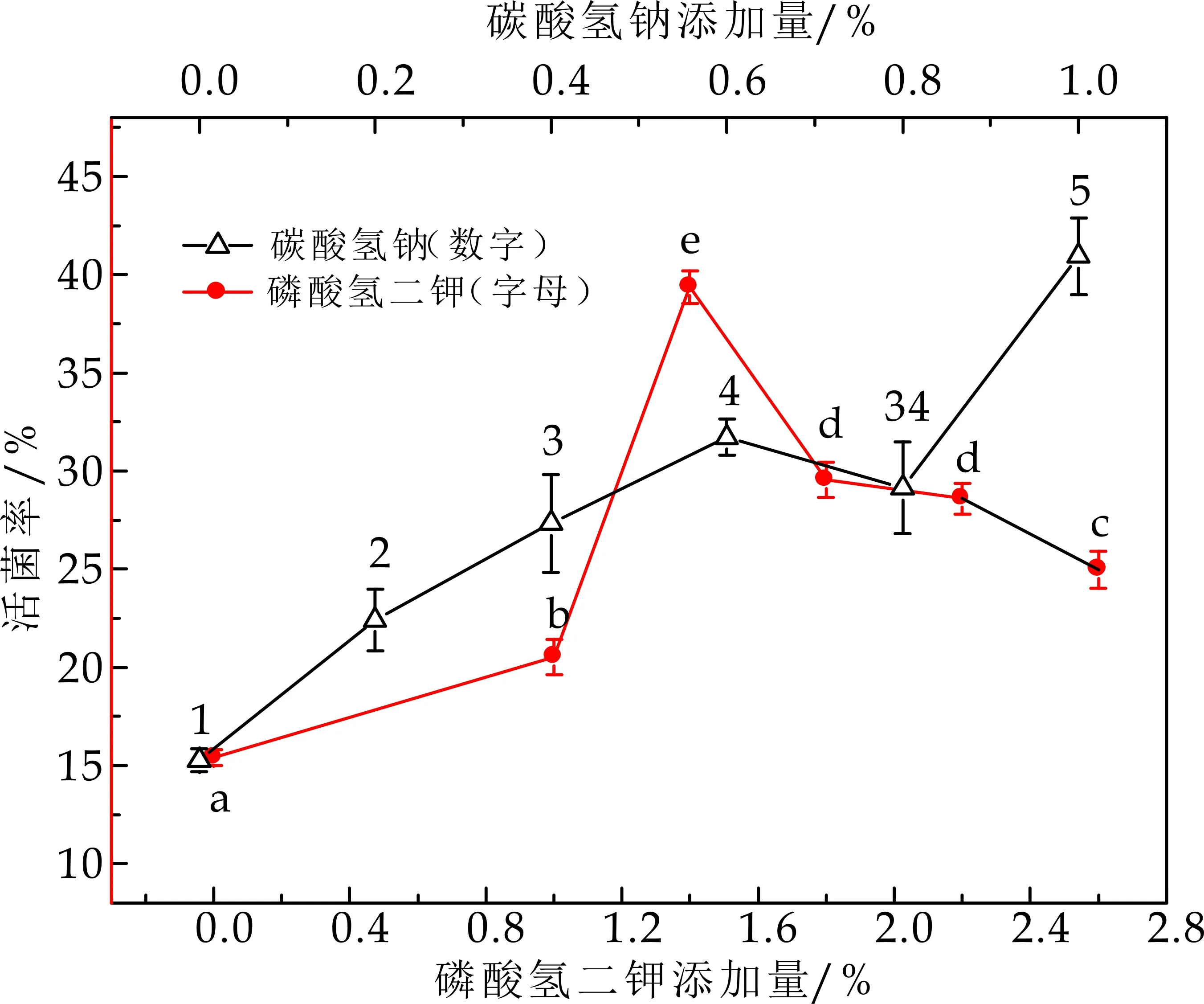
(a)无机盐添加量对活菌率的影响
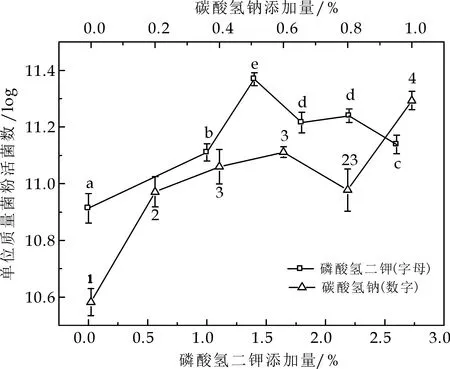
(b)无机盐添加量对单位质量菌粉活菌数的影响图4 无机盐添加量对活菌率的影响
2.2 筛选实验
依据2.1单因素实验结果,进行筛选实验,其中保护剂各因素水平如表2所示;保护剂PB设计及结果如表3所示;保护剂对R1(冻干存活率)的方差分析如表4所示;保护剂对R2(单位质量菌粉活菌数)的方差分析如表5所示.

表2 保护剂各因素水平表
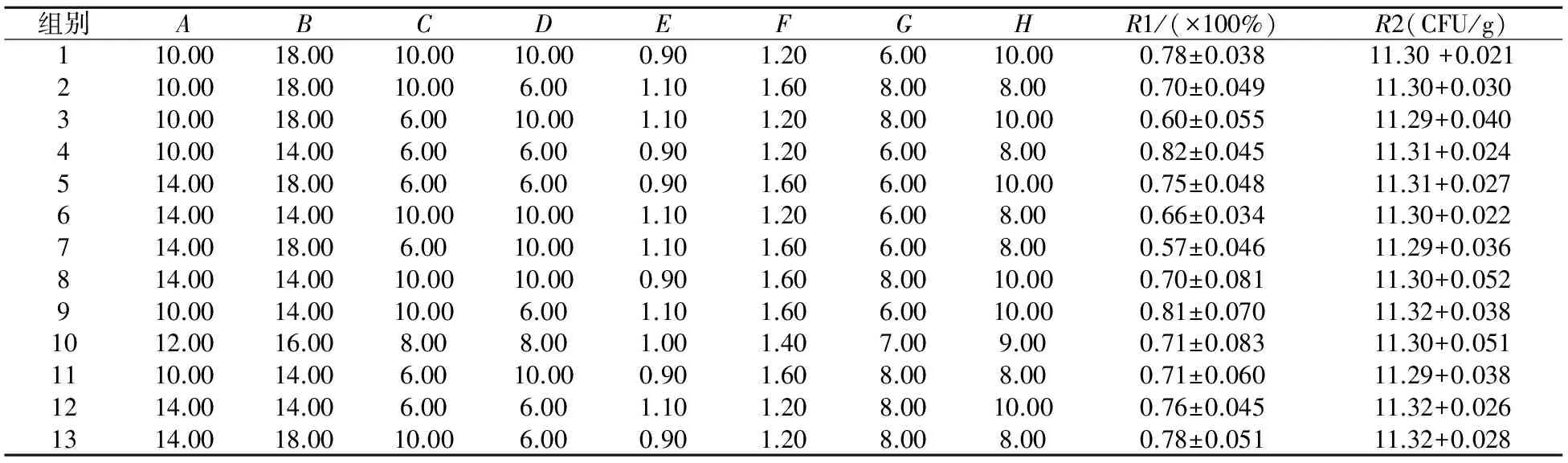
表3 保护剂PB设计及结果
注:表3中的A~H分别对应表2中对应的保护剂,保护剂添加量单位(%wt).
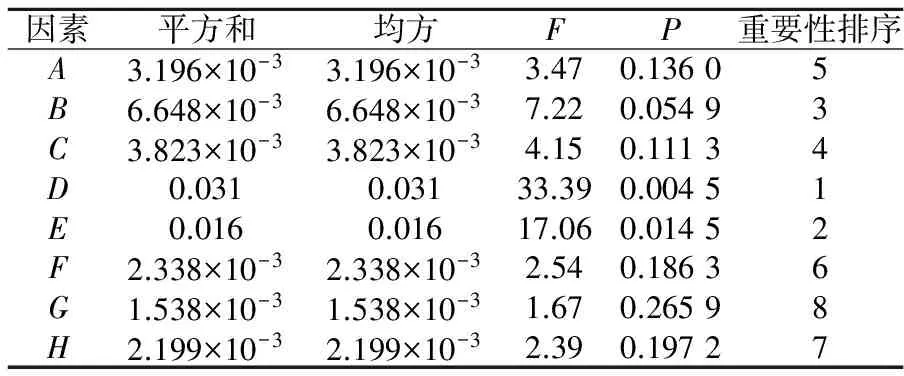
表4 保护剂对R1的方差分析
注:表4中的A~H分别对应表2中对应的保护剂.
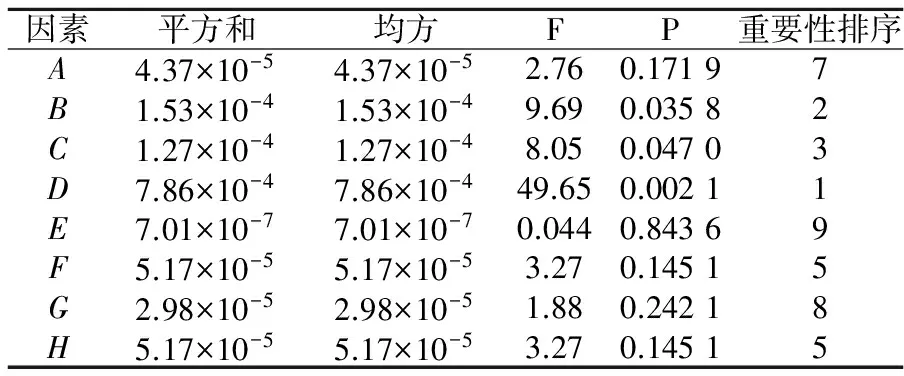
表5 保护剂对R2的方差分析
注:表5中的A~H分别对应表2中对应的保护剂.
由表4方差分析可知,D-菊糖、E-碳酸氢钠和B-低聚木糖的F值较大,且D的p=0.004 5<0.01,为极显著性因素;E的p=0.014 5<0.05,为显著性因素;B的p=0.054 9<0.1,为重要因素,其它因素对混合乳酸菌泥冻干存活率的影响均不显著;由表5方差分析可知,B-低聚木糖、C-低聚半乳糖、D-菊糖的F值较大,且D的p=0.002 1<0.01,为极显著性因素;B的p=0.035 8<0.05,C的p=0.047 0<0.5,为显著性因素,故选取D-菊糖、E-碳酸氢钠和B-低聚木糖为保护剂组成分.
2.3 爬坡实验
在筛选实验中发现D、E、B都是负效应,故应该选取其低水平作为爬坡实验的高水平,设置步长进行爬坡实验.其实验设计及结果如表6所示.
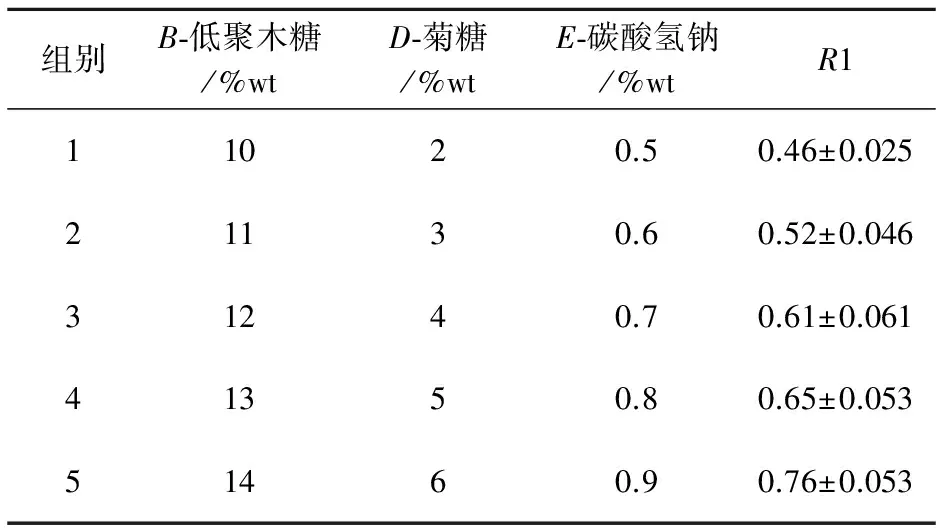
表6 爬坡试验设计及结果
根据表中实验结果可知,随着保护剂浓度的增大,R1逐渐增大,因此选择第5组为响应面中心点,分别为:B-低聚木糖14%;D-菊糖6% ;E-碳酸氢钠 0.9%.
2.4 响应面优化实验
中心组合设计因素与水平如表7所示;中心组合设计实验结果如表8所示;响应面二次模型的方差分析如表9所示.

表7 中心组合设计因素与水平
对表7的实验结果建立回归模型并进行数据分析,得到以下回归模型方程:
R1=+0.80+0.022×B+0.026×D+0.019×E
+0.027×B×D+0.013×B×E-
4.250×10-3×D×E-0.049×B2-0.047×
D2-0.033×E2
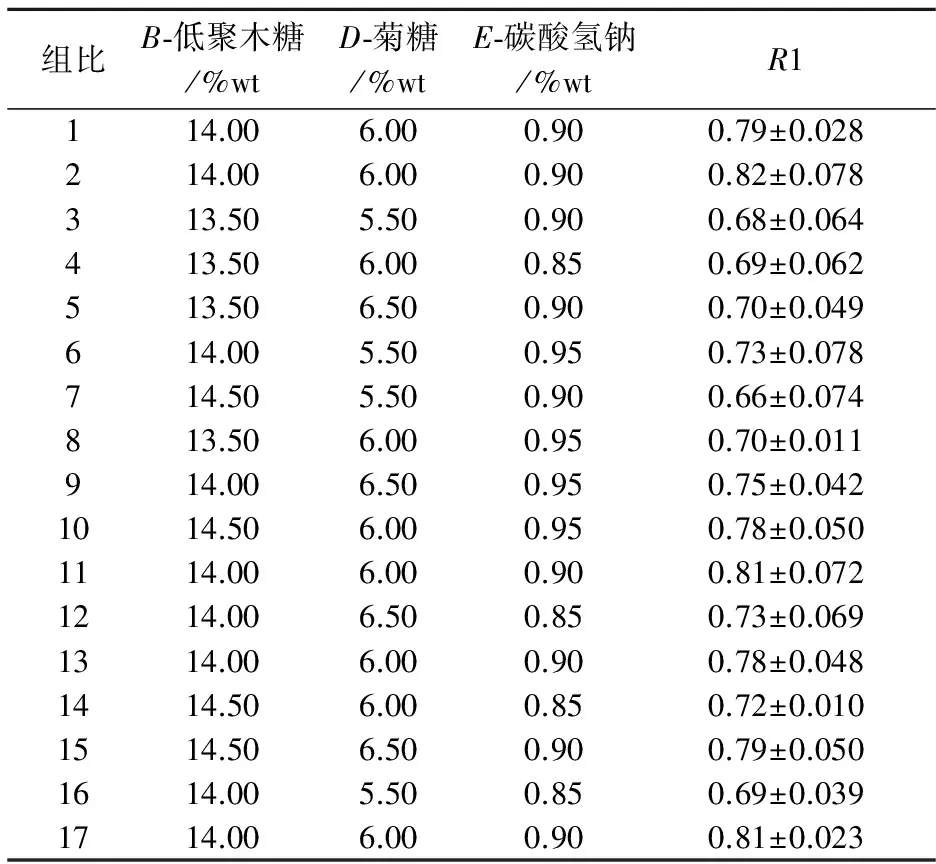
表8 中心组合设计实验结果
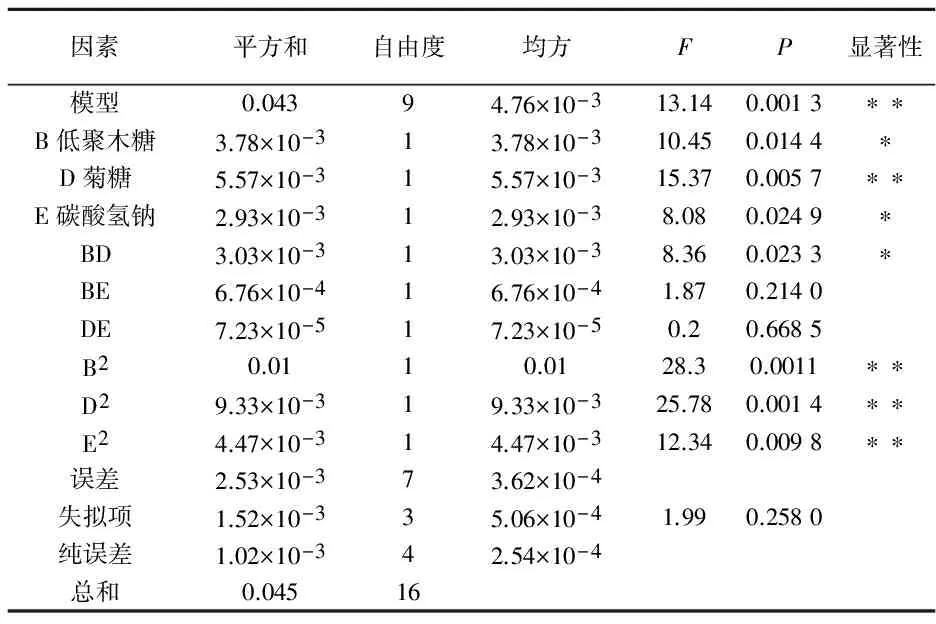
表9 响应面二次模型的方差分析
注:“**”表示对结果影响非常显著(P<0.01);“*”表示对结果影响显著(P<0.05)
方程模型的p值为0.001 3,表明模型显著,失拟项p>0.1,表明失拟项不显著,无失拟因素存在,该模型有效,可用模型对数据进行分析.R2=0.944 1,说明回归方程的拟合程度较好,回归分析有效,因此,用此回归方程来预测乳酸菌泥冻干存活率.
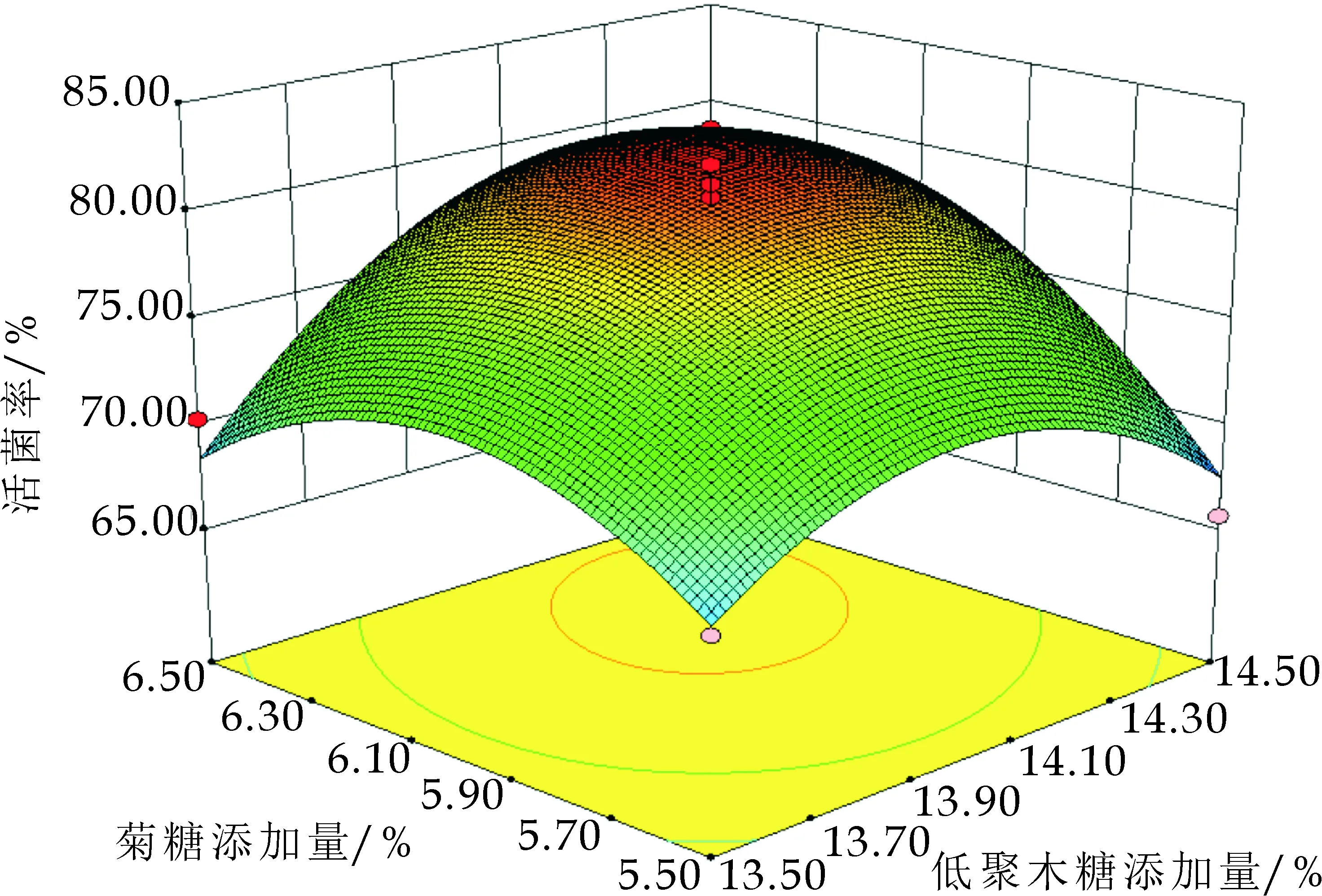
图5显示了低聚木糖、菊糖、碳酸氢钠交互作用对冻干存活率影响的响应面及等高线.图5(a)表明低聚木糖和菊糖的交互作用等高线近似圆形,且p=0.023 3<0.05,说明低聚木糖和菊糖对混合乳酸菌冻干菌粉剂交互作用显著.由水置换假说可知,低聚木糖和菊糖可以取代磷脂分子和蛋白质分子上的结合水,而低聚木糖和菊糖的相对分子量差距较大,当磷脂分子凝胶化,大分子的菊糖对于凝胶体内部水的取代效率降低,而分子量较小的低聚木糖可以与菊糖提供互补作用[12],起到保护作用.
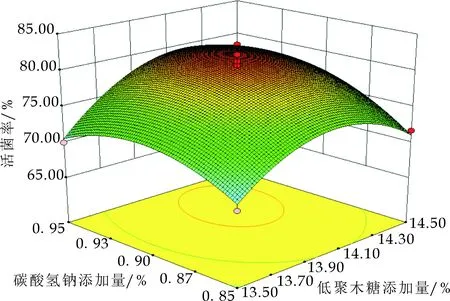
图5(b)可知,低聚木糖和碳酸氢钠的交互作用等高线为椭圆形,且p=0.214 0>0.05,说明低聚木糖和碳酸氢钠对混合乳酸菌冻干菌粉剂交互作用不显著.图5(c)可知,菊糖和碳酸氢钠的交互作用等高线为椭圆形,且p=0.668 5>0.05,说明菊糖和碳酸氢钠对混合乳酸菌冻干粉剂交互作用不显著.综合图5(b)、图5(c),盐类的保护作用主要在于使细胞内相容性溶质积累,增强乳酸菌对高渗、干燥、冷冻环境的适应性,而益生元只对于细胞外部膜和蛋白质的保护,所以益生元和无机盐类的交互作用不显著.
(a)低聚木糖和菊糖的交互作用
(b)低聚木糖和碳酸氢钠的交互作用
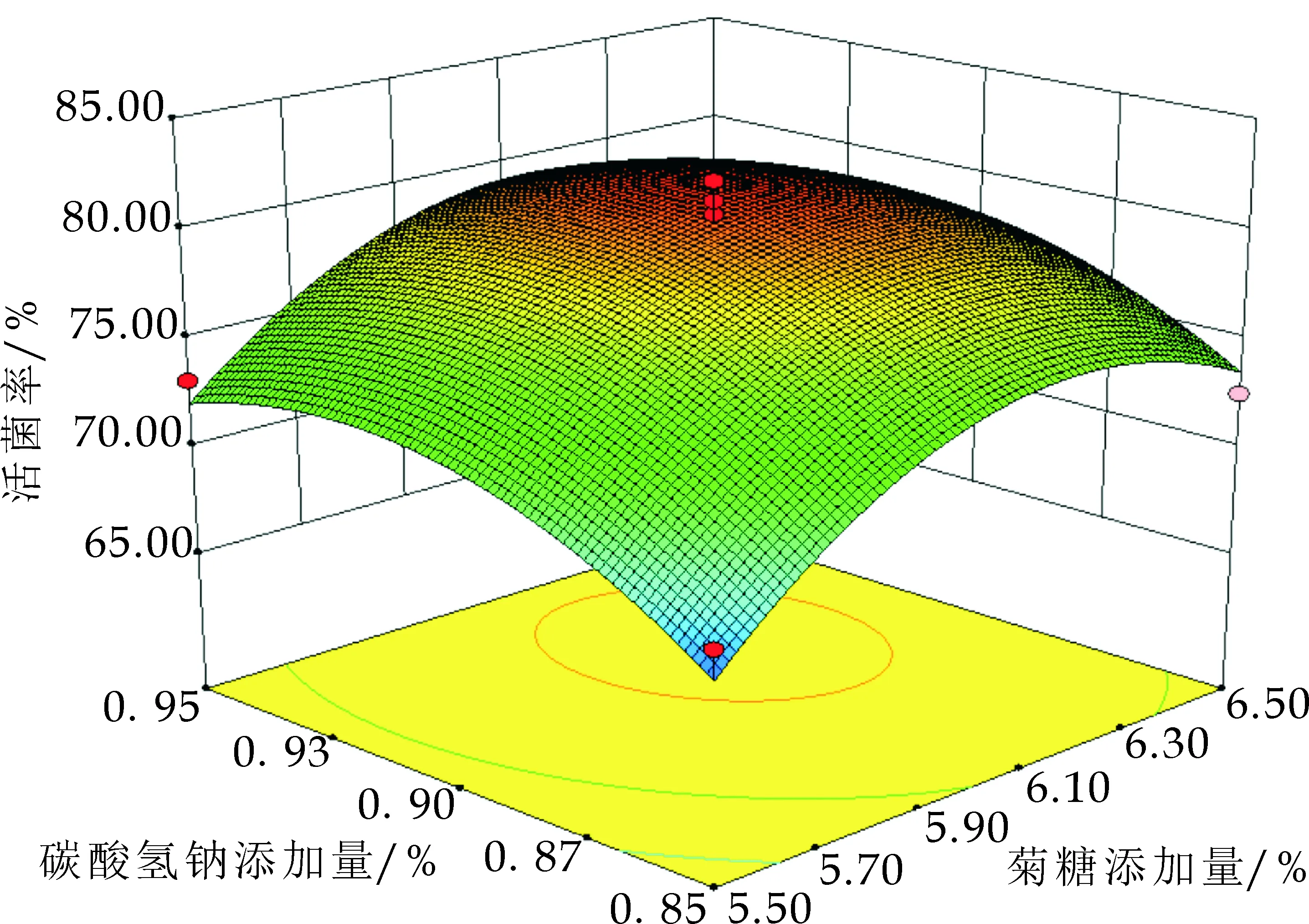
(c)菊糖和碳酸氢钠的交互作用图5 低聚木糖、菊糖、碳酸氢钠交互作用对冻干存活率影响的响应面及等高线
通过响应面分析可知,当低聚木糖添加量为14.5%、菊糖添加量为6.28%、碳酸氢钠添加量为0.92%时,预测乳酸菌菌泥的冻干存活率为79.80%.
2.5 验证实验
将嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、双歧杆菌、嗜热乳杆菌,以4%的接种量,接种比例2∶1∶2∶3∶4,接种到果渣浸提液中,在37 ℃~39 ℃下培养36~40 h,将菌液在5 000 r/min下离心10 min得到菌泥,将添加保护剂的菌泥在-20 ℃下预冻2 h后冻干24 h.冻干得到最终存活率为(82.87±4.28)%与预测值接近,与空白组(添加磷酸缓冲液,pH=7.4)相比乳酸菌菌泥的存活率提高了68.27%,表明响应面法优化乳酸菌泥冻干保护剂是可行的.
2.6 冻干菌粉活力验证
保持发酵培养基,发酵条件不变,以产酸量为指标,将继代培养菌种、复水冻干菌粉进行对比发酵实验.继代培养菌种接种量4 mL/100 mL,由于R1约为82.87%,则复水冻干菌粉的接种量为4.83 mL/100 mL,其发酵结果如图6所示.
由图6可知,继代培养菌种发酵39 h与复水冻干菌粉发酵45 h的产酸量基本接近,说明采用实验中复合保护剂进行冻干处理可以保护乳酸菌的发酵活性.继代培养菌种发酵3 h的产酸量接近复水冻干菌粉发酵9 h的产酸量,可能是因为在冻干过程中由于温度的变化以及水分子的失去,对于乳酸菌细胞造成了一定的损伤,在复水以及发酵前期需要进行修复,从而延长了发酵周期.
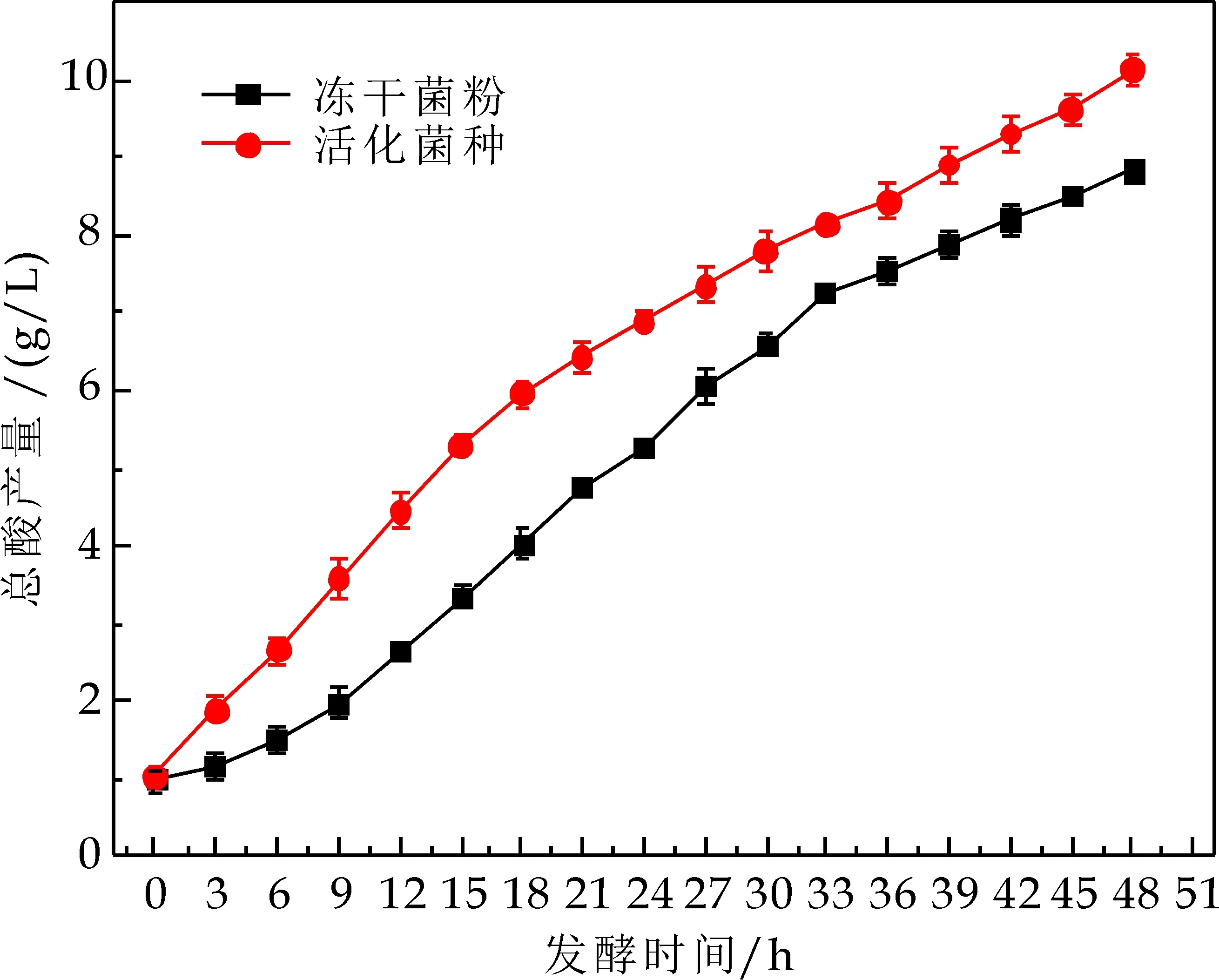
图6 冻干菌粉活力验证
3 结论
在复合乳酸菌发酵产生的乳酸菌菌泥中添加低聚木糖、菊糖、碳酸氢钠且添加量分别为14.5%、6.28%、0.92%时,可使菌泥中乳酸菌的存活率达到(82.87±4.28)%,较单一添加磷酸缓冲液提高了68.27%,表明响应面法优化复合乳酸菌冻干保护剂配方是可行的,冻干保护剂在保护乳酸菌粉的活性和功能活性方面将发挥重要作用.
[1] 白春杨.微生态制剂对家禽免疫作用研究现状[J].国外畜牧学(猪与禽),2016,36(4):70-71.
[2] 杨洋,高航.国内直投式乳酸菌发酵剂研究进展[J].中国奶牛,2016(6):44-47.
[3] Agnieszka W,Patrycja K,Jacek B,et al.Lactic acid bacteria-20 years exploring their potential as live vectors for mucosal vaccination[J].Appl Microbiol Biotechnol,2015,99(10):2 967-2 977.
[4] 韦刚,刘军义,莫伟媛,等.农副产品废弃物资源化利用生产乳酸菌饲料添加剂的研究[J].食品与发酵科技,2016,52(5):36-40.
[5] 杨辉,闫晓哲,杜娇娇.苹果渣乳酸菌发酵工艺条件优化[J].陕西科技大学学报,2017,35(3):138-142.
[6] 杨辉,闫晓哲,蒲鹏飞,等.苹果渣浸提液乳酸发酵剂的研究[J].陕西科技大学学报,2017,35(5):139-144.
[7] Fonseca F,Cenard S,Passot S.Freeze-drying of lactic acid bacteria[J].Methods in Molecular Biology,2015(1 257):477-488.
[8] Meng X C,Stanton C,Fitzgerald G F,et al.Anhydrobiotics:The challenges of drying probiotic cultures[J].Food Chemistry,2008,106(4):1 406-1 416.
[9] Morgan C A,Herman N,White P A,el at.Preservation of micro-organisms by drying:A review[J].Journal of Microbiological Methods,2006,66(2):183-193.
[10] 刘彩虹,邵玉宇,任艳,等.高密度发酵和真空冷冻干燥工艺对乳酸菌抗冷冻性的影响[J].微生物学通报,2013,40(3):492-499.
[11] Nelson R,Carolina S,Pablo M,et al.Role of mono and oligosaccharides from FOS as stabilizing agents during freeze-drying and storage ofLactobacillusdelbrueckii subsp.bulgaricus[J].Food Research International,2016,90:251-258.
[12] Tymczyszyn E E,Gómez Zavaglia A,Disalvo E A.Effect of sugars and growth media on the dehydration ofLactobacillusdelbrueckii ssp.bulgaricus [J].Journal of Applied Microbiology,2016,102(3):845-851.
[13] 蒲丽丽,刘宁,张英华,等.乳酸菌冻干保护剂及保护机理的研究进展[J].现代食品科技,2005,21(1):147-153.
[14] Schwab C,Vogel R,Gänzle M G.Influence of oligosaccharides on the viability and membrane properties ofLactobacillusreuteri TMW1.106 during freeze-drying [J].Cryobiology,2007,55(2):108-114.
[15] 陈合,齐康儒,李轶超,等.响应面法优化两歧双歧杆菌益生元类冻干保护剂[J].中国酿造,2017,36(5):81-84.
[16] 马振兴.嗜酸乳杆菌冻干菌粉的制备及应用研究[D].西安:陕西科技大学,2013.
[17] 陈世伟.产ACE抑制肽保加利亚乳杆菌冻干菌粉制备及应用[D].西安:陕西科技大学,2015.
[18] 陈贺佳,牟光庆.混合乳酸菌复合冻干保护剂的研究[J].食品研究与开发,2013,34(18):133-136.
[19] 张炎,张卫兵,宋雪梅,等.冻干保护剂对复合低温乳酸菌发酵剂的影响[J].食品工业科技,2015,36(7):144-147,153.
[20] Milhaud J.New insights into water-phospholipid model membrane interactions[J].Biochimica et Biophysica Acta,2004,1 663(1-2):19-51.
[21] Cyril J,Powell G L,Duncan R R,et al.Changes in membrane polar lipid fatty acids of seashore paspalum in response to low temperature exposure[J].Crop.Sci.,2002,42(6):2 031-2 037.
[22] Oldenhof H,Wolkers W F,Fonseca F,et al.Effect of sucrose and maltodextrin on the physical properties and urvival of air-dried Lactobacillus bulgaricus:An in situ fourier transform infrared spectroscopy study[J].Biotechnology Progress,2005,21(3):885-892.
[23] Samuel B,Eitan I,Bruce L,et al.Trehalose and sucrose srotect both membranes and proteins in intact bacteria during drying[J].Applied and Environmental Microbiology,1995,61(10):3 592-3 597.
[24] Adriana M,Wolfgang D,Rudi F,et al.Protective effect of sucrose and sodium chloride forLactococcuslactis during sublethal and lethal high pressure treatments[J].Appl.Environ.Microbiol,2004,70(4):2 013-2 020.
[25] Romano N,Tymczyszyn E,Mobili P,et al.Bioactive foods in promoting health:Porbiotics,prebiotics and synbiotics,fdition:2nd edition[M].Holland:Elsevier,2016.
[26] 王念念,刘雨生.海藻糖用于玻璃化冷冻卵母细胞的研究[J].国际生殖健康/计划生育杂志,2009,28(3):148-150.
[27] Noori N,Hamedi H,Kargozari M,et al.Investigation of potential prebiotic activity of rye sprout extract[J].Food Bioscience,2017,19:121-127.
[28] Tymczyszyn E E,Gerbino E,Illanes A,et al.Galacto-oligosaccharides as protective molecules in the preservation ofLactobacillusdelbrueckii subsp.bulgaricus[J].Cryobiology,2011,62(2):123-129.
