伴血小板增多胃癌患者临床病理特征及预后因素分析
2018-04-11王瑛段和力
王瑛 段和力
胃癌(gastric cancer,GC)是我国最常见的消化系统恶性肿瘤,在世界范围肿瘤患者死亡率中位居第二位,而在我国位居首位[1]。目前认为其发病机制与遗传易感性、高龄、环境污染及不良饮食习惯等密切相关[2]。我国胃癌发病率呈增高趋势,治疗模式已从单一的手术治疗进入了围手术期多学科协作(multi-disciplinary team,MDT)的新治疗模式[3]。研究发现,包括胃癌在内的多种恶性肿瘤中,均存在一定比例的血小板(platelet,PLT)水平升高患者,一般认为PLT≥400×109/L为肿瘤患者PLT升高的临界值[4-5]。血小板源性生长因子(platelet-derived growth factor,PDGF)及其受体与肿瘤的发生、新生血管生成以及细胞凋亡机制等密切相关,胃癌患者的临床病理分期越晚,血小板增多的可能性越大,且预后较差[6]。本研究分析伴PLT增多胃癌患者病理学特征及影响预后的因素,以期为该病的临床诊疗提供参考。
1 资料与方法
1.1 临床资料
选取2013年1月至2015年1月在我院接受手术治疗的胃癌患者的临床资料。所有患者均经临床及病理学检查明确诊断为原发性胃癌。排除标准:⑴术前接受新辅助化疗;⑵合并其他组织起源的恶性肿瘤;⑶合并严重肝肾功能障碍、造血系统疾病、自身免疫性疾病、脾功能亢进等;⑷术后不能耐受化疗;⑸临床TNM分期IV期;⑹临床资料缺失。共100例患者符合标准纳入研究,根据患者术前PLT水平分为观察组(PLT≥400×109/L)51例和对照组(PLT<400×109/L)49例。本方案获医院伦理委员会批准,患者知情同意并签署知情同意书。
1.2 治疗方法
两组患者均接受我院同一组手术医师所施行的胃癌根治术。术后化疗患者化疗方案:奥沙利铂(0.1g/支,江苏恒瑞)130 mg/m2,静脉滴注,d1;替吉奥胶囊(20 mg/粒,山东新时代药业)80 mg/m2,口服,2次/d,d1~14;休息1周,每3周为1个周期,共6个周期,持续6个月。
1.3 观察指标
收集两组患者一般状况,包括性别、年龄、体重指数(BMI)、数字疼痛分级法(NRS)评分、吸烟史、饮酒史、肿瘤大小、淋巴结转移、肿瘤分化程度、血管癌栓及临床TNM分期等。按标准测量肿瘤最大直径[7]。观察患者术后2年生存和死亡情况,根据测量的肿瘤最大直径行ROC曲线分析,得出临床最优截点为4.95 cm(AUC=0.745),见图1。故本研究采用5 cm为临床近似值,分为肿瘤大小≤5 cm组和>5 cm组。
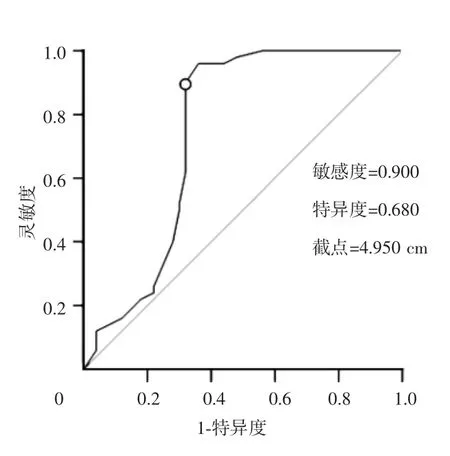
图1 选择最佳胃癌肿瘤大小截点的ROC曲线
两组患者术前均采集静脉血5 mL,检测其凝血功能,包括D-二聚体(d-dimer,D-D)、纤维蛋白原(fibrinogen,FIB)及凝血酶原时间(prothrombin time,PT)。
1.4 统计学方法
采用SPSS 23.0软件对数据进行统计学处理。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验。计数资料比较采用χ2检验。术后累积生存率采用Kaplan-Meier法计算,组间比较行Log-rank检验。多因素Cox回归分析影响患者预后的因素,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床病理特征比较
观察组肿瘤大小>5 cm、临床TNM分期Ⅲ期的患者比例均高于对照组,差异有统计学意义(P<0.05),两组患者在组织类型、肿瘤分化程度、是否合并血管癌栓、有无淋巴结转移等方面比较,差异均无统计学意义(P>0.05)。见表1。
2.2 两组患者凝血功能指标比较
观察组患者PT显著低于对照组(P<0.01),而D-D及FIB水平显著高于对照组(P<0.01)。见表2。

表1 两组患者临床病理特征比较
表2 两组患者凝血功能指标比较(±s)
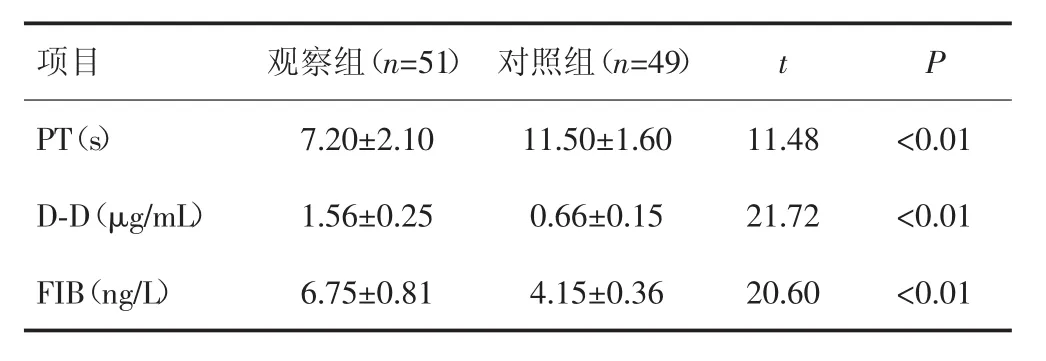
表2 两组患者凝血功能指标比较(±s)
项目观察组(n=51)对照组(n=49)t P PT(s)7.20±2.10 11.50±1.60 11.48<0.01 D-D(μg/mL)1.56±0.25 0.66±0.15 21.72<0.01 FIB(ng/L)6.75±0.81 4.15±0.36 20.60<0.01
2.3 两组患者术后2年生存率比较
随访截至2017年5月1日,失访6例,失访率为5.66%。观察组术后2年生存率显著低于对照组(64.71%vs 83.67%,χ2=4.439,P=0.035),两组生存曲线比较,差异有统计学意义(χ2=197.994,P<0.001)。见图2。
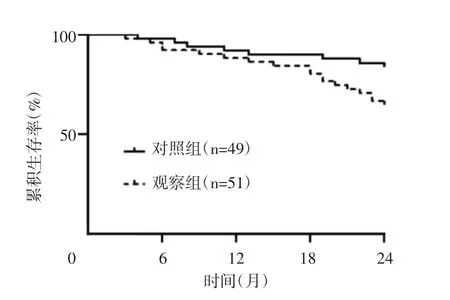
图2 两组患者术后生存曲线比较
2.4 影响胃癌患者生存的单因素分析
单因素分析结果显示,肿瘤大小、临床TMN分期、伴PLT增多、年龄、术后辅助化疗可能与患者预后相关(P<0.05)。见表3。
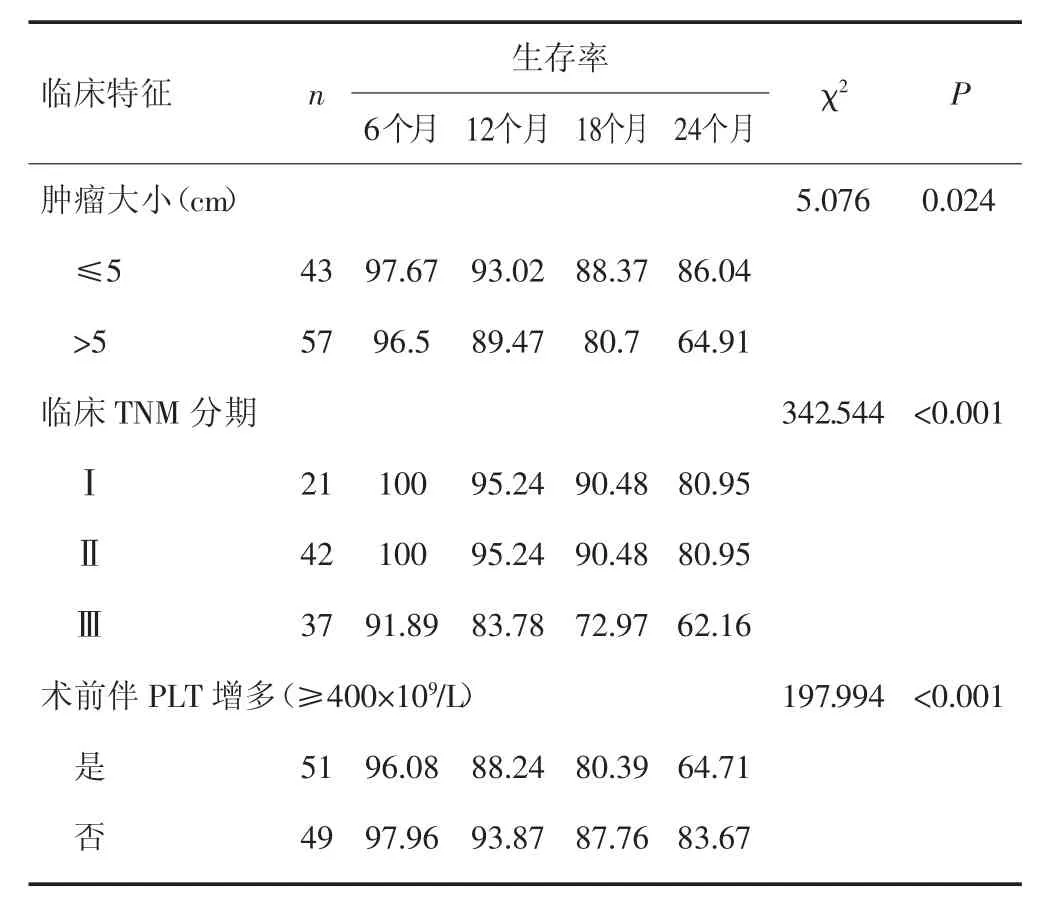
表3 影响胃癌患者生存的单因素分析(%)
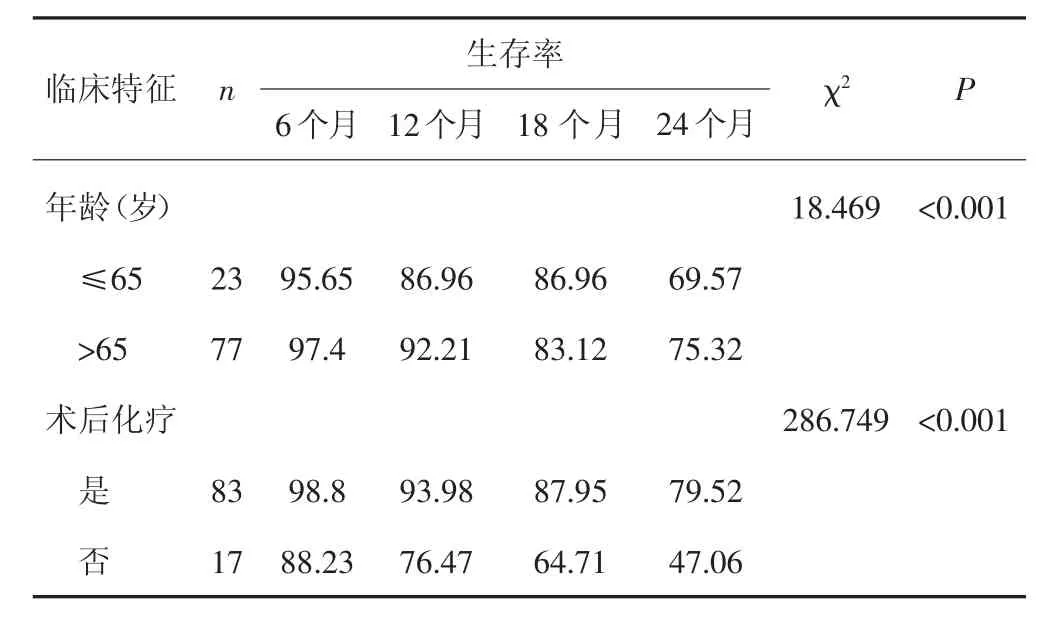
(续表)
2.5 多因素Cox回归分析
多因素分析结果显示,临床TNM分期、伴PLT增多是影响胃癌患者预后的独立危险因素(P<0.05),而术后化疗是其保护因素(HR=0.822,95%CI:0.754~0.896,P<0.001)。见表4。
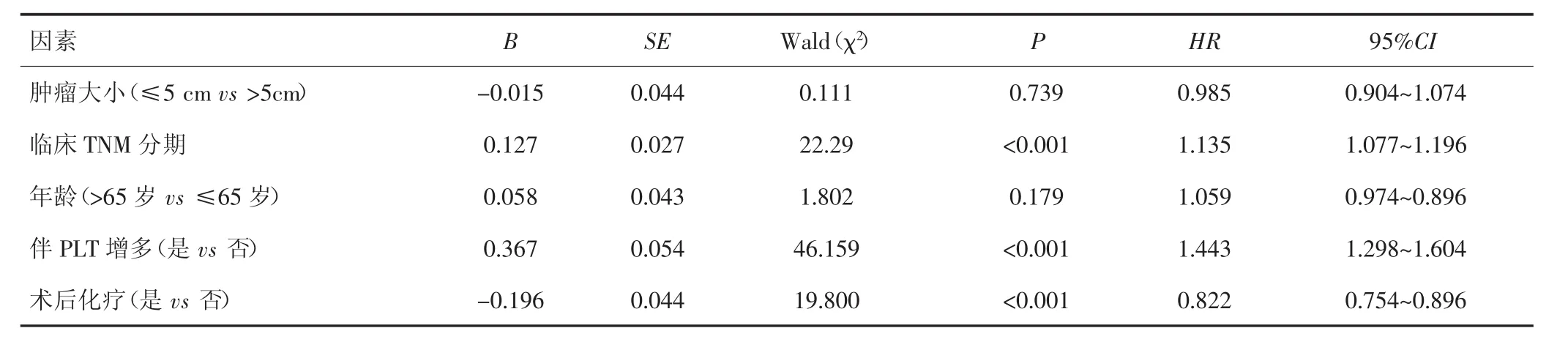
表4 影响胃癌患者生存的多因素Cox回归分析
3 讨论
因种族差异、生活饮食习惯不同,我国胃癌发病率高于欧美发达国家,早期无特异性临床表现,部分患者就诊时错过最佳手术时机。近年来胃镜诊疗技术不断普及,早期胃癌诊断率明显提高,可手术患者增多[8-9]。但胃癌术后5年生存率仍仅为60%左右[10]。恶性肿瘤患者进展期及晚期易伴血小板增多,部分胃癌患者亦如此,这一现象被国内外学者认可[11-12],但具体机制并不清楚。有研究认为胃癌伴血小板增多可能与胃部血供丰富,局部血管内易形成血栓有关。此外,肿瘤引发的免疫反应可间接引起炎症、血小板激活等[5,13]。
本研究结果显示,观察组患者术前PT显著低于对照组,而D-D及FIB水平则显著高于对照组,提示观察组患者可能存在凝血功能亢进,与既往报道结果吻合[14-15]。进一步分析对比两组患者病理学特征发现,观察组肿瘤大小>5 cm及临床TNM分期高的患者比例均高于对照组,术后2年累积生存率显著低于对照组,提示伴PLT增多的胃癌患者肿瘤进展可能更快,预后不良。为进一步明确伴PLT增多是否是胃癌患者预后的独立影响因素,对两组患者进行了单因素及多因素分析,结果显示临床TNM分期、伴血小板增多是影响胃癌患者预后的独立危险因素。Kolev等[16]研究亦发现PLT增多是影响胃癌患者预后的独立危险因素,伴PLT增多的患者肿瘤体积较大,浆膜浸润、淋巴结转移发生率较高,与本研究结果一致。原因可能与伴PLT增多的胃癌患者血液常处于高凝状态,而血栓形成与肿瘤患者形成癌栓、转移,甚至复发有关。但本研究未发现肿瘤大小为影响胃癌预后的独立因素,与其他研究[17]结果不同。可能与本研究样本量有限、随访时间较短有关。
综上所述,伴PLT增多是影响胃癌患者预后的独立危险因素,其可能存在凝血功能障碍,肿瘤进展更快,提示预后不良。但本研究仅为回顾性研究,有关结论尚需进一步研究。
[1] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[2] Huang Q,Zou X.Clinicopathology of early gastric carcinoma:an update for pathologists and gastroenterologists[J].Gastrointest Tumors,2017,3(3-4):115-124.
[3] 周逢强,齐艳美,岳爱学,等.MDT协助下进展期胃癌新辅助化疗对手术影响[J/CD].中华普外科手术学杂志(电子版),2011,5(1):79-86.
[4] Hwang SG,Kim KM,Cheong JH,et al.Impact of pretreatment thrombocytosis on blood-borne metastasis and prognosis of gastric cancer[J].Eur J Surg Oncol,2012,38(7):562-567.
[5] Aldemir MN,Turkeli M,Simsek M,et al.Prognostic value of baseline neutrophil-lymphocyte and platelet-lymphocyte ratios in local and advanced gastric cancer patients[J].Asian Pac J Cancer Prev,2015,16(14):5933-5937.
[6] 李涛.血小板源性生长因子及其受体与胃癌的靶向治疗[J].实用肿瘤学杂志,2013,27(5):476-480.
[7] Bilici A,Uygun K,Seker M,et al.The effect of tumor size on overall survival in patients with pT3 gastric cancer:experiences from 3 centers[J].Onkologie,2010,33(12):676-682.
[8] Grass F,Vuagniaux A,Teixeira-Farinha H,et al.Systematic review of pressurized intraperitoneal aerosol chemotherapy for the treatment of advanced peritoneal carcinomatosis[J].Br J Surg,2017,104(6):669-678.
[9] Maron SB,Catenacci DVT.Update on gastroesophageal adenocarcinomatargetedtherapies[J].Hematol Oncol Clin North Am,2017,31(3):511-527.
[10] Anandappa G,Chau I.Emerging novel therapeutic agents in the treatment of patients with gastroesophageal and gastric adenocarcinoma[J].Hematol Oncol Clin North Am,2017,31(3):529-544.
[11] Xue LJ,Mao XB,Ren LL,et al.Inhibition of CXCL12/CXCR4 axis as a potential targeted therapy of advanced gastric carcinoma[J].Cancer Med,2017,6(6):1424-1436.
[12] 杨超,蔡爱珍,郗洪庆,等.胃癌新辅助化疗前血小板水平与疗效的关系[J].中华普通外科杂志,2016,31(7):593-595.
[13] Kadiyala M,Ponnusankar S,Elango K.Calotropis gigantiea(L.)R.Br(Apocynaceae):a phytochemical and pharmacological review[J].J Ethnopharmacol,2013,150(1):32-50.
[14] Wang L,Huang X,Chen Y,et al.Prognostic value of TP/PD-ECGF and thrombocytosis in gastric carcinoma[J].EurJSurgOncol,2012,38(7):568-573.
[15] Tas F,Ciftci R,Kilic L,et al.Clinical and prognostic significance of coagulation assays in gastric cancer[J].J Gastrointest Cancer,2013,44(3):285-292.
[16] Kolev Y,Uetake H,Iida S,et al.Prognostic significance of VEGF expression in correlation with COX-2,microvessel density,and clinicopathological characteristics in human gastric carcinoma[J].Ann Surg Oncol,2007,14(10):2738-2747.
[17] 李小宝,姬乐,曹波,等.肿瘤大小对各T分期胃癌患者预后影响的分析[J].中国普外基础与临床杂志,2016,23(10):1262-1264.
