绣球菌多糖超声波修饰条件的响应面优化*
2018-04-10王宏雨林衍铨
张 迪,王宏雨,林衍铨
(福建省农业科学院食用菌研究所,福建 福州 350014)
广叶绣球菌(Sparassis latifolia) 是新开发的珍稀食(药)用菌,目前该品种的人工栽培技术已实现了工厂化周年生产,可稳定供应市场。广叶绣球菌(下文简称绣球菌)子实体中含有大量的β-葡聚糖,现有研究表明绣球菌中的β-葡聚糖成分能够提高人体免疫力和造血功能,同时对某些肿瘤也具有一定的预防和抑制作用,具有抗癌、防癌的保健价值[1-2]。通过前期研究发现,绣球菌冻干品中提取的绣球菌多糖分子量高达400 kDa,存在溶解困难、溶液粘度大等缺点,有必要通过适当的分子修饰提高其溶解性,降低溶液粘度,提高活性。
近年来天然多糖的提取、改性以及结构分析成为研究的热点,超声波修饰主要是对多种生物大分子(如葡聚糖、DNA等)进行结构修饰。原理是利用增加质点震动能量来切断生物大分子中的某些特定的化学键(糖苷键),以降低分子量,增加水溶性,提高生物学活性[3-4]。目前关于绣球菌多糖的化学和物理修饰的研究鲜有报道,本文采用超声波对绣球菌多糖进行分子修饰,分析超声波功率、时间、物料浓度对超声波修饰后的绣球菌多糖的DPPH自由基清除率的影响,并以DPPH自由基清除率为考察指标,对绣球菌多糖的超声波修饰条件进行响应面优化,确立较优的超声波修饰工艺条件。
1 材料与方法
1.1 供试材料
绣球菌子实体鲜品,由福建天益菌业有限公司提供。
1.2 试剂与仪器设备
试剂:1,1-二苯基-2-三硝基苯肼DPPH(WAKO公司),实验用水为超纯水,其余试剂均为国产分析纯、色谱纯。
仪器:JY92-IIDN超声波破碎仪,上海净信实业有限公司;Centrifuge 5804-R离心机,德国艾本德公司;EPOCH2TC酶标仪,美国BioTek公司;真空冷冻干燥机,北京博医康有限公司;超纯水器,优普公司。
1.3 试验方法
1.3.1绣球菌多糖制备
干燥:采用真空冷冻干燥对绣球菌鲜品进行干燥,干燥条件为-35℃、预冻24 h,冷阱温度-60℃,搁板温度30℃,干燥时间30 h。收获干品后用高速粉碎机粉碎过60目筛,备用。
热水提取:料液比1∶15,100℃水浴搅拌提取2 h,一次投料量为50 g干粉。提取液过滤后滤液经8000 r·min-1、离心10 min取上清,减压浓缩至原体积一半后加入4倍体积95%的乙醇醇沉过夜,醇沉液8000 r·min-1离心20min取沉淀,沉淀真空干燥后即得绣球菌粗多糖。绣球菌粗多糖用蒸馏水复溶为 15 mg·mL-1的溶液,8000 r·min-1离心 10 min取上清液备用。
脱蛋白:采用三氯乙酸法[5],取浓度15mg·mL-1的绣球菌粗多糖液,加入糖液体积10%的40%TCA溶液,混匀静置30 min,8000 r·min-1离心20 min,弃沉淀,重复3次。脱蛋白后的多糖用4倍体积乙醇醇沉,再用丙酮洗涤沉淀2次,真空干燥后得到绣球菌多糖。
1.3.2绣球菌多糖的DPPH自由基清除能力的测定
参考王金玺[6]的方法略作改动,采用96孔板进行测定,将待测样品统一稀释至质量浓度2mg·mL-1进行测定,每孔样品溶液150μL,加入50μL用无水乙醇配制的DPPH溶液(2.5×10-4mol·L-1),振荡混匀后置于暗处,室温下反应30 min,用无水乙醇调零,在波长517 nm处测定吸光值记为Ax;空白组中的样品用50μL无水乙醇替代,其余处理同上,在波长517 nm处测定吸光值记为A0;对照组中的DPPH溶液用50μL无水乙醇替代,其余处理同上,在波长517 nm处测定吸光值记为Ax0,每个样品溶液平行试验3次。
DPPH自由基清除率(SR)公式为:
1.3.3绣球菌多糖超声波修饰的响应面优化试验
在前期单因素试验的基础上,采用Design Expert 8.0软件,根据Box-Behnken中心设计原理,设计三因素三水平响应面分析试验。以绣球菌多糖的DPPH自由基清除率为响应值,料液浓度、超声功率、超声时间3个因素作为自变量,对绣球菌多糖的超声波修饰工艺条件进行优化分析。
2 结果与分析
2.1 绣球菌多糖超声波修饰的响应面试验结果
通过Design Expert8.0统计软件,采用三因素三水平的响应面进行设计,考虑各因素间的交互作用以及各因素对DPPH自由基清除率的影响,试验设计如表1和表2所示。

表1 响应面试验因素编码和水平Tab.1 Factors code and levels of variablels for response surface test
通过对试验结果进行拟合,得到DPPH自由基清除率与料液浓度、超声功率、超声时间之间的二次多元回归模型:
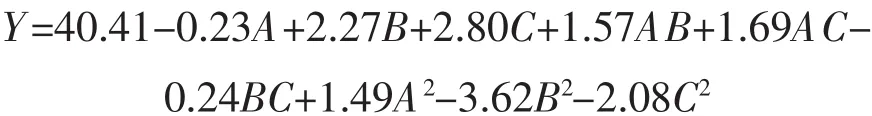
经Design Expert 8.0软件对17个点的绣球菌多糖的DPPH自由基清除率进行回归统计分析得出回归模型方差分析表,如表3所示。

表2 响应面分析试验设计与结果Tab.2 Design and results of response surface analysis
从表3可见,回归模型P<0.01(P=0.0065),达到极显著水平,失拟项P>0.05(P=0.0862) 不显著,R2=0.9092,拟合程度尚可,说明该模型成立,理论推测可用。回归方程系数显著性检验结果表明,方程中的超声时间(C)、超声功率(B) 及其二次项(B2),对DPPH自由基清除率具有极显著的影响(P<0.01);超声时间的二次项(C2)对DPPH自由基清除率影响显著(P<0.05),其他变量对DPPH自由基清除率的影响均不显著(P>0.05)。由回归方程可知对DPPH自由基清除率影响最大的因素为超声时间,其次超声功率,而料液浓度对提取率的影响不显著。交互作用方面,超声处理的料液浓度、功率、时间三者间的所有交互作用对多糖的DPPH自由基清除率的影响均不显著。

表3 回归模型的变量方差分析表Tab.3 The ANOVA table of variates
2.2 响应面数据分析和最优工艺条件的确定
等高线的形状可反映因素之间交互效应的强弱,椭圆形的表示2个因素交互作用强,圆形的则说明2个因素交互作用弱[6]。各因素响应面图和等高线图见图 1~图 3。
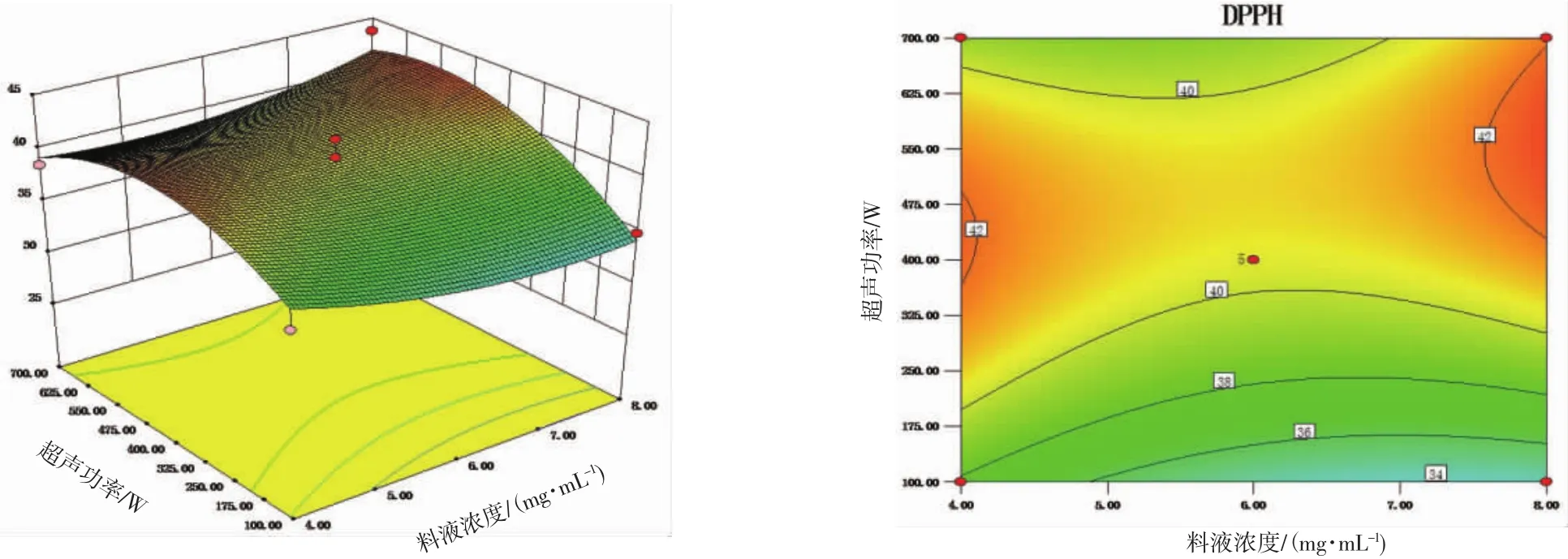
图1 超声功率、料液浓度的响应面图和等高线图Fig.1 Response surface 3D and corresponding contourmap of the ultrasonic treatment power and concentration

图2 超声时间、料液浓度的响应面图和等高线图Fig.2 Response surface 3D and corresponding contourmap of the ultrasonic treatment time and concentration
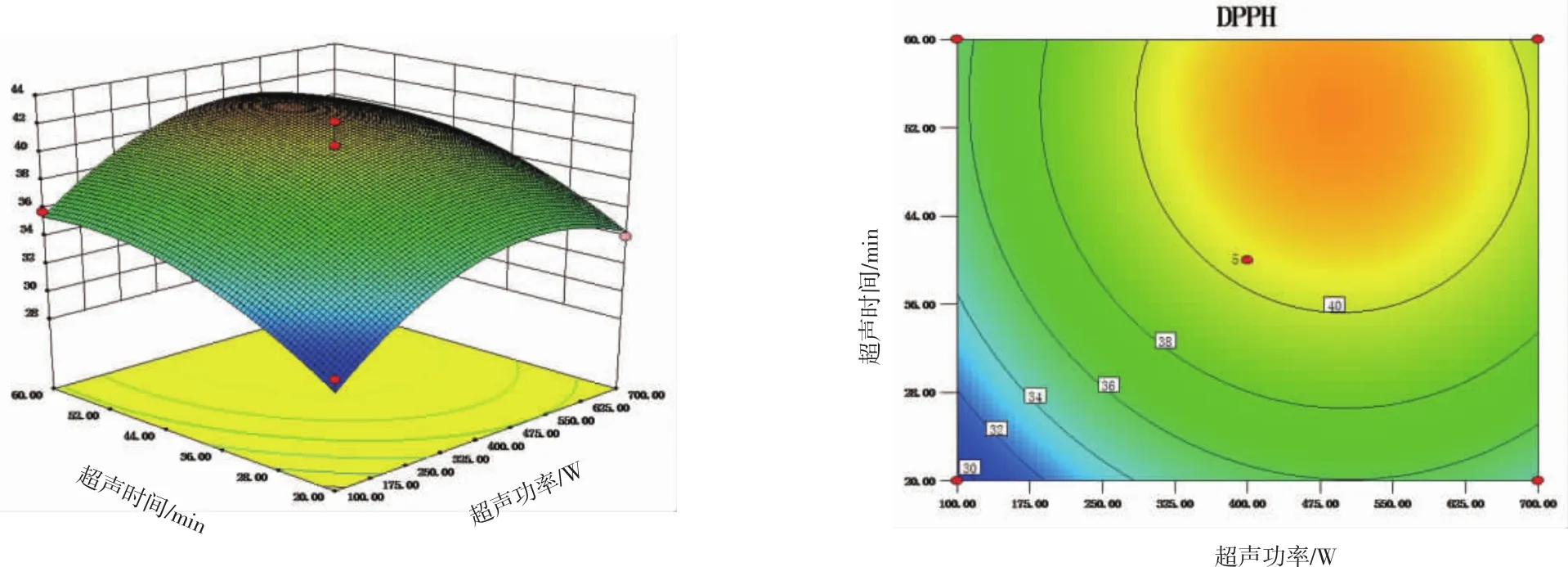
图3 超声时间、超声功率的响应面图和等高线图Fig.3 Response surface 3D and corresponding contourmap of the ultrasonic treatment time and power
由图1、图2可知,DPPH自由基清除率的极大值都出现在相关因素的高水平组合区间,由等高线可见在高水平区间内的料液浓度与超声功率、超声时间间存在一定的互作,但方差分析显示这些互作效应对模型中的DPPH自由基清除率的影响均不显著。由图3可见,超声功率和超声时间间基本无互作作用,与方差分析结果相符。
由图1可见,随着超声波处理功率的增大,绣球菌多糖的DPPH自由基清除率出现了先增大后下降的趋势,这可能是由于超声波功率过大引起多糖分子交联,使抗氧化作用下降所致[7]。超声波作用于糖苷键使其发生断裂是渐进的过程,在功率、糖苷键数量恒定的条件下糖苷键断裂的数量随着超声时间的增加而增加,逐渐达到饱和值,这与图2所示绣球菌多糖的DPPH自由基清除率随着超声时间的增加而提高,最终趋于稳定,仅出现轻微的下降的情况是相符的。
利用回归方程进行优化求解,得到超声波修饰后,绣球菌多糖的DPPH自由基清除率最高预测值为44.96%,对应的最佳工艺条件为:料液浓度8 mg·mL-1,超声波功率548.82W,超声时间60 min。根据实际操作条件选取料液浓度8mg·mL-1,超声波功率550W,超声时间60 min的工艺条件进行3次验证试验取平均值,试验结果表明超声波修饰后的绣球菌多糖的DPPH自由基清除率平均值为44.43%,与预测值44.96%接近,拟合度良好,较超声修饰前的18.73%提高了2.37倍。
3 结论
采用响应面法分析了料液浓度、超声功率和超声时间3个因素对绣球菌多糖DPPH自由基清除率的影响,得到DPPH自由基清除率预测值(Y)与料液浓度、超声功率和超声时间的二次多元回归方程:

回归方程中的超声时间(C)、超声时间的二次项(C2)、超声功率(B)及其二次项(B2),对绣球菌多糖的DPPH自由基清除率具有显著的影响,其他变量对清除率的影响均不显著。3个因素对清除率的影响大小依次为:超声时间>超声功率>料液浓度。
通过回归方程优化后确定最佳脱色工艺条件为:脱料液浓度8 mg·mL-1,超声功率550W,超声时间60 min,该条件下绣球菌多糖的DPPH自由基清除率由未超声修饰的18.73%提高到44.43%,提高了2.37倍。
参考文献:
[1]Kimura T.Natural products and biological activity of the pharmacologicallyactivecauliflower mushroomSparassis crispa[J].BioMed Research Intermational,2013,8(3):501-508.
[2]Kim HS,Kim JY,Ryu HS,et al.Induction of dendritic cell maturation by β-glucan isolated fromSparassis crispa[J].International Immunopharmacology,2010,10(10):1284-1294.
[3]王兆梅,李琳,郭祀远,等.多糖结构修饰研究进展[J].中国医药工业杂志,2002,33(12):616-620.
[4]赖萍,林跃鑫.天然多糖分子修饰研究进展[J].生命的化学,2003,23(3):183-187.
[5]朱美静,童群义.猴头多糖脱蛋白方法的研究[J].河南工业大学学报:自然科学版,2005,26(4):25-27.
[6]王金玺.菇多糖分离纯化、结构表征与修饰及抗氧化性的研究[D].扬州:扬州大学,2013:21-46.
[7]王振斌.无花果多糖的提取、超声波修饰及分离纯化[D].苏州:苏州大学,2013:24-27.
