柠檬皮中柠檬苦素的提取及其抑菌稳定性研究
2018-04-10白卫东冯卫华曾晓房于立梅陈利红
张 贝,白卫东,2,冯卫华,2*,曾晓房,2,于立梅,韩 珍,陈利红
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.广东中兴绿丰发展有限公司,广东河源 517000;3.广东省梅州市飞龙果业有限公司,广东梅州 514000)
柠檬是芸香科柑橘属的主要品种,它富含维生素 C、柠檬橙和钠元素等,经常食用柠檬可以防止消化不良、降脂、预防肿瘤和改善血液循环等功效,因此,柠檬也被称为世界上最有药用价值的水果之一[1]。我国是柠檬种植最大的地区,柠檬的产业发达,但由于柠檬皮与籽含有苦味,通常被当作生活垃圾丢弃。随着国内外学者的深入研究,发现柠檬皮与籽中的柠檬苦素含量丰富,柠檬苦素是植物次生代谢时生成的一类含呋喃环且高度氧化的四环三萜类化合物,存在于柑橘属多种植物中,迄今为止已分离出大约300种柠檬苦素类化合物[2],据研究表明有明显的抗肿瘤、镇痛、抗炎等药理作用[3],也是引起柑橘类果汁味苦的主要物质[4]。研究人员已从柑橘属中分离出37种柠檬苦素类似物和22种配糖体[5-6]。目前,人们对柠檬苦素的研究主要集中在芸香科植物各种属及不同部位柠檬苦素的提取工艺、含量、抑菌活性、抗氧化性及其在食品工业应用等方面,柠檬苦素和其他柠檬苦素类化合物均可作为大部分农作物的杀虫剂、拒食剂、生长调节剂,而这些柠檬苦素类化合物还可提高其他生物杀虫剂和常规杀虫剂的效果[7-9]。
目前,我国对于柠檬苦素的研究还处于初级阶段,研究主要集中在柠檬苦素在植物各组分中的含量及其抗氧化性、抑菌性等方面。日本、美国已报道了柠檬苦素类物质制作功能性食品和饮料的专利,我国对其生理活性和开发利用的报道甚少,而柠檬苦素在市场上的需求却明显增加,所以开发柠檬苦素具有十分重要的现实意义。笔者利用正交优化方案,得到一种高效快速在柠檬果皮中提取柠檬苦素的方法,同时以其提取液对7种菌进行抑菌试验筛选,旨在为柠檬的开发利用和柠檬苦素的高效提取提供理论依据和参考。
1 材料与方法
1.1材料
1.1.1原料及主要试剂。柠檬皮粉,由广东中兴绿丰发展有限公司提供。柠檬苦素标准品、石油醚、无水乙醇、对-二甲氨基苯甲醇、浓硫酸、三氯化铁、大肠杆菌、金黄色葡萄球菌、沙门氏菌、枯草芽孢杆菌、根霉、青霉和黑曲霉。细菌:营养琼脂培养基,营养肉汤培养基;霉菌:PDA培养基,马铃薯葡萄糖水培养基。
1.1.2主要仪器。电子天平、电热干燥箱、UV759紫外可见分光光度仪、THZ-82冷冻水浴恒温振荡器、牛津杯、无菌超净工作台、BXM-30R立式压力蒸汽灭菌器、SP-250生化培养箱、SPH-103B恒温培养摇床。
1.2提取方法
1.2.1提取工艺流程。新鲜柠檬皮烘干→磨粉,过40目筛→60 ℃石油醚浸泡2 h脱脂→90%乙醇浸提→真空旋蒸→二氯甲烷除杂→旋蒸得结晶。
1.2.2正交试验设计。以乙醇为提取剂,以提取剂浓度、提取料液比和浸提时间3个单因素进行L9(34)正交试验,所得柠檬苦素提取液以柠檬苦素含量为指标确定最佳提取工艺,正交试验因素水平设计见表1。
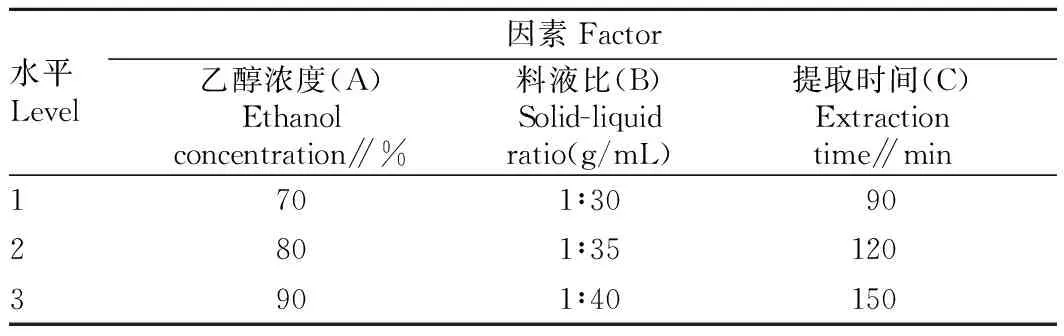
表1 正交试验因素水平设计
1.2.3显色剂Ehrlich试剂的配制。A液:准确称取125 mg 对-二甲氨基苯甲醛溶于100 mL硫酸乙醇溶液中(浓硫酸65 mL,无水乙醇35 mL,放冷使用);B液:准确称取三氯化铁9.0 g,蒸馏水定容至100 mL。使用时在A液中加入0.05 mL B液,现配现用。
1.2.4柠檬苦素含量的测定。柠檬苦素标准品以无水乙醇配成250 μg/mL的标准工作溶液,在6支试管中分别加入0、0.5、0.8、1.2、1.5、2.0标准溶液,分别加入无水乙醇至2.0 mL,再分别加入5.0 mL显色试剂Ehrlich试剂摇匀,在室内静置30 min避免阳光直射,在波长500 nm下测定分光度。以柠檬苦素空白为参比,测定其吸光度,以柠檬苦素含量为横坐标,吸光度为纵坐标绘制标准曲线。
1.3抑菌性试验
1.3.1菌悬液制备。将大肠杆菌、金黄色葡萄球菌、沙门氏菌和枯草芽孢杆菌接种到营养肉汤培养基中,于37 ℃下培养1 d备用,将根霉、青霉和黑曲霉接种到马铃薯葡萄糖水培养基中,于28 ℃下培养2 d备用。
1.3.2抑菌试验。 牛津杯法:用无菌移液枪取1 mL菌悬液与50 ℃已灭菌的10 mL培养基在无菌培养基中,充分摇晃混匀,常温下静置至培养基凝固后,取对角位置安放4个灭菌的牛津杯,分别加入20 μL柠檬苦素,分别在28和37 ℃下培养1和2 d,观察抑菌圈直径大小,重复3次取平均值。
1.3.3紫外线对抑菌活性的影响。用无菌移液枪取1 mL菌悬液与50 ℃已灭菌的10 mL培养基在无菌培养基中,充分摇晃混匀,常温下静置至培养基凝固后,取对角位置安放4个灭菌的牛津杯,分别加入在紫外线下处理0、10、15、20、25、30 min的最小抑菌浓度的柠檬苦素提取液20 μL,分别在28和37 ℃下培养1和2 d,观察抑菌圈直径大小,重复3次取平均值。
1.3.4pH对抑菌活性的影响。用无菌移液枪取1 mL菌悬液与50 ℃已灭菌的10 mL培养基在无菌培养基中,充分摇晃混匀,常温下静置至培养基凝固后,取对角位置安放4个灭菌的牛津杯,分别加入将pH调为2.7、4.0、6.0、8.0的最小抑菌浓度的柠檬苦素提取液20 μL,分别在28和37 ℃下培养1和2 d,观察抑菌圈直径大小,重复3次取平均值。
1.3.5温度对抑菌活性的影响。用无菌移液枪取1 mL菌悬液与50 ℃已灭菌的10 mL培养基在无菌培养基中,充分摇晃混匀,常温下静置至培养基凝固后,取对角位置安放4个灭菌的牛津杯,分别加入经常温、45、60、80、121 ℃热处理15 min的最小抑菌浓度的柠檬苦素提取液20 μL,分别在28和37 ℃下培养1和2 d,观察抑菌圈直径大小,重复3次取平均值。
2 结果与分析
2.1提取正交试验结果取去脂烘干的柠檬皮粉样品9份,各5 g,以提取剂浓度、提取料液比和浸提时间3个单因素做正交提取试验,结果见表2。
表2柠檬果皮中柠檬苦素提取的L9(34)正交试验
Table2OrthogonaltestofL9(34)extractionoflimonininlemonpeel
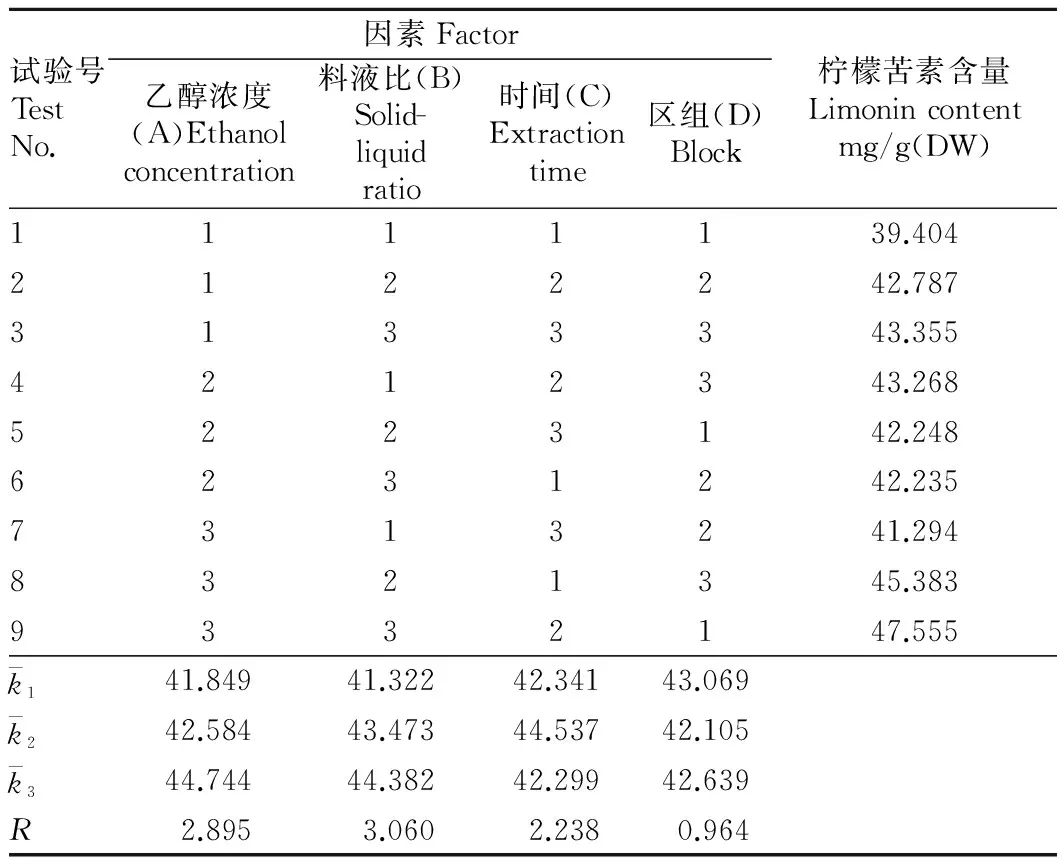
试验号TestNo.因素Factor乙醇浓度(A)Ethanolconcentration料液比(B)Solid-liquidratio时间(C)Extractiontime区组(D)Block柠檬苦素含量Limonincontentmg/g(DW)1111139.4042122242.7873133343.3554212343.2685223142.2486231242.2357313241.2948321345.3839332147.555k141.84941.32242.34143.069k242.58443.47344.53742.105k344.74444.38242.29942.639R2.8953.0602.2380.964
根据正交试验可以得出,料液比为影响柠檬苦素提取的最大因素,其次是乙醇浓度,提取时间又次之,即B>A>C,由于最佳提取条件包括在正交试验9组试验中,所以不需要进行验证试验。因此,柠檬苦素最佳提取条件为A3B3C2,即乙醇浓度90%,料液比1∶40(g/mL),提取时间 120 min;最优提取条件下,柠檬皮粉柠檬苦素的提取理论值为47.555 mg/g(DW)。
2.2抑菌试验结果
2.2.1最小抑菌浓度确定。将柠檬苦素提取液以二氯甲烷萃取除杂后真空旋蒸,再稀释成一定倍数的10%无水乙醇溶液,以15%无水乙醇做空白对照,结果见表3。
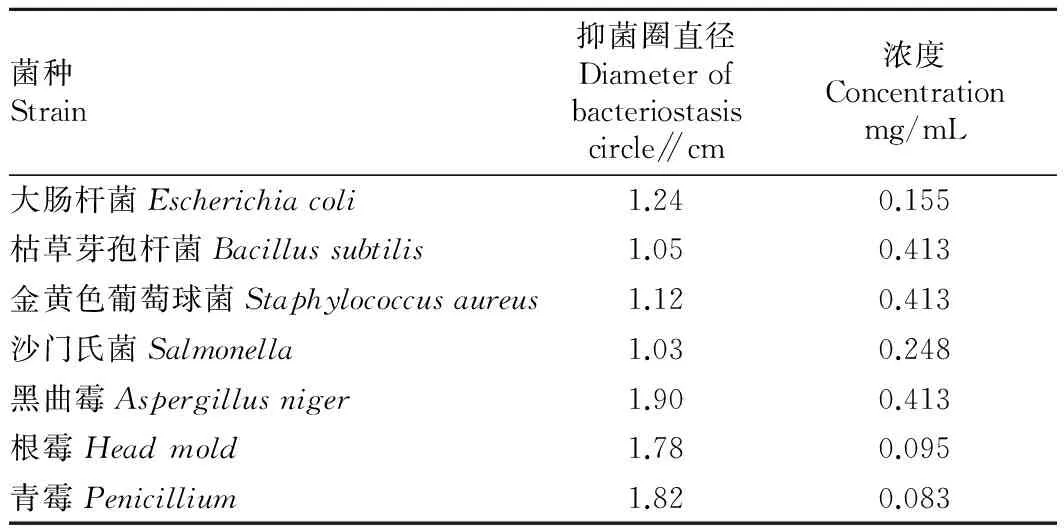
表3 各菌种最小抑菌浓度
从表3可以看出,柠檬苦素对这7种菌都有一定抑制效果,且由抑菌圈直径大小可以看出对霉菌的抑制效果远大于细菌。
2.2.2紫外线处理对抑菌活性的影响。将最小抑菌浓度的柠檬苦素在紫外线下处理0、10、15、20、25、30 min,分别接种大肠杆菌、金黄色葡萄球菌、沙门氏菌、枯草芽孢杆菌、根霉、青霉和黑曲霉,培养一定时间后,观察抑菌圈直径大小,平行3次测定结果见图1。
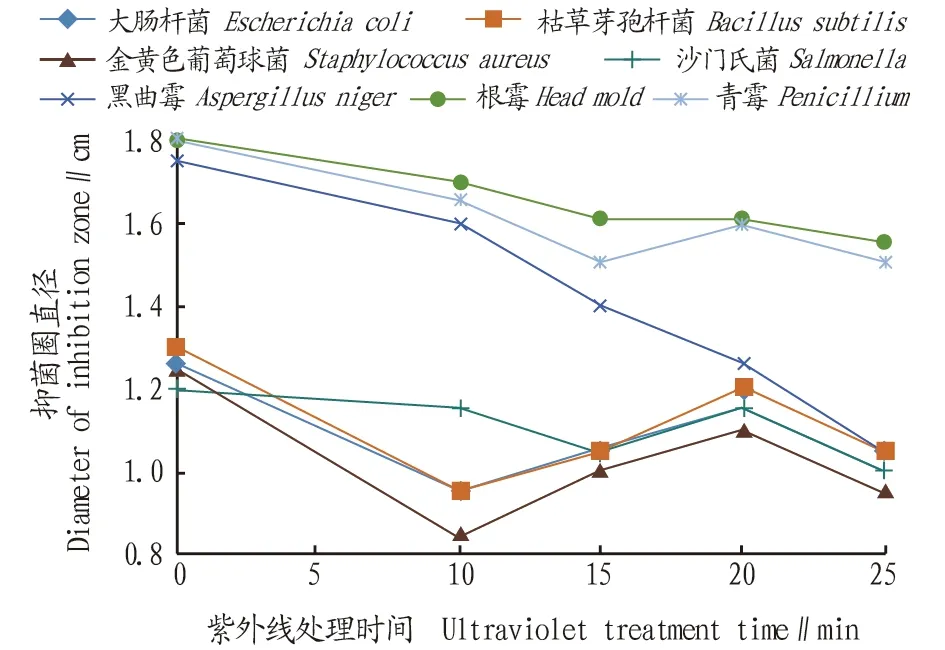
图1 紫外线处理对抑菌活性的影响Fig.1 Effect of UV treatment on bacteriostatic activity
从图1可知,随紫外线处理时间增加,因紫外线照射破坏了柠檬苦素和细菌的抑菌活性,导致霉菌抑菌圈直径呈现出大体下降的趋势,而细菌抑菌圈先下降后在15 min时回升,但达不到未处理时的直径大小。可能是因为提取液为化合物,紫外线激发了其他柠檬苦素类物质的抑菌活性,导致抑菌效果再次增强。由图1可看出,紫外线处理对柠檬苦素的抑菌效果影响较大。
2.2.3pH处理对抑菌活性的影响。将最小抑菌浓度的柠檬苦素以缓冲剂调整pH至2.7、4.0、6.0、8.0,分别接种大肠杆菌、金黄色葡萄球菌、沙门氏菌、枯草芽孢杆菌、根霉、青霉和黑曲霉,培养一定时间后,观察抑菌圈直径大小,平行3次测定结果见图2。
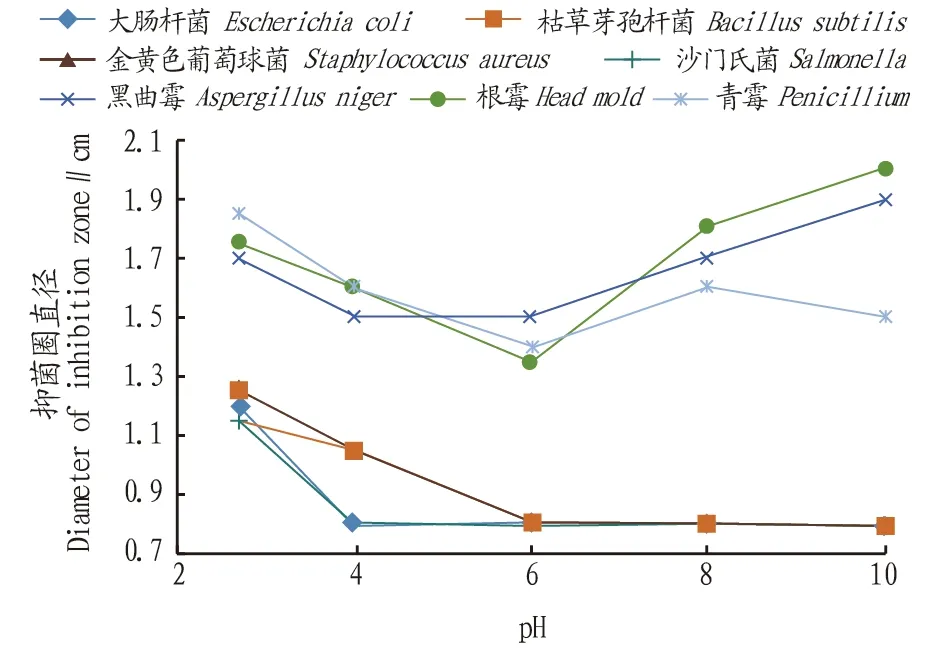
图2 pH处理对抑菌活性的影响Fig.2 Effect of pH treatment on bacteriostatic activity
从图2可以看出,柠檬苦素在酸性条件下抑菌效果更好,在pH>6以后几乎对3种细菌无抑制效果,对霉菌pH偏酸性时随pH增大而抑制效果减弱;但在pH>6以后,因使其他抑制剂的活性减弱,提取液中其他物质的抑菌效果增强。
2.2.4温度处理对抑菌活性的影响。将最小抑菌浓度的柠檬苦素在室温,分别接种大肠杆菌、金黄色葡萄球菌、沙门氏菌、枯草芽孢杆菌、根霉、青霉和黑曲霉,培养一定时间后,观察抑菌圈直径大小,平行3次测定结果见图3。

图3 温度处理对抑菌活性的影响Fig.3 Effect of temperature treatment on bacteriostatic activity
从图3可以看出,随着温度逐渐升高,抑制了柠檬苦素的活性,导致柠檬苦素的抑菌效果显著降低,在80 ℃以后,由于高温破坏了柠檬苦素类物质的活性,已基本失去抑菌效果。
3 结论
柠檬皮中柠檬苦素类物质以90%乙醇溶液在料液比为1∶40(g/mL)、提取温度为60 ℃、提取120 min的条件下,提取量可达到47.555 mg/g,对比令红艳等[7]的研究结果萃取温度为188.3 ℃,物料粒径为71.3目,料液比值为1∶23.3(g/mL)工艺更简单快捷,且柠檬苦素提取率更佳。柠檬苦素类物质抑菌稳定性受温度影响较大,随着温度升高对细菌霉菌的抑制效果降低,在80 ℃已基本无效果;对霉菌的抑制效果受紫外线照射时间影响,随照射时间增加而抑菌活性降低;对4种细菌在酸性条件下抑制效果更佳,随pH上升活性减弱,在pH>6时基本无抑制效果。
[1] 蔡护华,桥永文男.柑桔果实中柠檬苦素类化合物的研究现状与展望[J].植物学报,1996,38(4):328-336.
[2] HASHINAGA F,FONG C F,HASEGAWA S.Biosynthsis of limonoids inCitrussudachi[J].Agri Biol Chem,1990,54(11):3019-3020.
[3] 王青山,邓放明.柠檬苦素类似物的研究概况[J].天然产物研究与开发, 2008,20(B05):160-165.
[4] 李思义.柑桔柠檬苦素类似物[J].广西热作科技,1999(2):21-25.
[5] 赵雪梅,费洪荣,王桂玲,等.柑桔属中柠檬苦素类化合物研究进展[J].中国药房,2007,18(36):2860-2862.
[6] 李赤翎,俞建,蒋雪薇,等.柠檬苦素类似物糖苷的抗菌与抗氧化作用研究[J].食品科技,2008(5):154-156.
[7] 令红艳,封家福,张知贵.柑橘籽类柠檬苦素提取工艺及其体外抗肿瘤研究[J].食品工业,2013,34(8):57-59.
[8] NAKAGAWA H,DUAN H Q,TAKAISHI Y.Limonoids fromCitrussudachi[J].Chemical & pharmaceutical bulletin,2001,49(5):649-651.
[9] OHTA H,BERHOW M,BENNETT R D,et al.Limonoids in seeds ofCitrushanaju[J]. Phytochemistry,1992,31(11):3905-3907.
