烟草H2A的序列分析、原核表达载体构建及诱导表达
2018-04-10童文艳徐林娜乔慧聪
童文艳,徐林娜,乔慧聪,李 芬
(河南师范大学生命科学学院,河南新乡 453007)
烟草H2A序列来自于以 NtTkr尾部为诱饵进行的酵母双杂交筛选,NtTkr与新发现的烟草驱动蛋白家族成员12(kinesin-12 subfamily)NtKrp序列一致,在分裂旺盛的组织和发育各时期胚中表达,可调控细胞周期进程,进而影响胚、种子大小与萌发[1]。NtTkr有3个卷曲螺旋结构,尾部卷曲螺旋中 1 084 位的 T 缺失或突变会影响其分布,而这一改变是受与其结合的蛋白底物的影响。已知驱动蛋白是一类蛋白质超家族,属于分子马达的一种,其“头部”具有ATP酶活性,能通过水解ATP获得能量,在细胞内执行着多种功能[2],如细胞内细胞器及大分子沿微管的定向输运、核融合、细胞分裂过程中染色体的移动、纺缍体的形成、神经元的发育以及发育过程中成形素的分布等均与驱动蛋白家族密切相关[3-4]。已知与细胞运动直接相关的马达蛋白有3种:驱动蛋白、肌球蛋白、动力蛋白,它们既负责真核细胞的运动,也参与胞内物质的定向运输、细胞分裂、形态建成等重要生物学过程,而这些功能都与其卷曲螺旋结构有直接的关系。
NtTkr共有3个卷曲螺旋结构,其中卷曲螺旋CC1和CC2形成茎杆结构,尾部的CC3(1 049~1 143Aa)可能参与靶蛋白的相互作用。因为酵母双杂交分析发现缺失和替换1 084位T在酵母细胞中可影响NtTkr与候选蛋白的结合强度。
为进一步检测 NtTkr全长、尾部、T1084替换或缺失的尾部与候选蛋白之间的相互作用,笔者对H2A进行了序列分析及蛋白结构域分析,并将其克隆入pGEX4T-1 原核表达载体进行诱导表达,为运用Pull Down 验证其相互作用进而确定NtTkr与底物互作的关键结构域奠定基础。
1 材料与方法
1.1材料
1.1.1菌株与质粒。以NtKkr 尾部为诱饵双杂交获得的阳性克隆F35-1,大肠杆菌DH5α和BL21;PGEX-4T-1质粒。
1.1.2工具酶与主要试剂。BamH I、XhoI 限制性内切酶和KOD-plus高保真酶,X-gal,IPTG,回收试剂盒,T4DNA 连接酶,RnaseA,dNTP 等均购自ToYoBo公司。
1.2方法
1.2.1信息查询。在美国国立生物信息中心数据库(http://www.ncbi.nih.gov/BLAST/)中,寻找与F35-1插入序列最为接近的核苷酸序列。
1.2.2同源性比较。运用Bioedit软件将F35-1插入序列与拟南芥H2A的Aa进行同源性比较。
1.2.3蛋白功能结构域分析。利用EMBL的SMART软件(http://smart.embl-heidelberg.de/)进行蛋白功能结构域分析。
1.2.4PCR片段的获得。扩增引物由 TaKaRa 生物工程公司合成,合成产物经PAGE纯化,其序列如下:5’端引物为p1:5’-NNNNggATCCTCAACAACAGCAACCAAA-3’;3’端引物为 p2:5’- NNNNCTCgAgCTGAGAAATAGAGGCAA-3’。引物两端分别加上BamH I 和XhoI 共2个酶切位点;以pGADT-Rec-F35-1质粒为模板,PCR 扩增获得目的片段。
1.2.5表达质粒pGEX-4T-H2A的构建和鉴定。将pGEX-4T-1和PCR产物经BamH I和XhoI酶切、凝胶回收4 969 bp的pGEX-4T-1载体和414 bp 的目的片段,在T4DNA连接酶作用下16 ℃连接16 h,连接产物转化大肠杆菌DH5α超感细胞,经酶切鉴定筛选正确的重组质粒 pGEX-4T-H2A,送北京三博远志生物技术有限责任公司测序。
1.2.6目的蛋白的诱导表达及SDS-PAGE检测。将测序无突变的重组质粒转化入 BL21(DE3)感受态细胞,在50 mg/mL氨苄青霉素LB平板上挑取单克隆,37 ℃、180 r/min 过夜培养,次日1∶100稀释菌液,培养4 h左右至OD600=0.8时,分别经0.10、0.08、0.06、0.04、0.02 mmol/L的IPTG 于37 ℃诱导 4 h 后, 取菌液2 mL,1 000 r/min、4 ℃离心1 min,弃上清,菌体中加入还原型2×SDS上样缓冲液和去离子水各100 μL,混匀后煮沸 10 min,取15 μL 样品进行SDS-PAGE分析。
2 结果与分析
2.1H2A序列分析将以 NtKrp 尾部为诱饵进行酵母双杂交筛选得到的阳性克隆 F35-1 测序,发现其插入片段大小为610 bp,经ORF finder 序列分析同时结合真核基因的特点可以确定该序列含有1个长度为426 bp 的编码框,编码142个Aa 和1个终止密码子。其序列如图1所示。
通过Blast发现,F35-1的核苷酸和氨基酸序列均与拟南芥的组蛋白H2A有很高的一致性,该基因的CDS全长为426 bp,编码142个氨基酸。二者的同源性比较见图2,其氨基酸的一致性为74%,相似性为88%。蛋白结构域分析表明,该蛋白含H2A结构域,参与组蛋白核心八聚体的组成,对应核苷酸序列为烟草H2A的编码基因。

图1 H2A序列Fig.1 H2A sequence
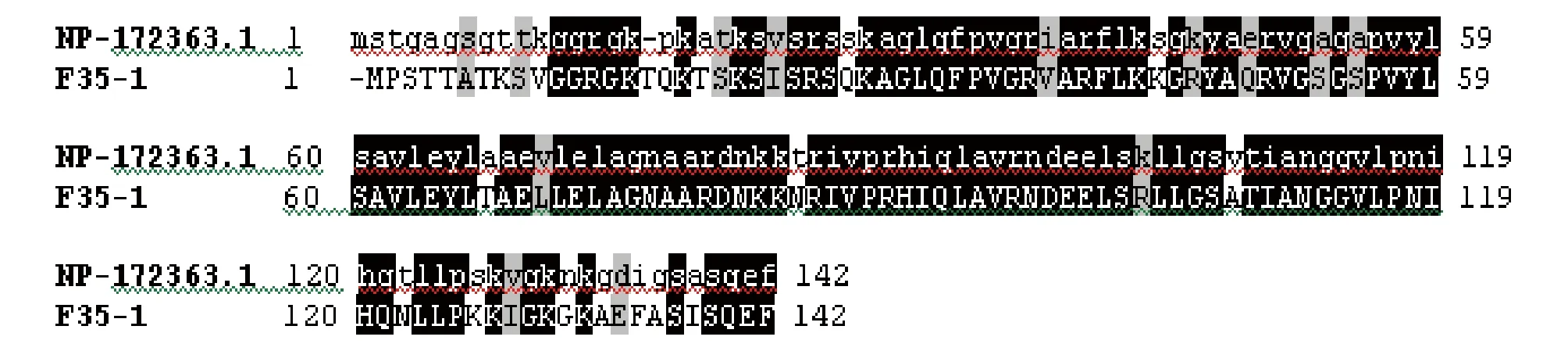
注:F35-1为阳性克隆基因; NP_172363.1为拟南芥组蛋白H2A基因;灰色为相似性;黑色为相同性Note:F35-1 was positive clone gene; NP_172363.1 was Arabidopsis histone H2A gene;Gray was similarity;Black was homogeny图2 F35-1与拟南芥组蛋白H2A基因的氨基酸序列分析Fig.2 Amino acid sequence analysis of F35-1 and Arabidopsis histone H2A gene
2.2烟草H2A全长的克隆、酶切与电泳回收以质粒pGADT-Rec-F35-1为模板进行PCR扩增,经过1.2%琼脂糖凝胶电泳鉴定(图3),得到414 bp的扩增带,与预期大小相符。运用引入引物两端的PCR产物,经BamH Ⅰ和XhoⅠ双酶切,电泳回收得到用于连接的H2A-414片段。
2.3原核表达载体的构建与鉴定BamH Ⅰ和XhoⅠ双酶切的pGEX-4T-1凝胶回收4 969 bp 载体片段,将其与“2.2”同样双酶切的H2A-414片段进行连接反应,连接产物转化DH5α感受态细胞,BamH Ⅰ和XhoⅠ双酶切鉴定重组质粒,得到4 969 bp的载体片段和414 pb的H2A全长(图4),测序无突变,表明得到正确的原核表达载体pGEX-4T-H2A。
2.4H2A的诱导表达重组质粒pGEX-4T-H2A转化到大肠杆菌BL21(DE3)感受态,转化子经0.10、 0.08、0.06、0.04、0.02 mmol/L的IPTG诱导培养4 h后收集菌体,煮沸后经12% SDS-PAGE检测蛋白的表达。结果表明大于0.06 mmol/L IPTG浓度诱导后表达的蛋白量几乎相当,都可高效表达约38 kD的烟草H2A蛋白(图5)。

注:1 .λ-Eco T14 Marker;2.PCR产物Note:1.λ-Eco T14 Marker;2.PCR products图3 烟草H2A-414 PCR产物的琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of tobacco H2A-414 PCR products
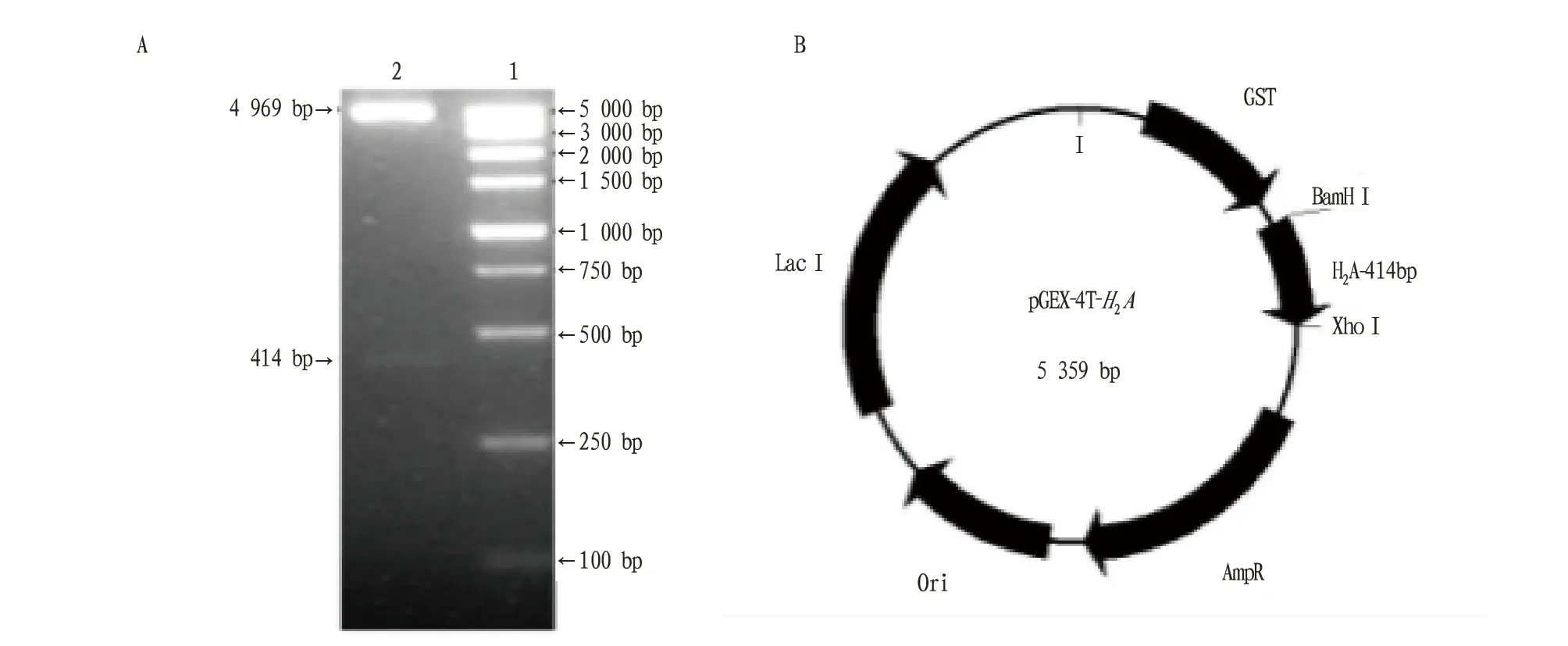
注:A.pGEX-4T-H2A的酶切鉴定(1.DL5000 Marker;2.pGEX-4T-H2A重组子BamH I和Xho I双酶切后得到的4 969 bp的载体片段和414 bp的H2A全长);B.pGEX-4T-H2A图谱,示414 pb的H2A全长插入pGEX-4T-1的酶切位点Note:A.Enzyme digestion identification of pGEX-4T-H2A(1 .DL5000 Marker ;2. 4 969 bp vector got by double enzyme digestion and 414 bp H2A overall length );B. pGEX-4T-H2A atlas,enzyme digestion site of 414 bp H2A overall length inserted with pGEX-4T-1图4 pGEX-4T-H2A重组子的酶切鉴定Fig.4 Enzyme digestion identification of pGEX-4T-H2A recombinant
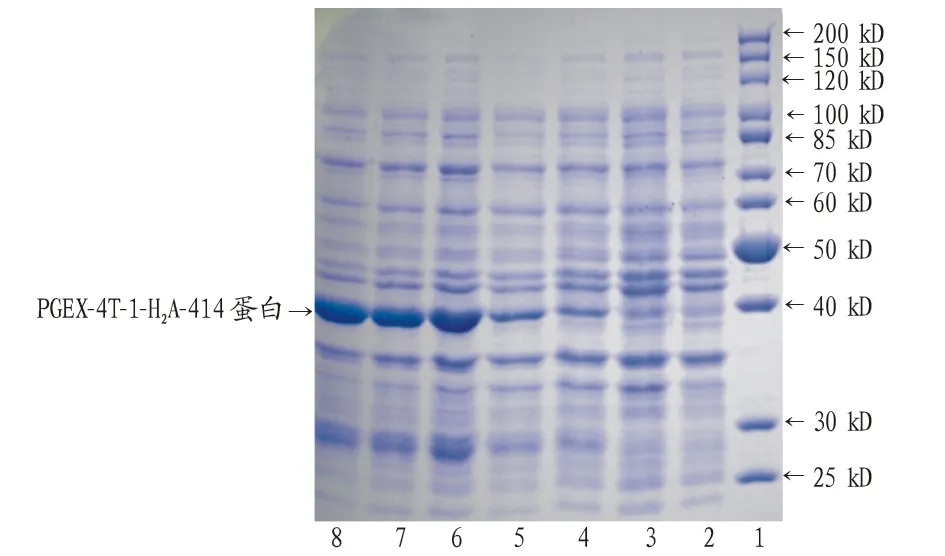
注:1.蛋白分子量Marker:PageRuler Unstained Protein Lader;2.空载的表达; 3.IPTG诱导前H2A的表达;4~8.0.10、0.08、0.06、0.04、0.02 mmol/L IPTG诱导后H2A的蛋白表达Note:1.Protein marker:PageRuler Unstained Protein Lader;2.No-load expression;3.H2A expression before IPTG induction;4-8.H2A protein expression after induction with 0.10、0.08、0.06、0.04、0.02 mmol/L IPTG图5 烟草H2A的诱导表达Fig.5 Induction expression of tobacco H2A
3 结论与讨论
已知的植物Kinesin多在不同组织中广泛表达[1-2,5],烟草新KinesinNtTkr却在幼叶和各发育时期的胚等分裂旺盛部位优势表达[1,6-7]。这种组织特异性表达模式提示它可能在胚胎发生及叶组织分化过程中具有独特的作用。对于揭示未知蛋白的功能,筛选与之相互作用的蛋白质非常重要,因为生物体中几乎所有生物过程,如 DNA复制、基因转录、蛋白合成及信号转导等,都离不开蛋白质之间的相互作用。通过对烟草幼叶 cDNA 文库的酵母双杂交筛选,得到了多个能与 NtTkr 互作的候选蛋白质。由于酵母双杂交具有局限性,不可避免地会存在假阳性[8-10],要确定候选蛋白是否真的能够与目的蛋白发生作用,必须通过 Pull Down 及 CoIP 或免疫共定位来进一步验证[4,11-12]。故笔者以pGADT-Rec-F35-1质粒为模板,PCR 扩增烟草H2A全长,并将其克隆入原核表达载体pGEX4T-1,转入 BL21(DE3),诱导其成功表达,为 Pull Down 验证该蛋白与候选蛋白之间的相互作用奠定了基础。
重组原核表达载体pGEX-4T-H2A构建成功后,转化大肠杆菌BL21超级感受态,IPTG诱导其表达。因目的蛋白的可溶性、稳定性和表达量因蛋白而异,故必须依据实际情况调整诱导表达条件。要使蛋白达到较高表达量,除培养时间和温度外,合适的IPTG工作浓度也极为重要。因此,笔者在相同温度和时间条件下,设置5个IPTG浓度,蛋白电泳检测结果显示,IPTG浓度为0.06 mmol/L时表达量较高,继续增大浓度时与0.06 mmol/L诱导差别不大,表明IPTG工作最适浓度为0.06 mmol/L。
最近有报道表明NtKrp通过与核糖体蛋白NtRPL17相互作用,影响细胞周期进程进而调节胚胎/种子大小和幼根生长[13]。如能证实NtKrp与组蛋白H2A的相互作用可进一步揭示NtKrp影响细胞分裂的机制。笔者构建了烟草H2A基因全长和pGEX4T-1载体大片段连接的融合表达载体并成功地诱导其表达,为深入研究NtTkr与候选蛋白质之间的体外互作及该蛋白的其他生物学功能奠定了试验基础。
[1] TIAN S J,WU J J,LI F,et al.NtKRP, a kinesin-12 protein, regulates embryo/seed size and seed germination via involving in cell cycle progression at the G2/M transition[J].Scientific reports,2016,6:35641.
[2] SABLIN E P,KULL F J,COOKE R,et al.Crystal structure of the motor domain of the kinesin-related motor ncd[J].Nature,1996,380(6574):555-559.
[3] ASBURY C L,FEHR A N,BLOCK S M.Kinesin moves by an asymmetric hand-over-hand mechanism[J].Science,2003,302(5653):2130-2134.
[4] SINGH R,LEE M O,LEE J E,et al.Rice mitogen-activated protein kinase interactome analysis using the yeast two-hybrid system[J].Plant Physiol,2012,60(1):477-487.
[5] YILDIZ A,TOMISHIGE M,VALE R D,et al.Kinesin walks hand-over-hand[J].Science,2004,303(5658):676-678.
[6] 李芬,吴秀丽,郭君丽.新基因NtTKR及其同源物LeTKR的生物信息学分析[J].河南师范大学学报(自然科学版),2014,42(5):110-115.
[7] 李芬,任向波,腾飞,等.烟草新驱动蛋白NtTKR过表达对酵母生长的影响[J].河南师范大学学报(自然科学版),2014, 42(6):97-102.
[8] FIELDS S,SONG O.A novel genetic system to detect protein-protein interactions[J].Nature,1998, 340(6230):245-246.
[9] BENDIXEN C,CANGLOFF S,ROTHSTEIN R.A yeast mating-selection scheme for detection of protein-protein interactions[J].Nucleic Acid Res,1994,22(9):1778-1779.
[10] HUBSMAN M,YUDKOVSKY G,ARONHEIM A.A novel approach for the identification of protein-protein interaction with integral membrane proteins[J].Nucleic acids research,2001, 29(4):1-6.
[11] KHAZAK V,GOLEMIS E A,WEBER L.Development of a yeast two-hybrid screen selection of human Ras-Raf protein interaction inhibitors[J].Methods Mol Biol,2005,310:253-271.
[12] ZHENG Y,TAN X Y,PYCZEK J,et al.Generation and characterization of yeast two-hybrid cDNA libraries derived from two distinct mouse pluripotent cell types[J].Mol Biotechnol,2013, 54(2):228-237.
[13] TIAN S J,WU J J,LIU Y,et al.Ribosomal protein NtRPL17 interacts with kinesin-12 family protein NtKRP and functions in the regulation of embryo/seed size and radicle growth[J].J Exp Bot,2017,68(20):5553-5564.
