CXCL1促进人肝癌细胞发生内质网应激
2018-04-09邹岭陈伟李自慧叶甲舟白涛陈洁陈健康王翠刘宁杨晓丽吴飞翔
邹岭,陈伟,李自慧,叶甲舟,白涛,陈洁,陈健康,王翠,刘宁,杨晓丽,吴飞翔
1.广西医科大学 附属肿瘤医院肝胆外科,广西 南宁 5300021;2.湘南学院 附属医院,湖南 郴州 423000;3.中国人民武装警察部队总医院 检验科,北京 100071
趋化因子CXCL1(chemokine CXC motif li⁃ gand 1)属于CXC亚族[1]。CXCL1不仅与炎症反应有关,而且CXCL1及其受体CXCLR2直接影响某些肿瘤恶性转变、存活及生长、侵袭和转移。CXCL1也间接影响血管生成及肿瘤相关巨噬细胞和癌症相关成纤维细胞的形成[2-3]。当细胞发生内质网应激(endoplasmic reticulum stress,ERS)时,会影响肿瘤微环境的稳态,激活未折叠蛋白反应(unfolded protein response,UPR)信号转导通路,诱发肿瘤相关巨噬细胞的活性,释放细胞因子促进肿瘤炎症反应,或通过募集血管内皮生长因子促进肿瘤血管生成,恢复肿瘤微环境[4-7]。目前尚未有对细胞因子中趋化因子与肿瘤细胞内内质网应激进行详细研究的报道。在此,我们探讨了人肝癌HepG2细胞中CXCL1过表达情况下对内质网应激的影响。
1 材料与方法
1.1 材料
人肝癌HepG2细胞由军事医学研究院生物工程研究所钟辉课题组惠赠,在含10%胎牛血清的DMEM培养液中加入100 μg/mL链霉素和100 U/mL青霉素,于含95%空气和5%CO2的37℃恒温箱里培养,每2~3 d传代一次,用于实验的细胞应处于对数生长期。
青霉素、链霉素购自华北制药有限公司;人CXCL1 ELISA试剂盒、衣霉素(tunicamycin,TM)、丙二醇甲醚醋酸酯(TPA)、DMSO购自Sigma-Al⁃drich公司;焦碳酸二乙脂(DEPC)购自上海生工生物工程公司;TRNzol-A+总RNA提取试剂盒、SuperReal荧光定量预混试剂彩色版(SYBR Green)购自天根生化科技有限公司;异丙醇、氯仿、75%乙醇购自西珑化工公司;细胞冻存管、细胞培养皿、培养瓶购自Corning公司;TransScript Frist-Strand cDNA Synthesis试剂盒购自全式金生物技术公司;EP管、无RNase的PCR管、0.2 mL八连排透明PCR薄壁管购自Axygen公司。
1.2 ERS相关蛋白基因引物设计与合成
每种基因选2~3个已报道且多次被引用的引物,通过荧光定量PCR分析溶解曲线,筛选出无二级结构、特异性较好的引物,作为后续实验所用引物(表1)。

表1 引物序列信息
1.3 人肝癌细胞转染
当HepG2细胞长至6 cm培养皿的60%~80%时可用于转染,转染前1 h换新鲜培养基2 mL(平时培养基的一半);把2 μL LipofectAMINE 2000加入100 μL生理盐水中(转染试剂∶生理盐水为1∶50)静置5 min;向另一100 μL生理盐水中加入2 μg CXCL1质粒,再把2 μL转染试剂LipofectAMINE 2000和100 μL生理盐水混合液加进来,静置15 min;最后把2 μg CXCL1质粒、2 μL转染试剂LipofectAMINE 2000和100 μL生理盐水的转染混合液均匀加入培养基中,轻轻混匀;4 h后补2 mL新鲜培养基或换成4 mL新鲜培养基;培养24 h后收集细胞提取mRNA。
1.4 荧光定量PCR
荧光定量PCR测定HepG2细胞中IRE1、PERK、ATF6 mRNA的表达。提取HepG2细胞总RNA,逆转录成cDNA,反应体系为20 μL(逆转录反应条件:42℃ 30 min逆转录,85℃ 5 min灭活逆转录酶)。PCR反应体系为20 μL,包括2×Su⁃perReal Color PreMix 10 μL,正、反向引物各0.5 μL,cDNA模板2 μL,无RNase的ddH2O 3 μL。各样品均以β-actin作为内参照。
1.5 数据处理及分析
用Bio-Rad iQ5软件分析数据,提取扩增曲线及融解曲线,按下式计算样本中各目的基因的相对表达量:ΔCT=CT(目的基因)-CT(内参基因),其中CT为3个复孔平均值;ΔΔCT=ΔCT(实验组)-ΔCT(对照组)。目的基因的相对表达量为2-ΔΔCT。用SPSS16.0软件,采用单因素方差分析对结果进行比较,P<0.05认为具有统计学意义。
2 结果
2.1 GFP-CXCL1质粒在真核细胞中的表达
结果见图1,质粒GFP-CXCL1瞬时转染到真核细胞HepG2中,24 h后在荧光显微镜下可以看到绿色荧光,表明GFP-CXCL1载体在真核细胞中获得表达。
图1 GFP-CXCL1质粒在HepG2细胞细胞中的表达
2.2 荧光定量PCR检测内质网应激相关蛋白IRE1、PERK、ATF6 mRNA的表达
在HepG2细胞中瞬时转染GFP-CXCL1质粒,过表达 CXCL1,培养 24h后收集细胞提取mRNA,通过荧光定量PCR检测内质网应激相关蛋白IRE1、PERK、ATF6的mRNA,结果见图2。HepG2细胞过表达CXCL1后,内质网应激相关蛋白IRE1、PERK、ATF6的mRNA水平均升高,表明HepG2细胞过表达CXCL1后内质网应激被激活。
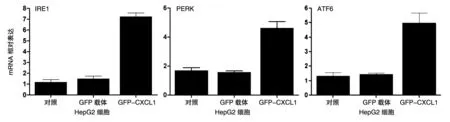
图2 HepG2细胞过表达CXCL1后内质网应激相关基因的表达
3 讨论
CXCL1是小分子趋化因子,能够趋化中性粒细胞向炎症部位运动,此外还参与新血管生成、伤口愈合等生理病理过程[8-9]。近年来研究表明CXCL1在肺癌[10]、膀胱癌[11]、卵巢上皮癌[12]及前列腺癌[13]中表达增高,与肿瘤的发生、发展相关。以肝癌为例,CXCL1可以通过NF-κB通路调控P65的表达,促进肝细胞癌的增殖和转移[14]。肿瘤的发生往往伴有炎症反应,那么CXCL1如何参与炎性反应,又如何通过与肿瘤的增殖和转移相联系?研究发现CXCL1的存在可以影响巨噬细胞的生成,从而影响炎性反应,进而影响肿瘤细胞的凋亡[8]。此外,Morizawa等[11]对膀胱癌的研究证实肿瘤相关巨噬细胞和癌症相关成纤维细胞存在于肿瘤微环境中,CXCX1可以增强它们的募集,影响肿瘤预后。阻断CXCL1募集信号通路,可以在一定程度上治疗膀胱肿瘤。
内质网是真核细胞内蛋白质合成、脂质生成和钙离子贮存的主要场所。当细胞环境由于生理或病理条件改变时,内质网内累积大量未折叠或错误折叠的蛋白质,细胞会采取相应的应答措施缓解内质网压力,促进内质网正常功能的恢复,这一反应被称为ERS[15]。当细胞发生ERS时会激活UPR信号转导通路。UPR信号主要通过3个定位于内质网膜上的蛋白负责监控ERS并启动UPR,这3个蛋白就是肌醇依赖内质网至细胞核信号激酶1α(IRE1α)、类RNA依赖蛋白激酶内质网激酶(PERK)及转录激活因子6(ATF6)[16]。正常状态下,GRP78与PERK、IRE1及ATF6这3种感受器的ER腔部分结合在一起。ERS发生时, GRP78与未折叠蛋白结合,游离的IRE1、PERK分别通过各自细胞质内结构域的二聚化和自身磷酸化而被激活[17];解离后的ATF6则转入高尔基体被蛋白酶水解成活性转录因子,此时内质网感受器被激活,通过 PERK-eIF2α、IRE1-XBP1s和ATF6-ERSE这3条主要的信号通路参与UPR[18-21]。
我们将GFP-CXCL1质粒转染人肝癌HepG2细胞使其过表达,检测与内质网应激相关的3个信号通路蛋白的表达水平,以此验证CXCL1对内质网应激的影响是否与这3个信号通路蛋白有关。结果HepG2细胞过表达CXCL1后,内质网应激相关蛋白IRE1、PERK、ATF6均升高。
内质网应激是一个复杂的过程,其分子机制还有很多不明之处,各种细胞因子如何参与内质网应激调控尚不明晰。本研究可为探讨趋化因子对内质网应激的影响提供新的思路,并且为进一步研究CXCL1促进原发性肝癌增殖及侵袭转移的分子生物学机制提供帮助。
[1] Miyake M,Lawton A,Goodison S,et al.Chemokine (C-X-C)ligand 1(CXCL1)protein expression is in⁃creased in aggressive bladder cancers[J].BMC Cancer, 2013,13:322.
[2] Petty A J,Yang Y.Tumor-associated macrophages:im⁃plications in cancer immunotherapy[J].J Immunother, 2017,9(3):289-302.
[3] Affo S,Yu L X,Schwabe R F.The role of cancer-as⁃sociated fibroblasts and fibrosisin liver cancer[J].An⁃nu Rev Phytopathol,2017,12:153-186.
[4] Maeng H J,Song J H,Kim G T,et al.Celecoxib-me⁃diated activation of endoplasmic reticulum stress induc⁃esde novo ceramide biosynthesisand apoptosisin hepatoma HepG2 cells[J].BMB Rep,2017,50(3):144-149.
[5] Guo Q,Xu L,Li H,et al.Progranulin causes adipose insulin resistance via increased autophagy resulting from activated oxidative stress and endoplasmic reticu⁃lum stress[J].Lipids Health Dis,2017,16(1):25.
[6] Lee B R,Chang S Y,Hong E H,et al.Elevated en⁃doplasmic reticulum stress reinforced immunosuppres⁃sion in the tumor microenvironment via myeloid-de⁃rived suppressor cells[J].Oncotarget,2014,5(23):12331-12345.
[7] Peters L R,Raghavan M.Endoplasmic reticulum calci⁃um depletion impacts chaperone secretion,innate im⁃munity,and phagocytic uptake of cells[J].J Immunol, 2011,187(2):919-931.
[8] Garg A D,Vandenberk L,Fang S,et al.Pathogen re⁃sponse-like recruitment and activation of neutrophils by sterile immunogenic dying cells drives neutrophilmediated residualcellkilling[J].CellDeath Differ, 2017,24(5):832-843.
[9] Wang W,Xu M J.Inflammation is independent of ste⁃atosis in a murine model of steatohepatitis[J].Hepatolo⁃gy,2017,66(1):108-123.
[10]YuanM,ZhuH.Tumor-derivedCXCL1promotes lung cancer growth via recruitment of tumor-associat⁃ed neutrophils[J].J Immunol Res,2016,2016:6530410.
[11]Miyake M,Hori S,Morizawa Y,et al.CXCL1-mediat⁃ed interaction of cancer cells with tumor-associated macrophages and cancer-associated fibroblasts pro⁃motes tumor progression in human bladder cancer[J]. Neoplasia,2016,18(10):636-646.
[12]WangQ,LiD.Evaluation ofproteomics-identified CCL18 and CXCL1 as circulating tumor markers for differential diagnosis between ovarian carcinomas and benign pelvic masses[J].Int J Biol Markers,2011,26 (4):262-273.
[13]Hardaway A L,Herroon M K.Marrow adipocyte-de⁃rived CXCL1 and CXCL2 contribute to osteolysis in metastatic prostate cancer[J]. Clin Exp Metastasis, 2015,32(4):353-368.
[14]Cao Z,Fu B.Overexpression of Chemokine(C-X-C) ligand 1(CXCL1)associated with tumor progression and poor prognosis in hepatocellular carcinoma[J].Can⁃cer Cell Int,2014,14(1):86.
[15]Noack J,Choi J.A sphingosine kinase inhibitor com⁃bined with temozolomide induces glioblastoma cell death through accumulation of dihydrosphingosine and dihydroceramide,endoplasmic reticulum stress and au⁃tophagy[J].Cell Death Dis,2014,5:e1425.
[16]Verfaillie T,Garg A D,Agostinis P.Targeting ER stress induced apoptosis and inflammation in cancer [J].Cancer Lett,2013,332(2):249-264.
[17]Smith W W,Jiang H,Pei Z,et al.Endoplasmic retic⁃ulum stress and mitochondrial cell death pathways me⁃diate A53T mutant alpha-synuclein-induced toxicity [J].Hum Mol Genet,2005,14(24):3801-3811.
[18]Katayama T,Imaizumi K,Honda A,et al.Disturbed activation of endoplasmic reticulum stress transducers by familialAlzheimer'sdisease-linked presenilin-1 mutations[J].J Biol Chem,2001,276(46):43446-43454.
[19]Hoozemans J J,van Haastert E S.The unfolded pro⁃tein response is activated in pretangle neurons in Al⁃zheimer's disease hippocampus[J].Am J Pathol,2009, 174(4):1241-1251.
[20]Culmsee C,LandshamerS.Molecularinsightsinto mechanisms of the cell death program:role in the pro⁃gression ofneurodegenerative disorders[J].Curr Al⁃zheimer Res,2006,3(4):269-283.
[21]Acosta-Alvear D,Zhou Y,Blais A,et al.XBP1 con⁃trols diverse cell type- and condition-specific tran⁃scriptional regulatory networks[J].Mol Cell,2007,27(1): 53-66.
