LC-MS/MS法测定大鼠血浆中5-羟基-7-(4-羟基-3-甲氧基苯基)-1-苯基-3-庚酮浓度
2018-04-09李备周颖常秀亭罗小菊云永欢曹献英
李备,周颖,常秀亭,罗小菊,云永欢,曹献英
1.海南省食品检验检测中心,海南 海口 570311;2.海南大学 食品学院,海南 海口 570228
中药高良姜具有散寒止呕、温胃止痛的功效,二苯基庚烷类化合物是其重要的生物活性成分,在抗炎、抗氧化、抗菌、抗病毒、抗肿瘤等方面表现出较好的药理活性[1-5]。5-羟基-7-(4-羟基-3-甲氧基苯基)-1-苯基-3-庚酮(DPHA)是高良姜中重要的二苯基庚烷类成分(结构式见图1),具有上述活性[6-12]。本研究建立了测定大鼠血浆中DPHA浓度的LC-MS/MS方法,为高良姜二苯庚烷类成分的药动学研究和开发利用提供参考。
1 材料与方法
1.1 材料
清洁级SD大鼠(10周龄,体重240±20 g)由长沙市天勤生物技术有限公司提供[动物合格证号:SCXK(湘)2014-0011]。
Prominence UFLC液相色谱仪(日本岛津公司)通过Turbo V离子源接口串联AB-SCIEX API 4000+串联四级杆质谱仪,Analyst软件控制数据采集和处理(美国AB公司);5922型冷冻离心机(日本Kubota公司);XS105DU十万分之一电子分析天平(瑞士梅特勒-托利多公司);LabTow⁃er EDI15超纯水一体机(美国热电公司);Vibrax圆周振荡器(德国艾卡公司);FDB03DD氮吹仪(英国Techne公司);色谱级甲醇(德国默克公司);色谱级正己烷和甲酸(阿拉丁试剂)。
1.2 供试品溶液的制备
精密称取DPHA对照品适量,加甲醇配制成0.1 mg/mL的储备液,4℃保存备用。取益智酮甲对照品适量,精密称定,加甲醇配制成200 ng/mL内标溶液。
1.3 血浆样品采集处理
大鼠经适应性饲养3 d,临用前禁食不禁水12 h,从眼眶静脉丛采集血液样品,肝素钠抗凝,4000 r/min离心10 min获得血浆,取50 μL血浆样品加入1 mL正己烷,2000 r/min振荡混匀10 min,离心后分取正己烷层950 μL,37℃加热氮气吹干,加入50 μL甲醇(含内标益智酮甲200 ng/ mL)复溶,2000 r/min振荡混匀3 min,13 000 r/ min离心10 min,取上清液置微量进样管中,待进样分析。
1.4 色谱-质谱条件
菲罗门Kinetex XB-C18色谱柱(2.10 mm×50 mm,2.6 μm),柱温40℃,以水(含0.01%甲酸,A)-甲醇(含0.01%甲酸,B)为流动相梯度洗脱[梯度洗脱程序:0~0.50 min(1%B),0.51~6.50 min(60%~100%B),6.51~8.00 min(1%B),流速0.30 mL/min,进样量10 μL]。电喷雾离子源(ESI),正离子检测,喷雾电压5500 V,GS1为55 psi,GS2为45 psi,帘气为35 psi,喷雾温度为500℃,碰撞气为 10 psi。多反应离子监测(MRM),用于定量分析的离子对为m/z 329.2→163.0,内标化合物益智酮甲为313.1→137.0。
1.5 专属性考察
取空白血浆、空白血浆加对照品和内标溶液、静脉注射给药后30 min血浆样品,按1.3项下样品处理方法处理,按1.4项下条件进样分析。
1.6 线性关系考察
取0.1 mg/mL DPHA甲醇溶液适量,用空白血浆配制成2000 ng/mL血浆样品,再用空白血浆逐级稀释成1000、100、10、5、2、1 ng/mL的血浆样品,经1.3项下方法处理后,进样10 μL,按1.4项下方法进行分析。

图1 5-羟基-7(4-羟基-3-甲氧基苯基)-1-苯基-3-庚酮
1.7 精密度和准确度考察
配制高、中、低3种浓度(1600、100、6 ng/mL)的DPHA血浆样品,每个浓度设5个平行样,经1.3项下方法处理后分别进样分析,计算日内精密度和准确度,连续测定3 d,计算日间精密度。
1.8 基质效应和提取回收率试验
按文献方法[13-14],采用提取后添加法评定基质效应,同时考察提取回收率。Set1:取高、中、低3种浓度DPHA对照品溶液50 μL,直接进样分析,得到峰面积A1;Set2:取空白血浆50 μL,经2.3项下方法处理至氮气37℃加热吹干步骤,然后分别加入高、中、低3种浓度DPHA对照品溶液50 μL复溶,2000 r/min振荡混匀3 min,13 000 r/min离心10 min,取上清液进样分析,得到峰面积A2;Set3:配制高、中、低3种浓度DPHA血浆样品,各取50 μL经1.3项下方法处理后进样分析,得到峰面积A3。以上每个浓度设5个平行样。基质效应ME=A2/A1×100%;提取回收率RE=A3/A2× 100%。
1.9 稳定性考察
配制高、中、低3种浓度的DPHA血浆样品,每个浓度设5个平行样,考察血浆样品在室温放置4 h、冻融循环3次和血浆样品处理后置自动进样器中8 h的稳定性,经1.3项下方法处理后分别进样分析,计算样品短期稳定性。
2 结果
2.1 专属性考察结果
DPHA、益智酮甲出峰时间分别为3.91、4.90 min,分离度大于1.5,空白溶剂和基质对测定无干扰。色谱图见图2。
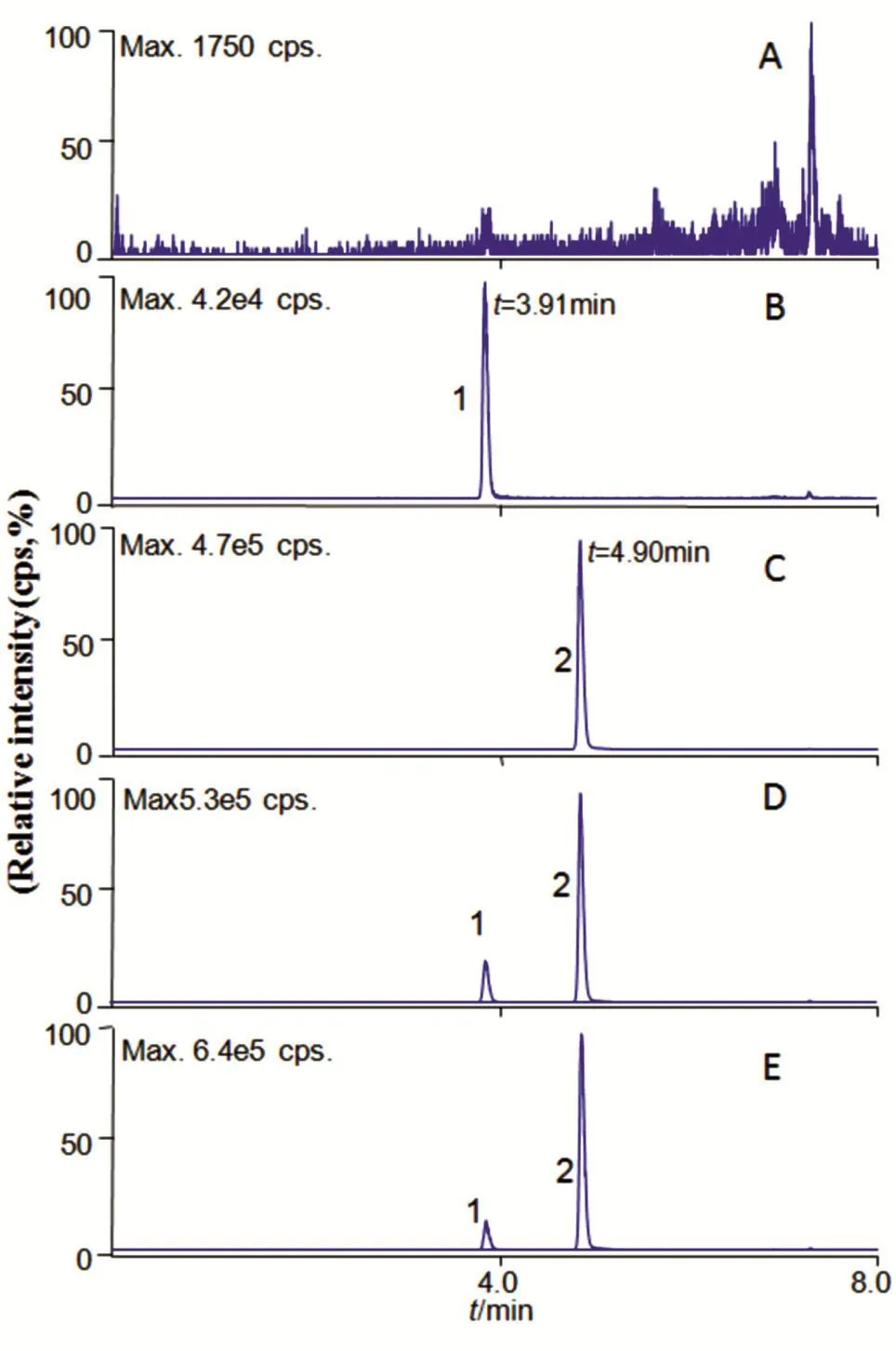
图2 DPHA(1)和内标益智酮甲(2)色谱图A:空白血浆;B:空白血浆加DPHA;C:空白血浆加内标;D:空白血浆加DPHA和内标;E:静脉注射给药30 min后血浆样品
2.2 线性考察结果
以待测物与内标峰面积之比(y)为纵坐标、待测物浓度(x)为横坐标、权重为1/x进行线性回归,得回归方程y=0.00119x+0.000409(r=0.9996),表明DPHA为1~2000 ng/mL时线性关系良好。
2.3 精密度和准确度考察结果
研究结果(表1)显示,日内、日间精密度RSD均低于15%,重复性良好;准确度为105.03%~112.80%。
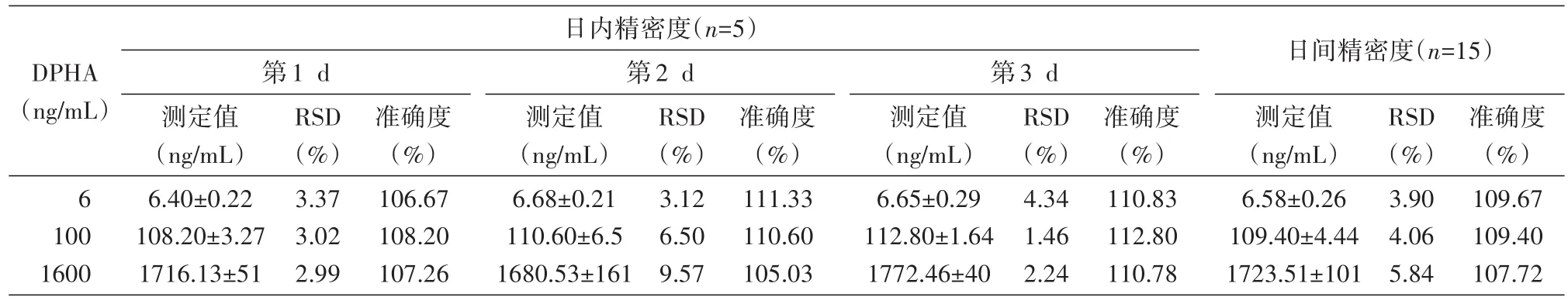
表1 DPHA定量分析精密度和准确度结果
2.4 基质效应和提取回收率试验结果
结果(表2)表明,高、中、低3种浓度下,待测物均无显著的基质效应,提取回收率大于70%。
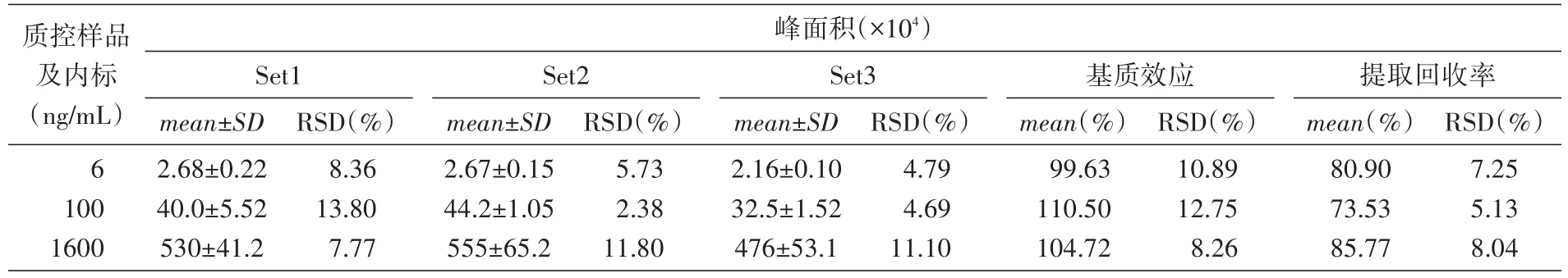
表2 大鼠血浆中DPHA的基质效应和提取回收率(n=5)
2.5 稳定性考察结果
各浓度样品测试的准确度为 102.46%~110.60%,小于15%;3种处理方式对样品稳定性无明显影响。结果见表3。
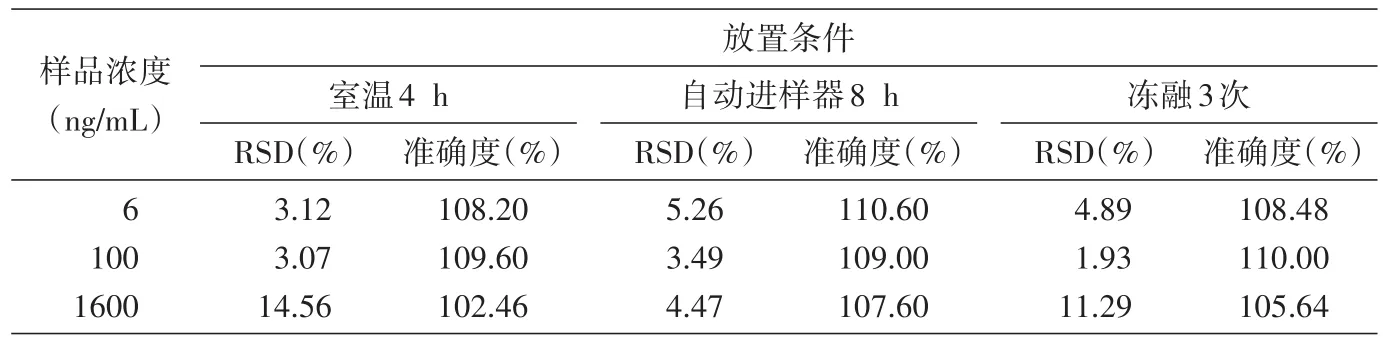
表3 血浆样品中DPHA的稳定性
2.6 样品测试
将上述分析方法用于分析大鼠给药后血浆样品。取4只SD大鼠,尾静脉注射给予DPHA 1.0 mg/kg,0.5 h后经眼眶静脉取血,按1.3项下方法处理后分别进样分析,计算得血药浓度为36.2±5.1 ng/mL(n=4,RSD=14.0%)。
3 讨论
DPHA结构与姜黄素类似,一般而言姜黄素类似物溶解性、稳定性较差,应用液相色谱-质谱联用技术分析这些化合物在血浆中的含量,文献报道基质效应为43%~86%,对结果的准确性存在一定影响[14-15]。本研究建立的DPHA液相色谱-质谱分析方法,基质效应为99.63%~110.50%,方法的建立过程中,还考察优化了离子源喷雾电压、GS1、GS2、帘气、喷雾温度等参数。对血浆样品的处理,通过试验对比了甲醇、乙腈沉淀和乙酸乙酯、正己烷、叔丁基甲醚萃取,最后确定正己烷萃取处理后检测干扰少、提取率高。同时设定了3对 离 子 对(329.2→163.0、329.2→137.0、392.2→311.0)检测分析DPHA,其中392.2→311.0信号最强,但干扰峰较多,最后选择信号稍弱而干扰较少的329.2→163.0作为定量分析的离子对。以上结果为DPHA的药代动力学研究奠定了基础,也为相关药效药理研究的给药剂量提供了参考。
[1] Matsuda H,Ando S,Kato T,et al.Inhibitors from the rhizomes of Alpinia officinarum on production of nitric oxide in lipopolysaccharide-activated macro⁃phages and the structural requirements of diarylhep⁃tanoids for the activity[J].Bioorgan Med Chem,2006, 14(1):138-142.
[2] Lee H J,Kim J S,Ryu J H.Suppression of induc⁃ible nitric oxide synthase expression by diarylhep⁃tanoids from Alpinia officinarum[J].Planta Med,2006, 72(1):68-71.
[3] 沈健,张虎翼,徐波,等.高良姜中的抗氧化有效成分[J].天然产物研究与开发,1998,10(2):33-36.
[4] Matsuda H,Nakashima S,Oda Y,et al.Melanogene⁃sis inhibitors from the rhizomes of Alpinia officinarum in B16 melanoma cells[J].Bioorgan Med Chem,2009, 17(16):6048-6053.
[5] 安宁.常用中药高良姜化学成分研究[D].北京:中国协和医科大学,2006.
[6] 邓亦峰,冯丽娜,罗辉.辛辣组分对高良姜提取物抗菌活性的影响[J].食品研究与开发,2013,34(4):4-7.
[7] Zhang B B,Dai Y,Liao Z X,et al.Three new anti⁃bacterial active diarylheptanoids from Alpinia officina⁃rum[J].Fitoterapia,2010,81(7):948-952.
[8] Sawamura R,Sun Y,Yasukawa K,et al.Antiviral ac⁃tivities of diarylheptanoids against influenza virus in vitro[J].J Nat Med,2010,64:117-120.
[9] Konno K,Sawamura R,Sun Y,et al.Antiviral activi⁃ties of diarylheptanoids isolated from Alpinia officina⁃rum against respiratory syncytial virus,poliovirus,mea⁃sles virus,and herpes simplex virus type 1 in vitro [J].Nat Prod Commun,2011,6(12):1881-1884.
[10]Kiuchi F,Shibwa M,Sankawa U.Inhibitors of prosta⁃glandin biosythensis from Alpinia officinarum[J].Chem Pharm Bull,1982,30(6):2279-2282.
[11]Kiuchi F,Iwakami S,Shibuya M,et al.Inhibition of prostaglandin and leukotriene biosynthesis by gingerols and diarylheptanoids[J].Chem Pharm Bull,1992,40(2): 387-391.
[12]Yasukawa K,Sun Y,Kitanaka S,et al.Inhibitory ef⁃fect of the rhizomes of Alpinia officinarum on TPA-in⁃ duced inflammation and tumor promotion in two-stage carcinogenesis in mouse skin[J].J Nat Med,2008,62 (3):374-378.
[13]Sun Y,Tabata K,Matsubara H,et al.New Cytotoxic diarylheptanoids from the rhizomes of Alpinia officina⁃rum[J].Planta Medica,2008,74(4):427-431.
[14]向平,沈敏,卓先义.液相色谱-质谱分析中的基质效应[J].分析测试学报,2009,28(6):753-756.
[15]Cao Y,Xu R X,Liu Z.A high-throughput quantifica⁃tion method ofcurcuminoidsand curcumin metabo⁃litesin human plasma viahigh-performanceliquid chromatography/tandem massspectrometry[J].JChro⁃matogr B Analyt Technol Biomed Life Sci,2014,949-950(4):70-78.
