内质网应激对肝癌细胞中趋化因子表达的影响
2018-04-09毛瑞涛陈伟邹岭李自慧叶甲舟白涛陈洁陈健康王翠刘宁杨晓丽吴飞翔
毛瑞涛,陈伟,邹岭,李自慧,叶甲舟,白涛,陈洁,陈健康,王翠,刘宁,杨晓丽,吴飞翔
1.吉林大学 中日联谊医院,吉林 长春 130000;2.广西医科大学 附属肿瘤医院肝胆外科,广西南宁 5300021;3.湘南学院 附属医院,湖南 郴州 423000;4.中国人民武装警察部队总医院 检验科,北京 100039
内质网(endoplasmic reticulum,ER)是真核细胞内蛋白质合成、脂质生成和钙离子贮存的主要场所。当细胞的环境由于生理或病理条件改变时,内质网腔内未折叠蛋白、错误折叠蛋白增加或钙离子浓度改变,均可诱导内质网应激(ER stress,ERS)。内质网应激激活内质网应激反应或未折叠蛋白反应(unfolded protein response,UPR)[1]。UPR主要通过IRE1α、PERK、ATF6信号通路,此3条通路的激活可引起炎症侵袭、转移和基因组不稳定性等。同时,高表达的信号分子如Xbp1、IRE1和ATF4等能引起淋巴细胞和白细胞的聚集,释放多种细胞因子包括趋化因子CXCL家族、血管内皮生长因子(VEGF)、肿瘤坏死因子(TNF)、白细胞介素(IL)等。因此,当发生内质网应激时,肿瘤细胞中各种细胞因子水平的变化将触发不同信号通路的反应[2]。我们应用荧光定量PCR等方法,检测了衣霉素(tunicamycin,TM)刺激诱发的内质网应激对HepG2肝癌细胞不同趋化因子表达水平的影响。
1 材料与方法
1.1 材料
人肝癌HepG2细胞由军事医学研究院生物工程研究所钟辉课题组惠赠,在含10%胎牛血清的DMEM培养液中加入100 μg/mL链霉素和100 U/mL青霉素,于含95%空气和5%CO2的37℃恒温箱里培养,每2~3 d传代一次,用于实验的细胞应处于对数生长期。
人CXCL1 ELISA试剂盒、衣霉素、丙二醇甲醚醋酸酯(TPA)、DMSO购自Sigma-Aldrich公司;焦碳酸二乙脂(DEPC)购自上海生物工程公司;TRNzol-A+总RNA提取试剂盒、SuperReal荧光定量预混试剂彩色版(SYBR Green)购自天根生化科技有限公司;TransScript Frist-Strand cDNA Synthesis试剂盒购自全式金生物技术公司;EP管、无RNase的PCR管、0.2 mL八连排透明PCR薄壁管购自Axygen公司。
1.2 细胞处理
当HepG2细胞长至70%时,换成新鲜的含10%胎牛血清的DMEM培养基,再分别用5 mmol/ mL DMSO,0、2.5、5、10 mmol/mL TM处理,诱导HepG2细胞发生内质网应激,分别在培养12和24 h后收集细胞及培养基。
1.3 荧光定量PCR
荧光定量PCR测定HepG2细胞中CXCL1、CXCL2、CXCL3、CXCL8的mRNA表达。提取HepG2细胞RNA,逆转录成cDNA,反应体系为20 μL(逆转录反应条件:42℃ 30 min逆转录,85℃ 5 min灭活逆转录酶)。PCR反应体系为10 μL(反应条件:预变性95℃ 15 min,变性95℃ 10 s,退火延伸60℃ 30 s)。各样品均以βactin作为内参照,引物序列见表1。
1.4 ELISA检测培养基中的CXCL1含量
ELISA测定HepG2细胞中的CXCL1含量。将制备的HepG2细胞匀浆液于4℃、13 000 r/min离心10 min,提取上清液,采用双抗体夹心法测定HepG2细胞中的CXCL1浓度,所有操作均按照ELISA检测试剂盒说明书执行。用SPSS22.0软件分析数据,采用单因素方差分析对结果进行比较,P<0.05认为具有统计学意义。
2 结果
2.1 内质网应激下趋化因子mRNA的表达情况
用不同浓度的TM刺激HepG2细胞,使其发生内质网应激,分别在12和24 h收集HepG2细胞提取总mRNA,通过荧光定量PCR检测其细胞内趋化因子的mRNA水平。结果见图1,TM刺激组CXCL1、CXCL2、CXCL3的mRNA水平比对照组显著升高(P<0.05),其中CXCL1的mRNA水平随不同浓度梯度的TM刺激依次增高。但CXCL8的mRNA水平降低(P<0.05)。以上结果说明HepG2细胞发生内质网应激时,不同趋化因子的表达趋势有所不同。

表1 引物及序列

图1 不同浓度TM刺激下HepG2细胞内趋化因子mRNA的表达
2.2 趋化因子CXCL1在内质网应激下的分泌水平
用ELISA检测经不同浓度TM刺激后HepG2细胞培养基上清中CXCL1的分泌水平,结果见图2,TM刺激组的CXCL1水平明显高于对照组,且CXCL1水平和TM浓度呈正相关。
3 讨论
内质网内环境的稳定是实现内质网功能的基本条件。研究表明[3-5],当内质网所处的微环境受到病原微生物、营养底物缺乏、脂肪超载、炎性因子、缺血缺氧等应激原严重持续性刺激后出现过多未折叠或错误折叠蛋白,能够引起多条信号通路反应(UPR),应激诱导细胞凋亡[6]。内质网应激诱导凋亡主要通过PERK、IRE1α[7-8]、ATF-6信号通路[9],恢复细胞内稳态环境。当发生内质网应激时,PERK信号通路可增加CHOP的表达,减少抗凋亡蛋白(Bcl-2、Bcl-xl)的表达,增加促凋亡蛋白(Bid、Bim、Noxa、Puma)的表达[10-13],最终激活细胞线粒体凋亡途径[14]。同时,PERK磷酸化引起真核起始因子2α(elF2α)发生磷酸化,elF2α磷酸化后可选择性地促进活化转录因子4(ATF-4)的翻译[15],ATF-4可激活CHOP及GADD34的表达[16],而GADD34通过促进蛋白合成增加氧自由基的产生而促进细胞凋亡[17]。近几年的研究发现,活化的IRE1α可与肿瘤坏死因子受体相关因子2(TRAF2)相互作用形成IRE1α-TRAF2复合物,IRE1α-TRAF2复合物可激活TNFα依赖性的细胞凋亡信号1(ASK1),ASK1进一步激活JNK及P38丝裂素活化蛋白激酶(P38MAPK)诱导细胞凋亡。P38MAPK磷酸化后可激活转录因子CHOP,通过增加Bim及死亡受体5(DR5)基因表达、降低Bcl-2基因表达而促进细胞凋亡[18-19]。另有研究发现ATF-6的过度表达可诱导CHOP mRNA表达,还发现ATF-6通过下调抗凋亡分子蛋白MCL-1而增加细胞凋亡[20]。
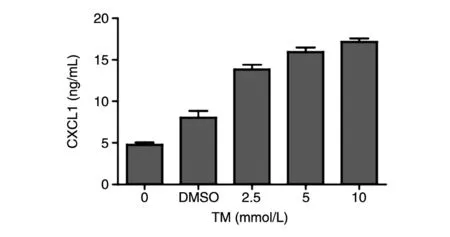
图2 不同浓度TM刺激下HepG2细胞内CXCL1的表达
对卵巢癌的研究发现[21],通过siRNA下调卵巢癌细胞表达CXCLl可以抑制卵巢癌细胞增殖;通过基因重组转入CXCL1基因上调CXCL1表达的卵巢癌细胞的增殖能力明显增强。进一步的研究表明重组CXCL1能够激活卵巢癌细胞的表皮生长因子受体(EGFR)磷酸化过程,提示EGFR旁路在卵巢癌增殖过程中发挥重要作用,EGFR进一步通过活化下游的MAPK通路引起细胞增殖。在CXCL1与肿瘤侵袭转移关系的研究中,已经证实CXCL1可以直接促进人喉鳞状细胞癌[22]、乳腺癌细胞[23]、膀胱癌细胞[24]、肾肿瘤细胞[25]、结肠癌细胞[26]的侵袭转移;另一方面,CXCL1可以通过促进肿瘤血管形成,间接促进肿瘤细胞的侵袭转移[27-28]。对膀胱癌的研究表明,CXCL1的表达上调可以募集更多的肿瘤相关巨噬细胞(TAMS)和癌症相关成纤维细胞(CAF),反过来肿瘤相关巨噬细胞M2型可以募集更多的CXCL1。多数研究证实CXCL1与肿瘤的发生、发展、预后有关。但CXCL1与内质网作为肿瘤微环境中的一部分,CXCL1是否参与UPR,影响肿瘤细胞的凋亡途径,目前还没有研究予以证实。本研究通过荧光定量PCR检测趋化因子CXCL家族在人肝癌HepG2细胞中表达量,结果表明TM组CXCL1、CXCL2、CXCL3的mRNA水平比对照组升高,且CXCL1的mRNA水平与TM浓度具有相关性,而CXCL8的mRNA水平降低。
内质网应激是一个复杂的过程,除了已知的IRE1α、PERK及ATF6,还有很多细胞因子参与其中。本实验探讨了内质网应激对CXCL家族趋化因子的影响,而这些趋化因子对内质网应激信号通路的进一步影响将是值得研究的科学问题。
[1] HetzC.The unfolded protein response:controlling cellfate decisionsunderER stressand beyond[J]. Nat Rev Mol Cell Bio,2012,13(2):89-102.
[2] Cubillos-Ruiz J R,Silberman P C,Rutkowski M R, et al.ER stress sensor XBP1 controls anti-tumor im⁃munity by disrupting dendritic cell homeostasis[J]. Cell,2015,161(7):1527-1538.
[3] Messlik A,Schmechel S,Kisling S,et al.Loss of tolllike receptor 2 and 4 leads to differential induction of endoplasmic reticulum stress and proapoptotic re⁃sponses in the intestinal epithelium under conditions of chronic inflammation[J].J Proteome Res,2009,8(10): 4406-4417.
[4] Hu S,Ciancio M J,Lahav M,et al.Translational inhi⁃bition ofcolonic epithelialheatshock proteinsby IFN-gamma and TNF-alpha in intestinal inflammation [J].Gastroentero,2007,133(6):1893-904.
[5] McGuckin M A,Eri R D.Intestinal secretory cell ER stress and inflammation[J].Biochem Soc Trans,2011, 39(4):1081-1085.
[6] Hughes A,Oxford A E.Endoplasmic reticulum stress and unfolded protein response in cartilage pathophysi⁃ology;contributing factors to apoptosis and osteoarthri⁃tis[J].Int J Mol Sci,2017,18(3):665.
[7] Jiang D,Niwa M,Koong A C.Targeting the IRE1al⁃pha-XBP1 branch of the unfolded protein response in human diseases[J].Semin Cancer Biol,2015,33:48-56.
[8] Jiang S,Yan C,Shao M L,et al.Fibroblast growth factor 21 is regulated by the IRE1α-XBP1 branch of the unfolded protein response and counteracts endo⁃plasmic reticulum stress-induced hepatic steatosis[J].J Biol Chem,2014,289(43):29751-29765.
[9] Guo F J,Xiong Z.ATF6 upregulates XBP1S and in⁃hibits ER stress-mediated apoptosis in osteoarthritis cartilage[J].Cell Signal,2014,26(2):332-342.
[10]Herold M J,O'Reilly L A,Lin A,et al.Evidence against upstream regulation of the unfolded protein re⁃sponse(UPR)by pro-apoptotic BIM and PUMA[J]. Cell Death Dis,2014,5:e1354.
[11]Kazi A,Sun J,Sung S S,et al.The BH3 alpha-heli⁃cal mimic BH3-M6 disrupts Bcl-X(L),Bcl-2,and MCL-1 protein-protein interactionswith Bax,Bak, Bad,or Bim and induces apoptosis in a Bax- and Bim-dependent manner[J].J Biol Chem,2011,286(11): 9382-9392.
[12]Kim H,Tu H C,Ren D,et al.Stepwise activation of BAX and BAK by tBID,BIM,and PUMA initiates mi⁃tochondrial apoptosis[J].Mol Cell,2009,36(3):487-499.
[13]Ren D,Tu H C,Kim H,et al.BID,BIM,and PU⁃ MA are essentialforactivation ofthe BAX- and BAK-dependent cell death program[J].Science,2010, 330(6009):1390-1393.
[14]Han X,Zhou J,Zhang P,et al.IRE1alpha dissociates with BiP and inhibits ER stress-mediated apoptosis in cartilage development[J].Cell Signal,2013,25(11): 2136-2146.
[15]Notte A,Rebucci M,Fransolet M,et al.Taxol-in⁃duced unfolded protein response activation in breast cancer cells exposed to hypoxia:ATF4 activation regu⁃lates autophagy and inhibits apoptosis[J].Int J Bio⁃chem Cell B,2015,62:1-14.
[16]Harding H P,Novoa I,Zhang Y,et al.Regulated translation initiation controls stress-induced gene ex⁃pression in mammalian cells[J].Mol Cell,2000,6(5): 1099-1108.
[17]Nagelkerke A,Bussink J,Mujcic H,et al.Hypoxia stimulatesmigration ofbreastcancercellsvia the PERK/ATF4/LAMP3-arm of the unfolded protein re⁃sponse[J].Breast Cancer Res,2013,15(1):R2.
[18]Heath-Engel H M,Chang N C,Shore G C.The endo⁃plasmic reticulum in apoptosis and autophagy:role of the BCL-2 protein family[J].Oncogene,2008,27(50): 6419-6433.
[19]Chonghaile T N,Gupta S.BCL-2 modulates the un⁃folded protein response by enhancing splicing of X-box binding protein-1[J].Biochem Biophys Res Com⁃mun,2015,466(1):40-45.
[20]Moore K,Hollien J.Ire1-mediated decay in mammali⁃an cellsrelieson mRNA sequence,structure,and translational status[J].Mol Biol Cell,2015,26(16):2873-2884.
[21]Bolitho C,Hahn M A,Baxter R C,et al.The chemo⁃kine CXCL1 induces proliferation in epithelial ovarian cancer cells by transactivation of the epidermal growth factor receptor[J].Endocr Relat Cancer,2010,17 (4):929-940.
[22]Han L,Liu W,Chen Y,et al.GROalpha expression and its prognostic implications in laryngeal squamous cell carcinoma[J].Neoplasma,2015,62(1):152-158.
[23]Kronski E,Fiori M E,Barbieri O,et al.miR181b is induced by the chemopreventive polyphenol curcumin and inhibits breast cancer metastasis via down-regula⁃tion of the inflammatory cytokines CXCL1 and 2[J]. Mol Oncol,2014,8(3):581-595.
[24]Kawanishi H,Matsui Y,Ito M,et al.Secreted CX⁃CL1 is a potential mediator and marker of the tumor invasion of bladder cancer[J].Clin Cancer Res,2008, 14(9):2579-2587.
[25]AliS,Lazennec G.Chemokines:noveltargetsfor breast cancer metastasis[J].Cancer Metast Rev,2007, 26(3-4):401-420.
[26]Li A,Varney M L,Singh R K.Constitutive expres⁃sion of growth regulated oncogene(gro)in human co⁃lon carcinoma cells with different metastatic potential and its role in regulating their metastatic phenotype [J].Clin Exp Metastas,2004,21(7):571-579.
[27]Miyake M,Goodison S.Expression of CXCL1 in hu⁃man endothelialcells induces angiogenesis through the CXCR2 receptor and the ERK1/2 and EGF path⁃ways[J].Lab Invest,2013,93(7):768-778.
[28]BelperioJA,KeaneM P,ArenbergD A,et al. CXC chemokinesin angiogenesis[J].JLeukoc Biol, 2000,68(1):1-8.
