铜绿假单胞菌重组Bb-OprI疫苗免疫及PA01株感染后小鼠脾细胞因子IL-17和Treg的变化
2018-04-09刘潇李文桂
刘潇,李文桂
重庆医科大学 附属第一医院 传染病寄生虫病研究所,重庆 400016
铜绿假单胞菌(Pseudomonas aeruginosa,Pa)是院内感染的主要病原体之一。Pa易定植,且耐药机制多样复杂,可导致免疫力受损或囊性纤维化(cystic fibrosis,CF)等患者发生难以清除的感染[1]。疫苗具有良好的特异性,且受耐药机制的影响小,为防治Pa感染提供了新的思路。
Pa的外膜蛋白I(outer membrane protein I,OprI)是一种具有较高保守性的外膜蛋白,既往研究[2-3]证实OprI具有良好的免疫原性,是Pa疫苗研制有希望的候选分子之一。两歧双歧杆菌(Bifi⁃dobacterium bifidum,Bb)不仅是人与动物肠道内重要的益生菌之一,其稳定表达外源抗原的特征使其成为新型疫苗载体的研究热点[4]。
本课题组前期研究发现重组Bb-OprI疫苗可诱导免疫小鼠CD4+T细胞比例升高[5]。Th17细胞是重要的CD4+T细胞之一,既往研究[6-7]表明Th17细胞及其分泌的IL-17在宿主对Pa感染的免疫防御中有重要作用。CD4+CD25+Foxp3+T细胞是机体重要的调节性T细胞(regulatory T cell,Treg),与Th17细胞相互拮抗[8],在维持机体自身的免疫稳定中发挥不可或缺的作用[9-10]。我们拟将重组Bb-OprI疫苗接种BALB/c鼠,用PA01株攻击后研究脾细胞IL-17和Treg的变化,探索其免疫机制及对Pa感染的保护作用。
1 材料与方法
1.1 材料
21只SPF级雌性BALB/c小鼠,购自重庆医科大学实验动物中心;重组Bb-OprI疫苗由本所构建并保存;铜绿假单胞菌PA01株由重庆医科大学附属儿童医院余加林教授惠赠。
DNA抽提试剂盒、PCR试剂盒、RPMI1640培养基、胎牛血清(FBS)、青霉素、链霉素购自上海生工公司;LB液体培养基、LB固体培养基、MRS液体培养基和铜绿假单胞菌抗原(Pa antigen,PaAg)由本所保存;PCR仪、电泳仪、凝胶成像分析仪购自Bio-Rad公司;离心机购自Eppendorf公司;CO2培养箱购自Thermo Forma公司。
1.2 动物免疫及攻击方案
BALB/c鼠随机分为Bb-OprI疫苗组、空载体(Bb-pGEX-1λT)对照组和Bb对照组,每组7只,用100 μL MRS培养基重悬5×109CFU的疫苗进行灌胃接种,每周连续接种3 d,连续接种3周。初次接种后4周用10 μL LB液体培养基重悬5× 106CFU的PA01株进行滴鼻攻击。
1.3 肺组织菌落计数
PA01株攻击后2周处死小鼠,分离肺组织,匀浆稀释后涂布于LB固体培养基,37℃培养48 h,计数菌落数。
1.4 脾细胞制备
分离小鼠脾脏,常规制备脾细胞悬液,用含10%FBS、1×105U/L青霉素和1×105μg/L链霉素的RPMI1640培养基使脾细胞重悬,调整细胞终浓度为5×106/mL。
1.5 脾细胞诱导和培养
细胞培养板中加入上述制备的1 mL脾细胞悬液和10 μg PaAg,37℃、5%CO2条件下培养48 h,4000 r/min离心5 min收集脾细胞。
1.6 PCR扩增脾细胞IL-17和Foxp3基因
用DNA提取试剂盒提取脾细胞DNA,以此为模板扩增IL-17和Foxp3基因,引物由上海生工公司合成(表1)。反应体系均为50 μL,包括25 μL 2×PCR Master,2 μL上、下游引物,2 μL DNA模板,19 μL灭菌双蒸水。反应条件:①IL-17:95℃ 1 min;95℃ 5 s,60℃ 5 s,72℃ 30 s,46个循环;72℃ 10 min;②Foxp3:95℃ 5 min;95℃ 10 s,55℃ 30 s,72℃ 30 s,40个循环;72℃ 10 min。扩增产物进行1.2%琼脂糖凝胶电泳鉴定。
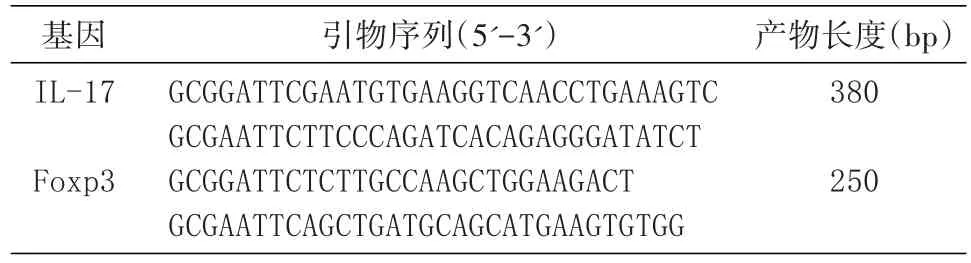
表1 PCR引物
1.7 统计学分析
用SPSS20.0软件对实验数据进行分析。实验数据以x±s表示,多组间比较用Kruskal-Wallis检验,P<0.05为差异有统计学意义。
2 结果
2.1 肺组织的菌落计数
Bb-OprI疫苗组、空载体对照组和Bb对照组小鼠肺组织的菌落数分别为(0.46±0.09)×108、(5.42±0.79)×108和(6.20±0.95)×108CFU,Bb-OprI疫苗组明显低于空载体对照组(P<0.01)和Bb对照组(P<0.01),2个对照组之间差异无统计学意义(P>0.05)(图1)。
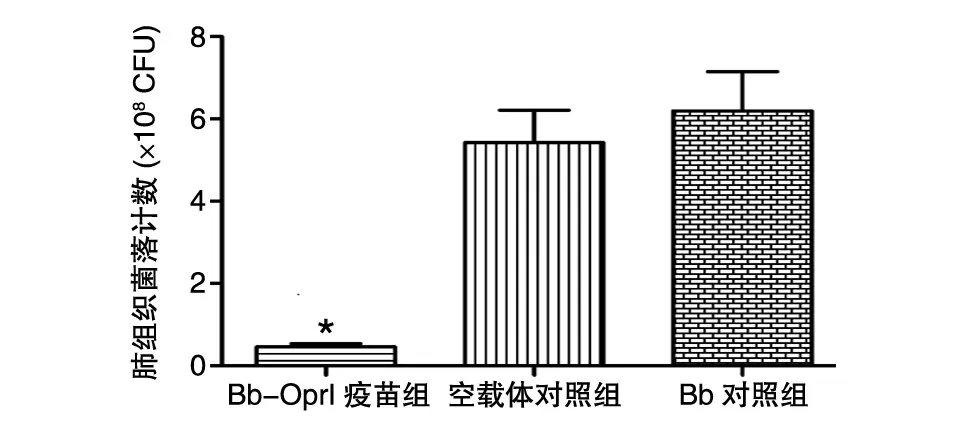
图1 疫苗免疫及PA01株攻击后小鼠肺组织的菌落计数*:与空载体和Bb对照组相比,P<0.01
2.2 IL-17和Treg检测
PCR检测表明,疫苗组可扩增出380 bp的IL-17基因及250 bp的Foxp3基因(图2、3)。空载体对照组和Bb对照组未能扩增出IL-17和Foxp3编码基因。
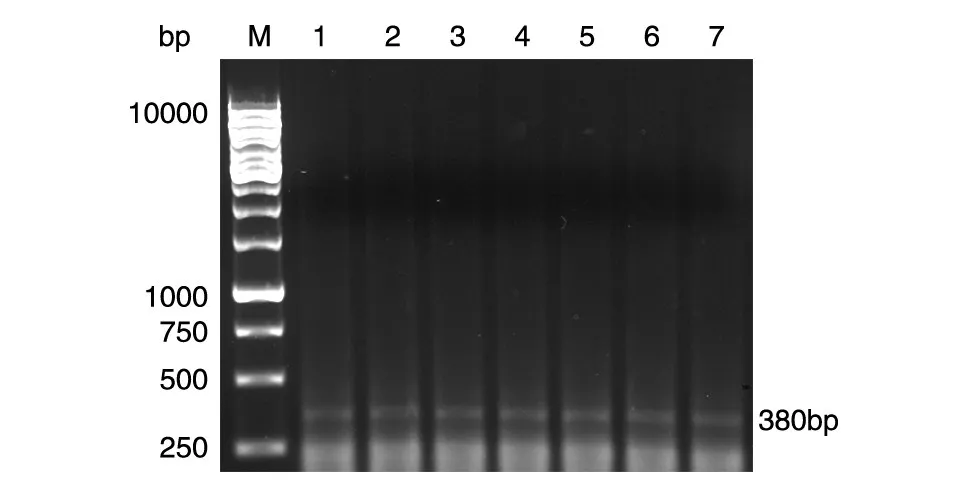
图2 疫苗免疫及PA01株攻击后小鼠脾细胞IL-17基因的PCR扩增结果M:DNA marker;1~7:IL-17基因的PCR产物
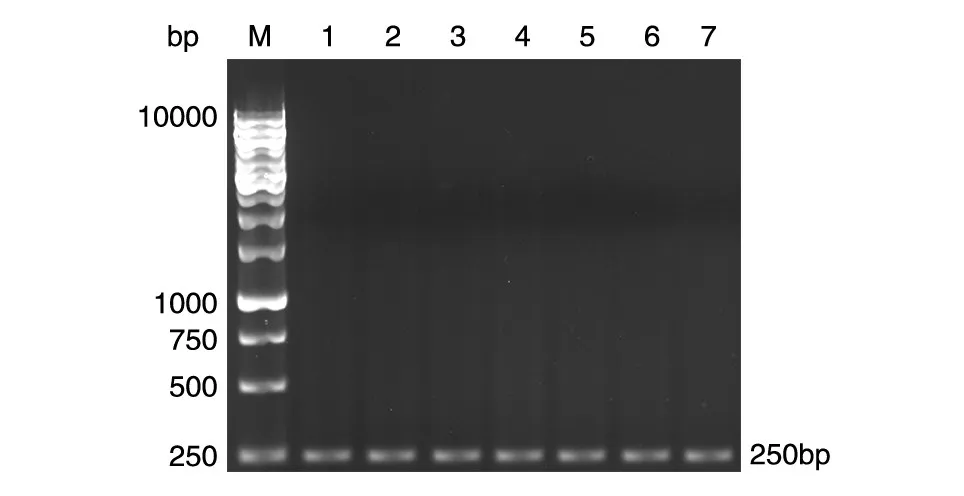
图3 疫苗免疫及PA01株攻击后小鼠脾细胞Foxp3基因的PCR扩增结果M:DNA marker;1~7:Foxp3基因的PCR产物
3 讨论
Yang等[2]将OprI蛋白加Al(OH)3佐剂肌肉注射免疫BALB/c鼠,发现PA01株攻击后免疫鼠的肺组织Pa负荷量明显减少。本研究将重组Bb-OprI疫苗灌胃接种BALB/c鼠,发现PA01株攻击后免疫鼠肺组织的细菌菌落数显著减少,与上述研究结果相似,表明该疫苗可诱导小鼠产生一定的保护力。
Liu等[7]发现急性Pa感染后,Th17细胞产生IL-17迅速增多,用IL-17抗体中和IL-17后,小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中的细菌数明显增多,肺组织的病理损伤明显加重,粒细胞集落刺激因子(granulocyte colo⁃ny-stimulating factor,G-CSF)和角质形成细胞趋化物(keratinocyte chemoattractant,KC)水平下降,使肺组织募集的中性粒细胞显著减少。Xu等[11]发现感染Pa后,小鼠BALF中IL-17水平和中性粒细胞计数显著升高;在正常小鼠气管内滴入表达IL-17的pcDNA3.1-IL-17质粒,可使BALF中促炎症因子IL-1β、巨噬细胞炎症蛋白2(macro⁃phage inflammatory protein-2,MIP-2)和G-CSF及中性粒细胞升高,PA01株攻击后小鼠肺组织细菌计数明显减少,生存率显著升高。这些研究结果提示IL-17可能通过下游因子的作用,募集中性粒细胞等免疫细胞发挥抵御Pa感染的保护作用。Chen等[12]在肺炎克雷伯菌肺部感染小鼠的模型中证实,在多个血清型间保守的外膜蛋白免疫小鼠可使纵膈淋巴结的记忆性Th17细胞活化增殖,从而提供长期的保护力。Aguado-Martínez等[13]将OprI与犬新孢子虫的嵌合蛋白Mic3-1-R融合并免疫小鼠,发现融合蛋白诱导脾细胞产生的IL-17水平明显高于单个Mic3-1-R蛋白。Yang等[2]将OprI外膜蛋白加Al(OH)3佐剂肌肉注射免疫BALB/c鼠,末次免疫后2周脾细胞IL-17升高,保护力实验显示该蛋白疫苗可以提高2倍LD50的PA01株攻击后小鼠的生存率。这些研究结果提示OprI蛋白作为疫苗分子或佐剂,均具有较好的诱导Th17免疫应答的能力,从而抵抗Pa的感染。本研究中我们用重组Bb-OprI疫苗灌胃免疫BALB/c鼠,PA01株攻击后免疫鼠脾细胞IL-17升高,与上述研究[2]相似,提示Bb-OprI疫苗可诱导小鼠产生Th17免疫应答。推测抗原提呈细胞将OprI抗原呈递给脾CD4+T细胞,在转化生长因子β(transforming growth factor-β,TGF-β)和IL-6的诱导下,CD4+T细胞向Th17细胞分化,分泌IL-17并形成记忆性Th17细胞,在PA01株攻击后,菌体的OprI蛋白刺激记忆性Th17细胞迅速大量增殖,分泌更高水平的IL-17,刺激肺泡上皮细胞分泌单核细胞趋化蛋白-1(monocyte chemotac⁃tic protein-1,MCP-1)、MIP-1α/β和趋化因子CX⁃CL13等,募集并活化巨噬细胞[14-15],通过氧依赖途径等杀伤Pa;分泌CXCL8和G-CSF等,募集并激活中性粒细胞吞噬和清除Pa[16]。
疫苗免疫产生适当的免疫应答可为机体提供良好的保护力,但过度的免疫应答则有可能造成机体损伤。Mulcahy等[17]发现CF患者外周血中Th17细胞的比例越高,肺功能越差。丁凤鸣等[18]证实Pa慢性感染后小鼠Th17细胞功能亢进而导致的IL-17水平持续升高,可使小鼠肺组织持续被大量的以中性粒细胞为主的白细胞浸润,中性粒细胞释放氧化剂和蛋白酶等成分造成肺组织严重的免疫性病理损伤[19]。因此,由Treg介导的免疫调节作用至关重要。Sanchez等[9-10]证实在病原体初次感染时,Treg通过TCR被特异性抗原激活,并且不显著影响CD4+T细胞的增殖和分化,初次免疫应答后激活的Treg可转化为记忆性Treg,再次免疫应答时,记忆性Treg以比初次免疫更快的速度和更多的数量增殖并募集至感染部位,通过分泌大量IL-10抑制CD4+T细胞的大量增殖,从而在不影响病原体清除的情况下抑制过强的再次免疫应答产生的组织损伤。Hector等[20]发现CF患者的外周血Treg的数量与肺功能正相关,慢性Pa感染的CF患者Treg数量明显降低,记忆性Treg的数量也显著下降,Treg细胞对非Treg细胞的抑制功能下降,提示Treg细胞在保护Pa感染患者的肺功能及改善预后方面有重要作用。本研究发现重组Bb-OprI疫苗免疫及PA01株攻击后,免疫鼠脾细胞中Treg增多,推测Bb-OprI疫苗免疫后,能够诱导记忆性Treg生成,PA01株攻击后Treg增殖活跃,活化的Treg分泌TGF-β和IL-10等细胞因子[21],作用于Th17细胞,抑制其过度增殖与活化,最终表现为在保证有足够的Th17细胞参与免疫应答并清除Pa感染的前提下,防止过多的IL-17所诱发的炎症反应和免疫损伤,保持内环境稳定的免疫状态。
本研究选用的疫苗分子OprI蛋白是一种无毒性、无致热原性,并且在Pa的多个血清型间具有保守性的疫苗分子[22];本研究所用疫苗载体为Bb,使该疫苗具有安全无毒和接种方便等优点,重组Bb-OprI疫苗的研制有望为抗Pa感染治疗提供新的思路。后续将进一步摸索疫苗免疫的剂量和途径,研究疫苗的保护性免疫机制等。
[1]Ullah W,Qasim M,Rahman H,et al.Beta-lactamaseproducing Pseudomonas aeruginosa:Phenotypic charac⁃teristics and molecular identification of virulence genes [J].J Chin Med Assoc,2017,80(3):173-177.
[2] Yang F,Gu J,Yang L,et al.Protective efficacy of the trivalentPseudomonasaeruginosa vaccine candi⁃date PcrV-OprI-Hcp1 in murine pneumonia and burn models[J/OL].Sci Rep,2017,7(1):3957.
[3] Hassan R,El-Naggar W,Abd El-Aziz A M,et al. Immunization with outer membrane proteins(OprF and OprI)and flagellin B protects mice from pulmonary in⁃fection with mucoid and nonmucoid Pseudomonas aeru⁃ginosa[J].J Microbiol Immunol Infect, 2017. doi: 10.1016/j.jmii.2016.08.014.
[4] 谭建蓉,李文桂,覃婷.日本血吸虫重组Bb(pGEXSj32)疫苗免疫BALB/c小鼠诱导免疫应答的动态研究[J].中国人兽共患病学报,2015,31(9):805-811.
[5] 刘潇,李文桂.两歧双歧杆菌介导的铜绿假单胞菌外膜蛋白I(Bb-OprI)疫苗免疫增强小鼠对铜绿假单胞菌的抑制作用[J].细胞与分子免疫学杂志,2017,33(8):1040-1044.
[6] Bayes H K,Ritchie N D,Evans T J.Interleukin-17 is required for control of chronic lung infection caused by Pseudomonas aeruginosa[J].Infect Immun, 2016,84(12):3507-3516.
[7] Liu J,Feng Y,Yang K,et al.Early production of IL-17 protects against acute pulmonary Pseudomonas aeru⁃ginosa infection in mice[J].FEMS Immunol Med Mi⁃crobiol,2011,61(2):179-188.
[8] Noack M,Miossec P.Th17 and regulatory T cell bal⁃ance in autoimmune and inflammatory diseases[J].Au⁃toimmun Rev,2014,13(6):668-677.
[9] Sanchez A M,Zhu J,Huang X,et al.The develop⁃ment and function of memory regulatory T cells after acute viral infections[J].J Immunol,2012,189(6):2805-2814.
[10]Brincks E L,Roberts A D,Cookenham T,et al.Anti⁃gen-specific memory regulatory CD4+Foxp3+T cells control memory responses to influenza virus infection [J].J Immunol,2013,190(7):3438-3446.
[11]Xu X,Shao B,Wang R,et al.Role of Interleukin-17 in defense againstpseudomonas aeruginosa infection in lungs[J].Int J Clin Exp Med,2014,7(4):809-816.
[12]Chen K,McAleer J P,Lin Y,et al.Th17 cells medi⁃ate clade-specific,serotype-independent mucosal im⁃munity[J].Immunity,2011,35(6):997-1009.
[13]Aguado-Martínez A,Basto A P,Müller J,et al.N-ter⁃minal fusion of a toll-like receptor2-ligand to a Neosporacaninum chimeric antigen efficiently modi⁃fies the properties of the specific immune response[J]. Parasitology,2016,143(5):606-616.
[14]Gopal R,Rangel-Moreno J,Slight S,et al.Interleu⁃kin-17-dependent CXCL13 mediates mucosal vaccineinduced immunity against tuberculosis[J].Mucosal Im⁃munol,2013,6(5):972-984.
[15]Liu J,Qu H,Li Q,et al.The responses of γδ T-cells against acute Pseudomonas aeruginosa pulmonary infection in miceviainterleukin-17[J].PathogDis, 2013,68(2):44-51.
[16]Pelletier M,Maggi L,Micheletti A,et al.Evidence for a cross-talk between human neutrophils and Th17 cells[J].Blood,2010,115(2):335-343.
[17]Mulcahy E M,Hudson J B,Beggs S A,et al.High peripheralblood Th17 percentassociated with poor lung function in cystic fibrosis[J/OL].PLoS One,2015, 10(3):e0120912.
[18]丁凤鸣,朱松雷,沈策.Th1和Th17细胞功能失调在铜绿假单胞菌慢性肺部感染中的致病作用[J].免疫学杂志,2012,28(6):510-514.
[19]Kruger P,Saffarzadeh M,Weber A N,et al.Neutro⁃phils:Between host defence,immunemodulation,and tissue injury[J/OL].PLoS Pathog,2015,11(3):e1004651.
[20]Hector A,Schäfer H,Pöschel S,et al.Regulatory T-cell impairment in cystic fibrosis patients with chron⁃ic Pseudomonas infection[J].Am J Respir Crit Care Med,2015,191(8):914-923.
[21]Stewart C A,Metheny H,Iida N,et al.Interferon-de⁃pendent IL-10 production by Tregs limits tumor Th17 inflammation[J].J Clin Invest,2013,123(11):4859-4874.
[22]Basto A P,Morais J,Marcelino E,et al.An efficient depyrogenation method for recombinant bacterial outer membrane lipoproteins[J].Protein Expr Purif,2014,98: 10-17.
