鸡白痢沙门氏菌阳性血清国家标准品制备用菌株的筛选
2018-04-09魏财文王秀丽彭国瑞张一帜辛凌翔蒋玉文
张 媛,魏财文,李 建,王秀丽,彭国瑞,张一帜,辛凌翔,蒋玉文
(中国兽医药品监察所,北京 100081)
鸡沙门氏菌病包括鸡白痢、鸡伤寒以及鸡副伤寒,是影响养鸡业的细菌性传染病,严重影响雏鸡成活率,也是成年鸡减产的重要隐患之一,而且会造成其肉蛋产品的污染,进而带来或引起食品安全问题[1]。水平传播和垂直传播在鸡白痢的流行过程中均发挥着重要作用[2]。感染鸡白痢沙门氏菌和鸡伤寒沙门氏菌的种鸡所产的蛋带菌率高达33%[3]。鸡沙门氏菌病普遍存于我国鸡养殖业中,对养鸡业危害极大[4-6]。
目前国内对于鸡沙门氏菌病,尤其是对鸡白痢和鸡伤寒还无有效的疫苗可用。控制鸡白痢、鸡伤寒最有效的措施是参照中华人民共和国农业行业标准《NY/T 536-2017鸡伤寒和鸡白痢诊断技术》[7]对鸡群进行鸡白痢-鸡伤寒抗体检测,淘汰阳性鸡只。鸡白痢鸡伤寒诊断试剂质量直接影响检测结果的准确性,需要使用标准物质对试剂质量进行评价与控制。中国兽医药品监察所是我国兽用标准物质研制、供应的法定单位,已有多年制备鸡白痢抗原和阳性血清的经验,但还需继续对阳性血清进行系统标准化研究。
英国国家生物标准与检定所(National Institute for Biological Standards and Control, NIBSC),是世界卫生组织WHO的一个国际标准品供应中心,研制和供应鸡白痢沙门氏菌阳性血清标准型及变异型标准品。鸡白痢阳性血清国际标准品由于制备过程复杂、需组织国际协作标定、费用较高、供应量少等原因,而难于被广泛用于鸡白痢鸡伤寒诊断结果的确认、诊断技术的验证。因此,亟需研制相应国家标准品。
鸡白痢沙门氏菌是研究、制备鸡白痢沙门氏菌阳性血清国家标准品的基础,筛选出抗原性及免疫原性良好的制备用菌株是标准物质建立的关键和重要前提,对标准物质的质量具有很大影响。本课题组从10株来源背景清晰的鸡白痢沙门氏菌菌株中筛选出分别符合标准型菌株特性及变异型菌株特性且抗原效价较为理想的CVCC79201株菌株及CVCC79207株菌株,两株菌均具备较好的免疫原性,可分别用于制备标准型鸡白痢沙门氏菌阳性血清国家标准品及变异型鸡白痢沙门氏菌阳性血清国家标准品。
1 材料与方法
1.1菌株备选鸡白痢沙门氏菌菌株,共10株,均为CVCC保藏[8]。各菌株来源历史如表1所示。

表1 实验所用菌株Tab 1 Strains in the test
1.2培养基及试剂普通肉汤、普通琼脂、硫代硫酸钠琼脂、磷酸盐缓冲盐水(0.07 mol/L,pH7.0~7.2)均购自北京中海动物保健科技公司。革兰氏染色液、沙门氏菌生化鉴定管均购自青岛高科技工业园海博生物技术有限公司。国际标准品Anti-S.Pullorum Serum(S)、 Anti-S.Pullorum Serum(V)购自英国国家生物标准与检定所。沙门氏菌O9定型血清购自丹麦国家血清研究院。Premix Taq购自TaRaKa公司。MarkerⅡ购自Biomed公司。琼脂糖购自宝生物工程(大连)有限公司。染料Goldview购自Biotium公司。细菌比浊标准管购自中国食品药品检定研究院。沙门氏菌O122、O123定型血清、1∶500吖啶黄溶液、PCR阴性对照品(大肠杆菌PCR产物)、鸡白痢鸡伤寒多价染色平板抗原参考品均由中国兽医药品监察所细菌制品检测室提供。
1.3PCR引物选取沙门氏菌invA基因合成引物,上游引物为5'-TGTTCGTCATTCCATTACCT-3',下游引物为5'-ATCGGCATCAATACTCATCT-3',引物均由上海Invitrogen公司合成。
1.4实验动物1.5~2.0 kg健康家兔购自北京维通利华实验动物技术有限公司。
1.5形态取菌种培养物进行革兰氏染色,镜检。
1.6生化特性参照试剂的使用说明书进行检定。
1.7培养特性菌种接种普通肉汤和普通琼脂平板,37 ℃培养24 h,观察细菌生长特性。
1.8变异检查将菌种的普通琼脂新鲜培养物,与1∶500吖啶黄溶液及生理盐水分别进行平板凝集反应。
1.9PCR检测无菌操作取1.0 mL灭菌生理盐水于1.5 mL EP管中,用接种环挑取不同菌种的菌落纯培养物置于灭菌生理盐水中,沸水浴5 min,放置低温迅速冷却,备用。PCR体系:Premix Taq 12.5 μL,上游引物和下游引物各0.5 μL,模板溶液2 μL,三蒸水10.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 45 s,53 ℃ 45 s,72 ℃ 45 s,共32个循环;最后72 ℃ 5 min,20 ℃ 5 min。PCR产物电泳鉴定:配制2.0 %琼脂糖溶液,按50 μL /L加Goldview制胶,取7 μL PCR产物点样,以Marker Ⅱ作对照,120 V电泳20 min取出凝胶,在凝胶成像仪上观察结果。
1.10血清学特性参照试剂的使用说明书进行检定。
1.11抗原性鉴定用菌种接种硫代硫酸钠琼脂扁瓶培养基,收集菌苔后,调整菌液浓度为2.0×1010CFU/mL,灭活后制备成平板凝集反应抗原。将WHO标准实验室提供的Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)国际标准品进行稀释,使其终浓度分别为500 IU/mL (强阳性血清)及10 IU/mL (弱阳性血清)。取稀释好的强阳性血清与弱阳性血清分别与反应抗原进行平板凝集试验,2 min内记录结果。
1.12免疫原性
1.12.1免疫抗原的制备根据抗原性鉴定结果,分别选择抗原效价最好的标准型鸡白痢沙门氏菌及变异型鸡白痢沙门氏菌各1株制备免疫抗原。接种硫代硫酸钠琼脂扁瓶,置37 ℃培养48 h,取纯粹生长的扁瓶,吸弃凝集水,用含2 %甲醛溶液的磷酸盐缓冲盐水(0.07 mol/L,pH7.0~7.2)将培养物洗下,收集于带玻璃珠的中性玻璃瓶中,振荡打碎菌块,置37 ℃灭活48 h,经无菌检验合格后,无水乙醇沉淀浓缩,以细菌比浊标准管为标准确定其浓度。保存于2~8 ℃备用。
1.12.2免疫程序家兔静脉注射免疫原6次,免疫剂量分别为1.0×109、2.0×109、4.0×109、8.0×109、1.6×1010、3.2×1010CFU/只,每次间隔7日,末次注射7日后试血。如血清效价不够,再用最后免疫剂量注射1次,当血清效价达到1∶2560以上,方可采血。
1.12.3血清制造以常规方法采血,提取血清,按血清总量的0.02%加入硫柳汞。
1.12.4血清效价测定用菌种接种硫代硫酸钠琼脂扁瓶培养基,收集菌苔后,调整菌液浓度为1.0×109CFU/mL,灭活后制备成试管凝集反应抗原。将血清稀释成1∶400、1∶800、1∶1600……1∶12800等稀释度;同法稀释Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)国际标准品。吸取每个稀释度的血清加入试管中,每管1.0 mL,每管加入试管凝集反应抗原1.0 mL。抗原对照为含0.5 %苯酚生理盐水1.0 mL与试管凝集反应抗原1.0 mL混合,观察是否有自凝现象。振摇混匀后,置37 ℃反应20 h,然后置室温2 h,记录结果。
2 结 果
2.1形态经染色观察,10株菌均为革兰氏阴性小杆菌。
2.2生化特性10株菌的生化特性均符合沙门氏菌的特性。
2.3培养特性10株菌在普通肉汤中的生长均为一致混浊,在普通琼脂平板上均生长为光滑湿润、微隆起、半透明的圆整菌落。
2.4变异检查经平板凝集试验,10株菌与1∶500吖啶黄溶液和生理盐水均不发生凝集。
2.5PCR检测用根据沙门氏菌invA基因合成的引物进行PCR扩增,10株菌均可扩增出395 bp的特异性条带,扩增结果见图1。
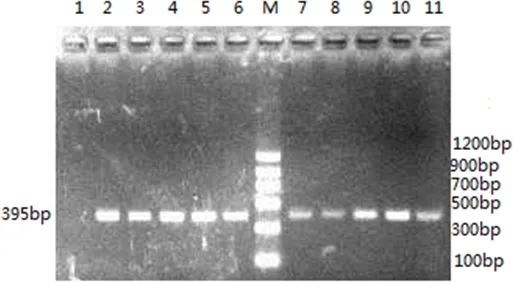
M:Marker Ⅱ;1:阴性对照:大肠杆菌;2:79207株;3:79201株;4:532株;5:531株;6:530株;7:529株;8:528株;9:527株;10:526株;11:523株M: Marker Ⅱ; 1: Negative control: E.coli; 2: CVCC79207 strain; 3: CVCC79201 strain; 4: CVCC532 strain; 5:CVCC531 strain; 6: CVCC530 strain; 7: CVCC529 strain; 8: CVCC528 strain; 9: CVCC527 strain; 10: CVCC526 strain; 11: CVCC523 strain图1 10株菌invA PCR产物的电泳Fig 1 Electrophoresis of invA PCR products from 10 strains
2.6血清学特性经平板凝集试验,CVCC523、526、527、528、79201株菌的血清型为沙门氏菌O9、O123,为标准型鸡白痢沙门氏菌;CVCC529、530、531、532、79207株菌的血清型为沙门氏菌O9、O122,为变异型鸡白痢沙门氏菌。
2.7抗原性鉴定经抗原性鉴定,CVCC523、526、527、528、529、530、531、532、79201、79207株菌制备的抗原与WHO标准实验室提供的Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)国际标准品的强阳性血清和弱阳性血清均能发生不同程度的凝集反应,但标准型菌株中的CVCC79201株及变异型菌株中的CVCC79207株制备的抗原与国际标准品Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)的凝集效价均高于其它抗原,效价测定结果见表2。平板凝集反应判定标准:++++表示出现明显的颗粒状或片状凝集,液体完全透明,即100%凝集;+++表示出现明显的颗粒状或片状凝集,但液体微现混浊,即75%凝集;++表示出现均匀一致的凝集颗粒,液体中等混浊,即50%凝集;+表示出现细微颗粒,液体混浊不透明,即25%凝集;-表示未出现凝集,液体完全混浊不透明,即无凝集。当50 μL抗原与50 μL含0.5%苯酚生理盐水无凝集(-)时试验成立。

表2 10株菌的抗原性鉴定结果Tab 2 Antigenic characteristics of 10 strains
经形态、生化特性、培养特性、变异检查、PCR检测结果表明,CVCC523、526、527、528、529、530、531、532、79201、79207均为沙门氏菌。根据血清学特性、抗原性鉴定结果,CVCC79201株及CVCC79207株分别符合鸡白痢沙门氏菌标准型菌株及变异型菌株的特性,且抗原效价最为理想。
2.8免疫原性免疫CVCC79201株制备的标准型抗原的6只家兔血清试管凝集效价均高于Anti-S.Pullorum Serum(S)国际标准品血清效价,免疫CVCC79207株制备的变异型抗原的6只家兔血清试管凝集效价均高于Anti-S.Pullorum Serum(V)国际标准品血清效价,见表3、表4。试管凝集反应判定标准:++++表示抗原呈坚实凝块或呈细沙粒样均匀铺于孔底,且孔底不可见抗原沉积,即100%凝集;+++表示抗原均匀铺于孔底,边缘可有卷曲,且孔底可见微量抗原沉积,即75%凝集;++表示抗原沉积于孔底,可形成扣状或环状,孔底沉积的抗原明显少于生理盐水对照,且沉积的抗原四周有明显凝集颗粒,即50%凝集;+表示抗原沉积于孔底,可形成扣状或环状,孔底沉积的抗原略小于生理盐水对照,且沉积的抗原的四周有少量凝集颗粒,即25%凝集;-表示抗原沉积于孔底,边缘光滑整齐,且不可见凝集颗粒者,即无凝集。判定时应按血清最终稀释度计算,如第一管中血清稀释倍数为1∶400,其加入等量抗原后最终稀释度为1∶800。当抗原对照无凝集(-)时试验成立,以出现不低于"++"凝集的最高血清最终稀释度判定为血清效价。
可见,CVCC79201株及CVCC79207株均具备较好的免疫原性,故选用标准型鸡白痢沙门氏菌CVCC79201株作为制备鸡白痢沙门氏菌阳性血清国家标准品(标准型)的生产菌株,选用变异型鸡白痢沙门氏菌CVCC79207株作为制备鸡白痢沙门氏菌阳性血清国家标准品(变异型)的生产菌株。
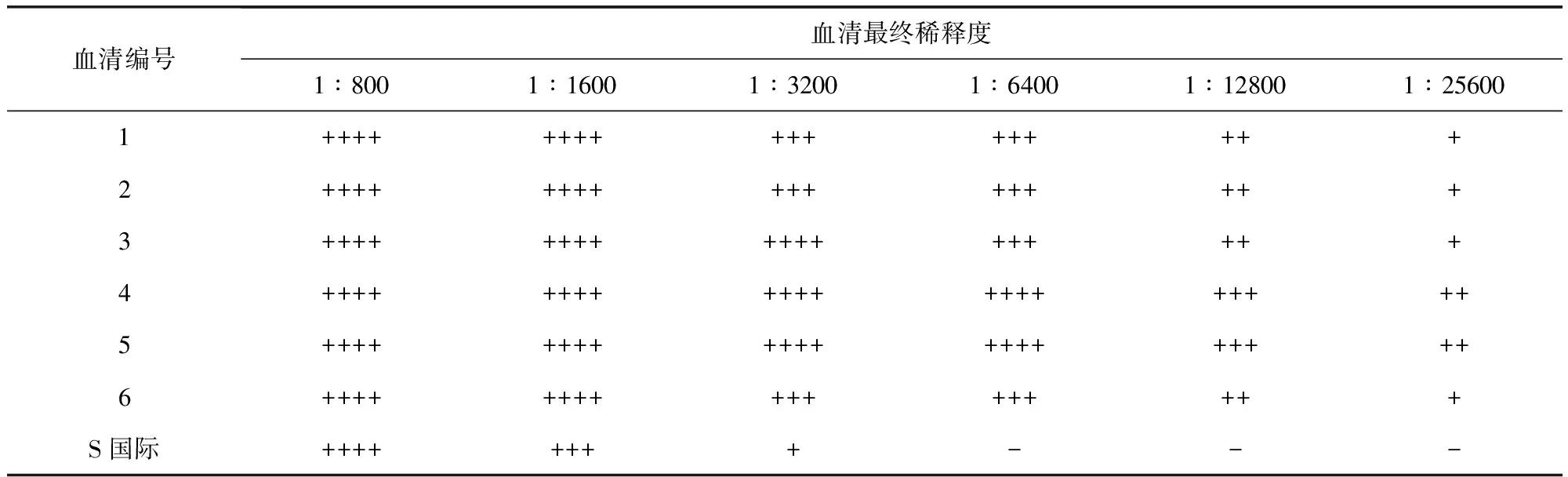
表3 抗鸡白痢沙门氏菌血清(标准型)效价测定结果Tab 3 Potency of Anti-S.Pullorum Serum(S)
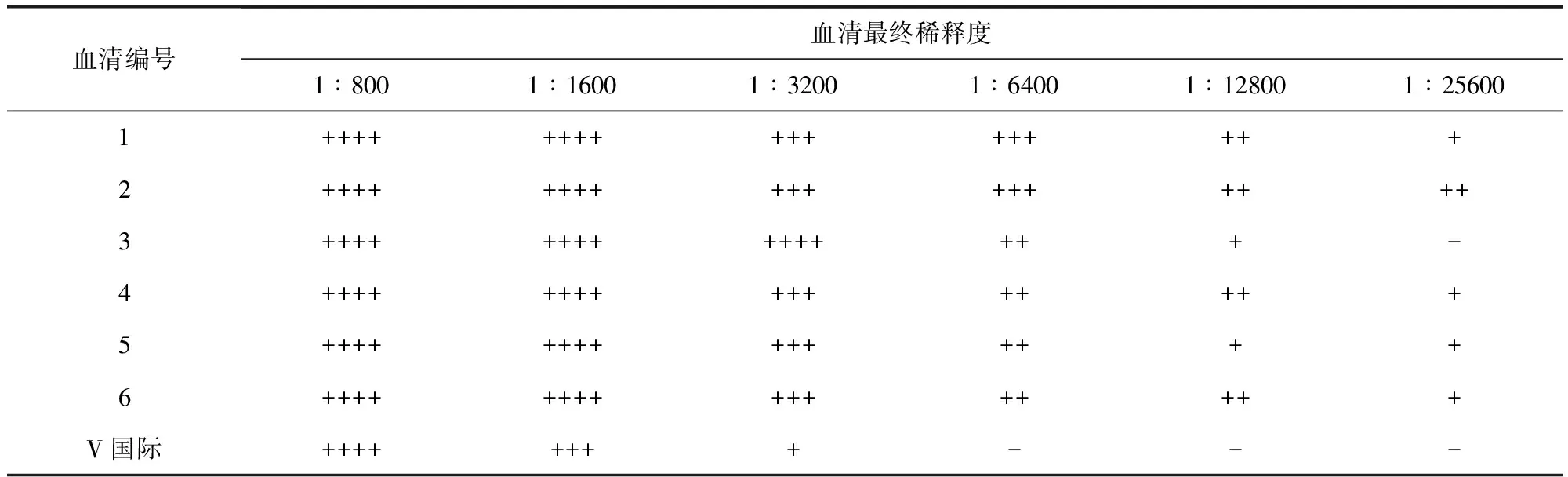
表4 抗鸡白痢沙门氏菌血清(变异型)效价测定结果Tab 4 Potency of Anti-S.Pullorum Serum(V)
3 讨 论
根据《中华人民共和国兽药典》二〇一五年版[9]规定,鸡白痢、鸡伤寒多价染色平板凝集试验阳性血清诊断试剂制备方法中要求使用鸡白痢沙门氏菌阳性血清国家标准品进行标定。但是,鸡白痢沙门氏菌阳性血清国家标准品尚未形成统一的标准化的制备规程。课题组按照《中华人民共和国兽药典》二〇一五年版及《兽用生物制品规程》二〇〇〇年版相关要求,开展鸡白痢沙门氏菌阳性血清国家标准品的研制工作。生产用菌株是制备标准物质最主要的原材料,菌株自身的特性直接关系到标准物质的质量,因此选定生产用菌种是研制鸡白痢沙门氏菌阳性血清国家标准品的首要工作。
英国威桥国际生物标准品实验室(NIBSC)是WHO的一个国际标准品供应中心实验室。美国国家兽医服务实验室(NVSL)和瑞典国家兽医研究所(SVA)是分别隶属于美国农业部和瑞典农业部领导的动物疫病诊断官方权威机构,均是国家兽医参考实验室。10株备选菌株多数是中国兽医微生物菌种保藏管理中心从此三个实验室引进的标准菌株,背景清晰、毒力强、免疫原性稳定,适宜用作制备阳性血清国家标准品的候选菌株。
CVCC79201株及CVCC79207株菌完全符合鸡白痢沙门氏菌的特性,而且具备良好的抗原性及免疫原性,可以作为制备鸡白痢沙门氏菌阳性血清国家标准品(标准型)及鸡白痢沙门氏菌阳性血清国家标准品(变异型)的生产用菌株。标准型鸡白痢沙门氏菌CVCC79201株抗原制备的抗血清效价均不低于1∶12800,变异型鸡白痢沙门氏菌CVCC79207株抗原制备的抗血清效价均不低于1∶6400,均高于标准型及变异型鸡白痢沙门氏菌阳性血清国际标准品1∶1600的血清效价,这不仅保证了用此两株菌制备的国家标准血清含有不低于国际标准血清的活性物质,而且可获得较高的产量。制备出的鸡白痢沙门氏菌阳性血清国家标准品将作为实物标尺用于鸡白痢沙门氏菌抗原参考品、诊断试剂以及鸡白痢沙门氏菌阳性血清诊断试剂的效价标定,减少不同厂家及同一厂家不同批次产品间差异,使种鸡场鸡白痢抗体检测结果更准确,从而促进鸡白痢净化工作的开展。
参考文献:
[1]谢懋英, 赖 婧, 马立才, 等. 肉鸡产业链中沙门菌流行情况及其耐药性[J]. 中国兽医学报, 2014, 34(11): 1790-1794.
Xie M Y, Lai J, Ma L C, et al. Prevalence and antimicrobial resistance of Salmonella in a broiler meat production chain from farm level to retail[J]. Chinese Journal of Veterinary Science,2014,34(11):1790-1794.
[2]殷俊磊, 李求春, 耿士忠, 等. 鸡白痢沙门菌研究进展[J]. 中国兽医学报, 2016, 36(9): 1624-1629.
Yin J L, Li Q C, Geng S Z, et al. Advances inSalmonellapullorum[J]. Chinese Journal of Veterinary Science, 2016, 36(9): 1624-1629.
[3]张永第. 鸡白痢沙门氏菌的分离鉴定及微量平板凝集抗原的制备[D]. 陕西:西北农林科技大学, 2010.
Zhang Y D. Isolation and identification ofSalmonellapullorumand preparation of micro plate agglutination antigen[D]. Shaanxi: Northwest Agriculture and Forestry University,2010.
[4]王 亮. 山东省部分种鸡场鸡白痢和滑液囊支原体病的流行病学调查[D]. 山东:山东农业大学, 2015.
Wang L. The epidemiology investigation of pullorosis andMycoplasmasynovial on partial breeding chicken farms, Shandong[D]. Shandong Agricultural University,2015.
[5]方 翟. 湖北省鸡源沙门氏菌的分离鉴定和耐药性分析[D]. 湖北:华中农业大学, 2014.
Fang D. Isolation, identification and antibiotic resistance study ofSalmonellafrom chickens in Hubei province[D]. Huazhong Agricultural University,2014.
[6]钱明珠, 王申峰, 许兰菊, 等. 河南鸡源沙门菌的分离鉴定及其耐药性分析[J]. 畜牧与兽医, 2012, 44(8):29-33.
Qian M J, Wang S F, Xu L J, et al. Isolation and identification ofSalmonellafrom chickens in Henan and drug resistance[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(8): 29-33.
[7]NY/T 536-2017. 鸡伤寒和鸡白痢诊断技术[S].
NY/T 536-2017. Diagnostic techniques for fowl typhoid and pullorum disease[S].
[8]中国兽医药品监察所.中国兽医菌种目录[M]. 2版. 北京:中国农业科学技术出版社, 2002: 94 -95.
China Institute of Veterinary Drugs Control. China veterinary species catalogue [M]. 2nd ed. Beijing: Chinese Agricultural Science and Technology Press, 2002: 94-95.
[9]中华人民共和国兽药典二〇一五年版三部[S].
Veterinary Pharmacopoeia of People's Republic of China (Volume Ⅲ, 2015) [S].
