一株鸭源禽流感病毒(H9N2)全基因序列分析及其排毒规律的研究
2018-04-09杨玲玲王晓艺常维山刘玉庆
杨玲玲,牛 凯,王 涛,王晓艺,常维山*,刘玉庆
(1.山东农业大学动物科技学院,山东泰安 271018; 2.烟台市牟平区姜格庄街道畜牧兽医工作站,山东烟台 264114; 3. 山东省农业科学院畜牧兽医研究所,济南 250100; 4.山东省潍坊市潍城区畜牧兽医管理局,山东潍坊 261000)
禽流感(Avian influenza,AI)是由正黏病毒科流感病毒属的A型流感病毒(Avian influenza virus,AIV)引起的一种急性接触性传染病,呈世界性发生和流行。目前已知的禽流感有16个HA亚型和9个NA亚型[1]。自1994年我国首次报道鸡群分离到H9N2亚型AIV以来[2],H9N2亚型低致病性AIV广泛存在于我国大部分地区[3]。鸡、火鸡、鸭、鹅和鹌鹑等家禽及野鸟、水禽、海鸟等均可感染[4]。家鸭被认为是AIV的巨大储存库,在AIV由野生水禽到陆生禽类的传播过程中充当中间媒介的作用。自1999年H5N1亚型高致病性禽流感病毒引起鸭、鹅高发病率和高致死率,打破了对水禽仅为流感病毒的携带者而不发病死亡的传统认识[5-6]。
实验研究了一株从发病鸭体内分离到的H9N2亚型AIV,命名为JN1株。通过对该H9N2亚型AIV进行全基因序列测定及遗传进化分析,明确了其全基因特征和遗传进化关系,利用点眼滴鼻人工接种3周龄雏鸭,研究H9N2亚型AIV感染雏鸭后的排毒规律及雏鸭感染后的抗体水平,为预防和控制禽流感的发生提供参考。
1 材 料
1.1病毒及实验动物毒株来自济宁送检样品,由山东农业大学动物科技学院预防兽医细胞免疫实验室分离,命名为JN1株。SPF种蛋购自山东省家禽研究所。试验用雏鸭购自山东省泰安市某孵化场。H5、H9N2亚型禽流感血凝抑制试验标准抗原与标准血清购自哈尔滨兽医研究所。
1.2主要仪器与试剂7500型荧光定量PCR仪(ABI公司);TRIzol UP、Taq DNA聚合酶、dNTPs、大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;SanProp柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒购自上海生工生物工程有限公司;PrimeScriptTMRT Reagent Kit、PMD18-T Vetor、SYBR Premix EX TaqTM、PrimerScriptTMRT Reagent Kit、PMD18-T Vector Cloning Kit购自宝生物工程(大连)有限公司。
1.3引物的设计与合成用于荧光定量PCR的H9N2亚型禽流感HA基因(KY212947)cDNA的扩增引物为:HA-F:TCGGAACGGGACCTACAATA,HA-R:CACAAGAGATGAGGCGACAG;内参基因β-actin(M26111)cDNA的扩增引物为:β-actin-F:ACTTCTGTTGCTGCCGTTCT,β-actin-R:AGCCCCGTGATGGTTACTG。利用Primer5.0软件设计,引物自身不形成二级结构,引物间没有互补序列。用于扩增H9N2亚型AIV全基因的引物是根据GenBank上公布的禽源H9N2亚型AIV全基因序列并参照孟芳等[7]发表的引物进行设计,所有引物由上海生工生物有限公司合成。
2 方 法
2.1生物学特性测定取新鲜病毒尿囊液,按照国际兽医局(OIE)方法进行鸡胚半数感染量(EID50)、鸡胚最小致死量的平均死亡时间(MDT)、静脉致病指数(IVPI)的测定。

2.3JN1株全基因测序与序列分析参照TRIzol UP说明书提取病毒RNA,用流感病毒反转录通用引物Uni12(5'-AGCAAAAGCAGG-3'),按照PrimeScriptTM RT Reagent Kit说明书进行反转录合成cDNA,进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳、凝胶回收和纯化后连接至PMT18-T载体转入DH5α,用PCR方法鉴定重组质粒,将阳性重组质粒送由上海生工生物工程技术服务有限公司进行序列测定。应用Lasergene 7.1软件拼接测序的基因片段并推导氨基酸序列,构建8个基因的系统发育树,同时对其编码的氨基酸进行分析,最后将序列上传至NCBI。实验用的参考株分别为DK/HK/Y280/97(AF156376)、CK/SH/F/98(AF461532)、CK/BJ/1/94(KF188294)、Qa/HK/G/97(AF156378)、Ty/Wisconsin/1/66(AB295601)、DK/HK/Y439/97(KF188265)。
2.4JN1株排毒规律的研究
2.4.1试验分组与攻毒20只3周龄健康雏鸭,通过点眼滴鼻途径每只接种1 mL病毒尿囊液(107.84EID50/只)。于感染后0、2、3、5、7、9、11、13、15、17 d采集泄殖腔以及咽拭子,用于排毒规律的测定;于感染后第7、11、14、17、20天经颈静脉随机采集5只雏鸭的血液分离血清,参照OIE (2008) 标准进行 HA/HI-test 测定抗体滴度。所有样品置于-20 ℃冰箱保存。
2.4.2样品棉拭子荧光定量PCR检测参照TRIzol UP说明书提取棉拭子中病毒RNA,用分光光度计测定RNA纯度和浓度,合成cDNA。按照建立的荧光定量PCR检测方法,对样品进行检测并对数据结果进行统计学分析。
3 结 果
3.1生物学特性测定JN1株EID50为10-7.54/0.2 mL,MDT为72 h,IVPI为0.26,表明该毒株为低致病力毒株。
3.3JN1株全基因序列分析
3.3.1全基因核酸序列比较将JN1株8个基因序列提交到GenBank,登录号为KY212942-KY212949。JN1株的全基因序列与GenBank上公布的多个H9N2亚型AIV的全基因序列进行同源性比较,结果显示,JN1株的各个基因与GenBank上下载的H9N2毒株的核苷酸的相似性范围:HA 80.3%~98.0%、NA 83.3%~99.6%、M 92.3%~100%、NP 89.1%~99.7%、NS 91.0%~98.3%、PA 87.4%~99.7%、PB1 89.8%~99.8%、PB2 84.2%~99.6%(表1)。
3.3.2HA基因上关键氨基酸位点分析JN1株 HA基因片段长1690 bp,具有完整的开放阅读框,编码560个氨基酸。氨基酸序列分析表明:JN1株的HA裂解位点处的氨基酸序列为PSRSSR↓GL仍符合低致病性H9N2亚型AIV的特点。HA受体结合位点与DK/HK/Y280基本一致,仅在198位不同;受体结合位点左侧壁(232-237)为NGLMGR,右侧壁为GTSTA。第234位氨基酸残基为Leu,具有同哺乳动物唾液酸α-2,6受体结合的特性。利用NetNGlyc1.0分析HA基因潜在的糖基化位点,发现 JN1株中存在6个潜在糖基化位点,与DK/HK/Y280相比,缺少了218~220位NRT位点和551~553位NGS位点,增加了313~315位NCS位点(表2)。
3.3.3NA上关键氨基酸位点分析JN1株NA基因片段长度1457 bp,编码466个氨基酸。氨基酸序列分析表明:JN1株缺少63~65位T、E、I三个氨基酸残基,这一缺失导致JN1株减少了61~63位潜在的糖基化位点。红细胞吸附位点分析表明:NA基因红细胞吸附位点367~372位点处为KKDSRS,400~403位点处为SDNW,431~433位点处为PQE,与欧亚经典毒株基本一致,研究表明,此区域对NA的酶活性具有重要的作用[8](表3)。

表1 JN1株与流感病毒主要参考株的核苷酸相似性比较Tab 1 Comparison of nucleotide similarity of JN1with influenza virus reference strains
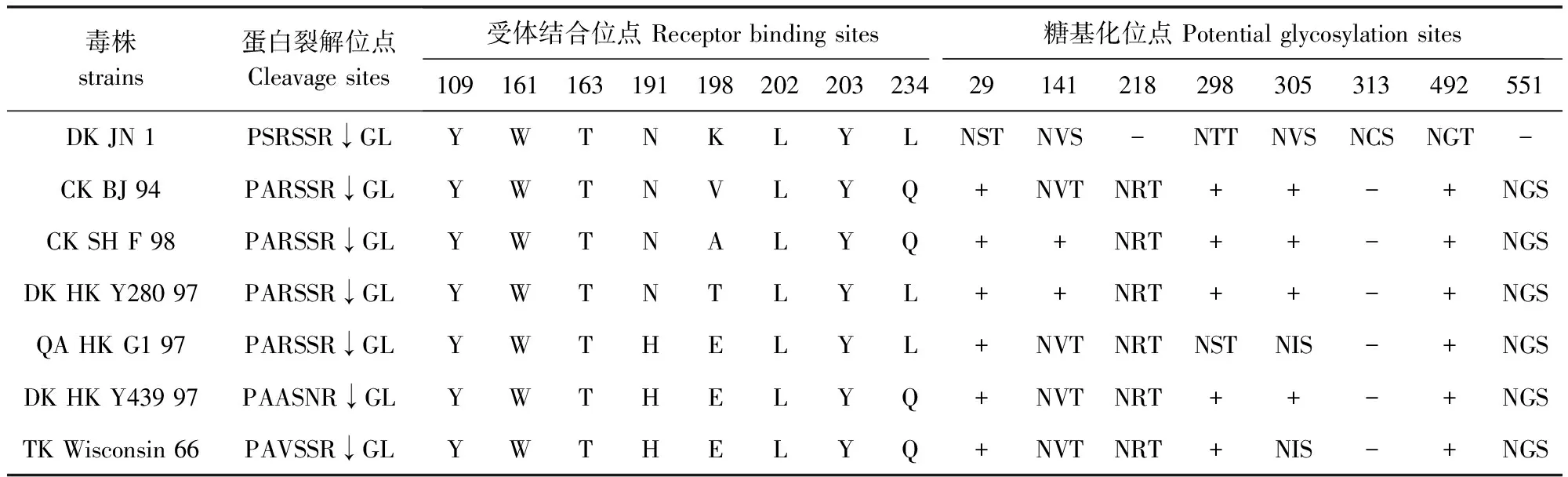
表2 HA蛋白关键位点的氨基酸序列比较Tab 2 Comparison of the key amino acid residues in the amino acid sequence of HA protein
+:具有与DK JN 1株相同的糖基化位点;-:糖基化位点缺失
+:Contain the same potential glycosylation sites as DK JN1; -:Lost potential glycoslation sites

表3 NA蛋白糖基化位点及红细胞吸附位点氨基酸序列分析Tab 3 Comparison of potential glycosylation sites and HB sites in the amino acid sequence of NA protein
+:具有与DK JN 1株相同的糖基化位点;-:糖基化位点缺失
+:Contain the same potential glycosylation sites as DK JN1; -:Lost potential glycoslation sites
3.3.4JN1株PB2、PB1和PA基因的序列分析PB2基因627位氨基酸的变化对于病毒感染哺乳动物有着极大的影响,禽源PB2的第627位谷氨酸(Glu,E)突变为赖氨酸(Lys,K)时,病毒能在小鼠体内高效复制[9]。JN1株PB2基因片段长度为2280 bp,编码760个氨基酸,627位不存在突变。PB1中的L13P和S678N的氨基酸差异是导致对小鼠致病力增强的关键,JN1株的13位出现了L/P的变异,但678位仍为S,表明JN1株对小鼠的致病力有增强的趋势。PA基因中的S224P和N383D突变,能够增强H5N1亚型AIV对鸭的致病力[10],而JN1株为S224和383D。
3.3.5JN1株M、NP、和NS基因的序列分析JN1株M基因片段长度1027 bp,编码有完整的M1和M2蛋白。氨基酸序列分析发现JN1株M2蛋白在31位S上发生了N的取代。NP基因蛋白的A184K变异可能在影响禽流感病毒的繁殖与致病力方面具有关键的作用[11],而N319K的变异可能是对小鼠致病力增强的关键[12],JN1株184位为K,319位则为N。JN1株的NS1的第92位氨基酸为D,具有目前国内鸡源H9N2毒株的典型特征。149位为A,而非V,具有与高致病性AIV相关的NS基因特征。
3.3.6JN1株各基因的系统发生树分析为了进一步探究JN1株AIV各基因的遗传进化关系,应用MegAlign软件,绘制了JN1株8个基因片段的系统发育基因进化树。JN1株HA属于以CK/HK/G9/97和DK/HK/Y280/9毒株为代表的Ⅰ群(G9群)。参考C Li 等[13]对中国分离的H9亚型AIV的系统发生分析结果,NA、M、NP、PA、PB1、PB2基因位于系统发育树的SH/F/98-like分支。NS基因经Blast对比,发现其与H5N1亚型AIV进化关系较近,说明本分离JN1株NS基因可能由H5N1传播而来(图1-图4)。
3.4雏鸭感染JN1株AIV病毒后的排毒规律在试验过程中,攻毒雏鸭未出现死亡情况,无明显临床症状。利用实验室建立的荧光定量检测方法对攻毒样品进行检测。雏鸭泄殖腔棉试子与咽拭子荧光定量PCR检测结果见图5,可以看出,雏鸭感染AIV病毒后,泄殖腔棉拭子和咽拭子的排毒规律基本一致。在攻毒后第2天即可检测到排毒,在检测过程中,出现了两个排毒高峰,无论是泄殖腔棉拭子还是咽拭子,均在第3 天达到排毒高峰,在第11天排毒量降到最低,第13 天突然升高,后降低。在排毒过程中,咽拭子排毒量要高于泄殖腔棉拭子,但差异不显著(P>0.05)。


图1 JN1株和其他AIV毒株HA、NA的系统发生树Fig 1 Phylogenic trees of the individual genes HA and NA of JN1 strain and other AIV
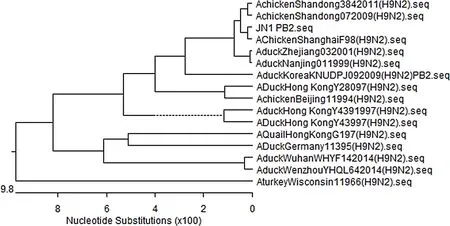

图2 JN1株和其他AIV毒株PB2、PB1的系统发生树Fig 2 Phylogenic trees of the individual genes PB2 and PB1 of JN1 strain and other AIV


图3 JN1株和其他AIV毒株PA、NP的系统发生树Fig 3 Phylogenic trees of the individual genes PA and NP of JN1 strain and other AIV

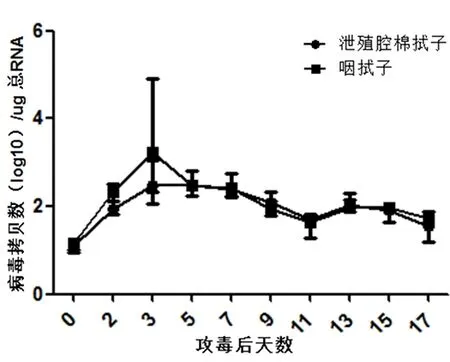
纵坐标为每微克总RNA中病毒拷贝数,其中病毒拷贝数以log10为单位进行表示图5 AIV病毒在试验鸭泄殖腔棉拭子与咽拭子中的排毒规律Fig 5 Results of AIV excretion in cloaca and pharynx after inoculation
3.5攻毒样品血清抗体水平检测试验攻毒前对3周龄的雏鸭采血取血清进行HI试验,结果为阴性。攻毒感染后21 d内观察雏鸭,攻毒组的雏鸭精神状态良好,食欲正常,无死亡情况和无明显的发病症状。攻毒后 7 d、11 d、14 d、17 d、20 d,采血取血清进行HI 试验结果显示,雏鸭接种JN1株之后7~17 d抗体效价缓慢上升,但抗体效价一直维持在较低水平(图6)。

图6 抗体检测结果Fig 6 The result of antibody test
4 讨 论
研究发现,鸭源H9N2亚型AIV血凝素裂解位点氨基酸序列特征与分离地区密切相关,中国大陆地区欧亚种系的鸭源H9N2亚型AIV裂解位点为-RSSR↓GL-,其他国家和地区分离的鸭源H9N2亚型AIV不具备这一特征[14]。从血凝素第226位受体结合位点看,中国鸭源H9N2亚型AIV有相当一部分为L,具有同哺乳物唾液酸α-2,6 受体结合的特性[15]。通过对JN1株AIV HA蛋白潜在的糖基化位点分析表明缺少了218~220位和551~553位的糖基化位点,而在313~315增加了一个潜在的糖基化位点,新增糖基化位点的出现可能改变病毒的抗原性并影响受体结合特性而感染新的宿主[13-14]。
Liu等[16]报道我国近年来H9N2亚型AIV NA基因颈部第63、64、65位点上有3个氨基酸(T、E、I)连续缺失,而与中国邻近的韩国、巴基斯坦鸡源H9N2亚型AIV分离株NA没有类似的氨基酸丢失[17],该缺失被认为是我国H9N2亚型AIV的一个分子标签,有报道此缺失可增强致病性[18]。试验中的JN1株,符合上述特征。
M基因的编码区由两部分组成,分别编码M1蛋白和M2蛋白。M2蛋白27位V,30位A,尤其是31位S的变异在对离子通道阻断剂(金刚烷胺和金刚乙胺)产生抗性方面发挥着重要作用[19]。JN1株在31位S上发生了N的取代,说明这些病毒对金刚烷胺产生了耐药性,应该引起高度重视。
JN1株NS1基因第92位氨基酸为D,Seo等[20]研究发现NS1蛋白的第92位氨基酸为D时,毒株通常具有低致病,但是氨基酸序列分析发现其149位氨基酸为A,而不是V,具有与高致病性AIV相关的NS 基因特征。同时,在对NS基因序列进行核酸进化分析时发现,NS基因与H5N1亚型AIV基因同源率高达99%,而和H9N2亚型AIV的同源率最高仅在94.6%,这说明JN1株NS基因很有可能是从H5N1亚型AIV传播而来。
H9亚型AIV在鸭中很少引起发病,但研究结果表明,水禽尤其是鸭,是流感病毒的贮存库,对AIV的发生及传播起到了非常重要的作用。本试验利用分离到的鸭源H9N2亚型AIV(JN1株)人工感染3周龄雏鸭,研究结果表明,H9N2亚型AIV在感染后第2~21天均有排毒,在感染后第3天达到排毒高峰,之后在第13天出现第2个排毒高峰,咽拭子和泄殖腔棉拭子规律一致。王蛟等[21]在对H9N2亚型AIV对樱桃谷鸭致病性的研究中,得出经滴鼻攻毒的雏鸭在攻毒后第4天到达排毒高峰,在第10天检测不到病毒;魏宝芝等[22]对H9N2亚型AIV进行气源性传播特点的研究中,第4天开始排毒,第6天排毒量最高,到第14天检测不到病毒。试验中在攻毒后第11天排毒量检测结果接近阴性,在第13天出现第2个排毒高峰,推测原因是在试验过程中存在再感染的存在。血清HI抗体效价结果显示,雏鸭感染后血清效价一直维持在较低的水平。Kida等[23]曾报道,在感染流感和免疫流感过程中,鸭产生的抗体效价低,维持时间短,并且可以在短时间内感染同一种亚型的流感病毒。
参考文献:
[1]Alexander Dennis J. An overview of the epidemiology of avian influenza[J]. Vaccine, 2006, 25(30):1016-1051.
[2]陈伯伦, 张泽纪, 陈伟斌. 禽流感研究I.鸡A型禽流感病毒的分离与血清学初步鉴定[J]. 中国兽医杂志, 1994, 10: 3-5.
Chen B L, Zhang J Z, Chen W B,etal. Isolation and preliminary serological identification of avian influenza virus-type A from chickens[J]. Chinese Journal of Veterinary Medicine, 1994, 10:3-5.
[3]刘 东, 刘红祥, 王群义, 等. 规模化肉鸡场H9N2亚型禽流感与传染性支气管炎流行病学调查[J]. 中国家禽, 2014, 6: 62-64.
Liu D, Liu H X, Wang Q Y,etal. The epidemiological investigation of H9N2 subtype avian influenza and infectious bronchitis in large-scale broiler farms[J]. China Poultry, 2014, 6: 62-64.
[4]B.W.卡尔尼克. 禽病学(第十版)[M]. 高 福, 苏敬良, 译. 北京: 中国农业出版社, 1999: 742-758.
B.W. Carnik. Disease of poultry(tenth edition)[M]. Gao F, Su J L, translation. BeiJing: China Agriculture Press, 1999: 742-758.
[5]Kim J K, Negovetich N J, Forrest H L,etal. Ducks: the "Trojan horses" of H5N1 influenza [J] .Influenza Other Respir Viruses, 2009, 3 (4):121-128.
[6]Fereidouni S R, Starick E, Beer M,etal. Highly pathogenic avian influenza virus infection of mallards with homo- and heterosubtypic immunity induced by low pathogenic avian influenza viruses[J]. PLoS One, 2009, 4 (8): e6706.
[7]孟 芳. H9N2亚型禽流感HA基因演化及其内部基因在H5N2亚型流感病毒演化中的作用[D].山东农业大学, 2015.
Meng F. HA genetic variation analysis of H9N2 avian influenza virus and its internal impact on H5N2 mutants generated[D]. Shandong Agricultural University, 2015.
[8]Webster R G, Air G M, Metzger D W. Antigenic structure and variation in an influenza virus N9 neuraminidase[J]. J Virol, 1987, 61(9):2910-2916.
[9]Shinya Kyoko, Hamm Stefan, Hatta Masato,etal. PB2 amino acid at position 627 affects replicative efficiency, but not cell tropism, of Hong Kong H5N1 influenza A viruses in mice[J]. Virology, 2004, 320(2):258-266.
[10] Song J, Feng H, Xu J,etal. The PA protein directly contributes to the virulence of H5N1avian influenza viruses in domestic ducks[J]. Journal of Virology, 2011, 85(5):2180-2188.
[11] Wasilenko J L, Lee C W, Sarmento Letal. NP, PB1, and PB2 viral genes contribute to altered replication of H5N1 avian influenza viruses in chickens[J]. J Virol, 2008, 82(9):4544-4553.
[12] Gabriel G, Dauber B, Wolff T,etal. The viral polymerase mediates adaptation of an avian influenza virus to a mammalian host[J]. Proc Natl Acad Sci USA, 2005, 102(51):18590-18595.
[13] Li C, Yu K, Tian G,etal. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J]. Virology, 2005, 340(1):70-83.
[14] 万春和, 傅光华, 程龙飞, 等. 鸭源H9N2 AIV血凝素基因序列比较[J]. 病毒学报, 2012, (2):158-164.
Wan C H, Fu G H, Cheng L F,etal. Sequence comparison of the hemagglutinin gene of the duck-origin H9N2 subtybe avian influenza viruses[J]. Chinese Journal of Virology, 2012, (2):158-164.
[15] Ito T, Kawaoka Y, Shi W,etal. Host-range barrier of influenza A viruses[J]. Vet Microbiol, 2000, 74(1/2):71-75.
[16] Liu Jin-Hua, Okazaki K, Shi Wei-Min,etal. Phylogenetic analysis of neuraminidase gene of H9N2 influenza viruses prevalent in chickens in China during 1995-2002[J]. Virus Genes, 2003, 27(2):197-202.
[17] Tosh C1, Nagarajan S, Behera P,etal. Genetic analysis of H9N2 avian influenza viruses isolated from India[J]. Arch Virol, 2008, 153(8): 1433-1439.
[18] Munier S, Larcher T, Cormier-Aline F,etal. A genetically engineered waterfowl influenza virus with a deletion in the stalk of the neuraminidase has increased virulence for chickens[J]. J Virol, 2010, 84(2): 940-952.
[19] Intharathep P, Laohpongspaisan C, Rungrotmongkol T,etal. How amantadine and rimantadine inhibit proton transport in the M2 protein channel[J]. J Mol Graph Model, 2008, 27, (3): 342-348.
[20] Seo S H, Hoffmann E, Webster R G. The NS1 gene of H5N1 influenza viruses circumvents the host anti-viral cytokine responses[J]. Virus Res, 2004, 103(1/2):107-113.
[21] 王 蛟, 刁有祥, 孙晓艳, 等. H9N2亚型禽流感病毒对樱桃谷肉鸭的致病性[J]. 中国兽医学报, 2014, (11):1732-1737.
Wang J, Diao Y X, Sun X Y,etal. Experimental infection with a duck-origin H9N2 avian influenza virus in cherry valley ducks[J]. Chinese Journal of Veterinary Science, 2014, (11):1732-1737.
[22] 魏宝之, 杨 燕, 胡家卿, 等. H9N2亚型AIV全基因序列分析及重组病毒R01/NASS气源性传播的特点[J]. 畜牧兽医学报, 2013, (07):1099-1108.
Wei B Z, Yang Y, Hu J Q,etal. Whole genome sequence analysis of H9N2 AIV and the characteristic of airborne transmission of the recombinant virus R01/NASS[J]. Chinese Journal of Animal and Veterinary Sciences, 2013, (7): 1099-1108.
[23] Kida H, Yanagawa R, Matsuoka Y. Duck influenza lacking evidence of disease signs and immune response[J]. Infect Immun, 1980, 30(2): 547-553.
