一起猪蓝耳病与伪狂犬病混合感染的紧急流行病学调查
2018-04-09董雅琴刘林青赵桂华李晓成兰邹然
董雅琴,刘林青,李 艳,赵桂华,李 印,李晓成,兰邹然
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 中国动物疫病预防控制中心,北京 100125;3. 莒南县动物疫病预防控制中心,山东莒南 276600;4. 山东省动物疫病预防与控制中心,山东济南 250022)
猪蓝耳病,学名猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS),是目前猪场常发病毒性免疫抑制性疾病。其病原为猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),不同品种、年龄、性别的猪只均可感染,临床表现为母猪繁殖障碍与生长猪呼吸道症状[1-2]。2012年,我国学者分离到与美国PRRSV变异株NADC30毒株基因同源性较高的毒株[3],统称为类NADC30毒株(NADC30-like毒株)。此类毒株逐渐成为继高致病性蓝耳病后我国又一田间优势流行毒株[4],临床上主要导致母猪流产、产死胎或弱仔等繁殖障碍,流产率高达30%~40%,保育及生长育肥猪严重的呼吸道症状,易继发细菌感染,死淘率可达15%~20%[4-5]。研究表明,现有PRRS疫苗不能有效保护猪只免受此类毒株的侵害[6-7]。
伪狂犬病(Pesudorabies,PR),又称奥耶兹氏病,是由伪狂犬病毒(Pesudorabies virus,PRV)引起的以痒、脑脊髓炎为主要特征的多种动物传染病[8]。猪是PRV的天然宿主和储存宿主。PRV感染主要引起母猪流产、产木乃伊胎等繁殖障碍,成年猪轻微呼吸和消化系统症状,幼年猪神经症状和腹泻等。PRV也会侵害仔猪的免疫系统,造成仔猪免疫力低下,从而继发感染其他病原,给猪场造成严重经济损失[9]。
2017年11月初,山东省某猪场育肥猪、哺乳仔猪、保育猪陆续出现咳嗽、气喘、发烧等症状,随后1周左右死亡,其间还有个别母猪发生流产。11月中旬,经该地动物疫病预防控制中心初步治疗,疫情未见好转。截至11月底,累计发病猪只近200头,病死50余头。12月2日,调查组了解情况后立即赶赴现场进行了调查。
1 方法
1.1 病例定义
1.1.1可疑病例 2017年11月4日至12月20日,该养殖场出现咳嗽、气喘、发烧症状之一的猪,以及出现流产的妊娠母猪。
1.1.2死亡病例 2017年11月4日至12月20日,死亡的可疑病例。
1.1.3确诊病例 可疑病例的淋巴结、肺、脾、扁桃体、肾等组织样品,经PCR/RT-PCR检测,结合扩增产物测序分析,PRRSV野毒与PRV野毒均为阳性的。
1.2 调查方式
1.2.1现场调查 到发病养殖场户实地调查,察看生产记录;与养殖场管理人员座谈,了解发病经过、免疫、治疗、日常饲养管理以及猪只调运等信息;进入猪场生产区,观察养殖环境、圈舍卫生状况;同时搜索可疑病例,进行临床诊断及病理剖检。
1.2.2抽样检测 结合临床诊断和病理剖检得出初步结论后,分别采集1头发病仔猪及1头死亡仔猪的淋巴结、扁桃体、肺、脾、肾等病变组织样品,进行PRRSV、猪瘟病毒(CSFV)、PRV、猪圆环病毒2型(PCV2)等高热类病原的PCR/RT-PCR检测;将阳性样品的扩增产物送上海生工生物工程有限公司测序,以判定是否为野毒感染。
1.2.3数据收集、整理和分析 用Excel整理收集到的有关猪只发病和死亡信息,并进行数据分析,对疫情分布情况进行描述性分析。
2 结果
2.1 现场调查
2.1.1养殖场基本情况 该场2011年开始启用,为某饲料企业合作猪场,且为该公司明星示范场。该场养殖规模中等,现有员工8人,包括场主1人、技术员1人、饲养员6人。现有猪舍6栋,每个饲养员负责1栋。存栏生猪约2 150头,其中能繁母猪120头,采取自繁自养的连续饲养模式。该场还混养鸡、鹅数十只。养殖场毗邻乡村小路,与另外两家小规模猪场(A、B)仅一路之隔,距居民区约300 m。该场对主要猪病均进行常规免疫。2017年初至此次疫情暴发前,猪群比较健康,仅有正常的零星发病和死淘现象。养殖场地理位置及功能区划见图1。

图1 疫点地理位置(左)与功能区域布局(右)
2.1.2疫病经过及防控情况 11月4日起,该猪场育肥猪出现咳嗽、气喘、发低烧(40℃)等症状;7日起,3头妊娠中期母猪先后发生流产;8—9日,哺乳仔猪、保育猪也陆续出现与育肥猪类似的症状。11月13日,该县疫控中心专业人员到现场,根据临诊表现初步诊断为PRV与PRRSV的混合感染,并建议紧急免疫伪狂犬病疫苗,配合使用泰万菌素、替米考星进行治疗。17—20日,养殖户采取了相应措施,但未能控制住疫情。12月2日,调查组进行现场调查,此时场中累计发病猪只约200头,病死50余头。12月11日,养殖户采取新的控制措施,21日以后再无病死猪出现,疫情得到有效控制。
2.1.3疫病分布
2.1.3.1时间分布 由于疫情过程较长,并未详细记录每日发病数,只根据死亡病例绘制流行曲线(图2)。11月4日,育肥猪开始发病;11月10日,开始出现死亡;11月13—20日,进行初步诊疗;12月2日,调查组介入调查;12月11日起,逐步采取相应干预措施;12月21日后,不再有病死猪出现,疫情得到有效控制。整个疫情暴发过程持续约1个半月。
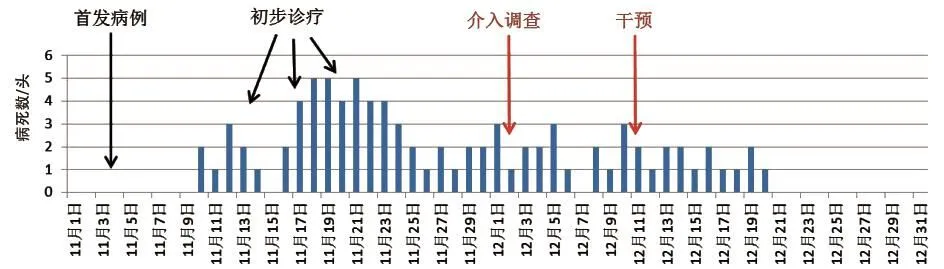
图2 疫病流行曲线
2.1.3.2空间分布 据调查,11月4日,2#舍中的育肥猪先出现咳嗽、气喘、发烧等现象;5日,4#、6#舍几乎同时出现有类似上述症状的育肥猪;7日,1#舍中的3头妊娠中期母猪先后流产;8日,3#舍哺乳仔猪开始发病;10日,5#舍保育猪开始发病。各舍发病顺序为:2#→4#+6#→1#→3#→5#。各猪舍猪群发病情况各不相同(图3):发病死亡最严重的为5#舍,发病率达0.46例/猪-月,死亡率为0.13例/猪-月;其他猪舍发病率均不超过0.07例/猪-月,死亡率均在0.05例/猪-月以下;1#舍无猪只死亡。发病率、死亡率计算公式如下[10]:

图3 不同猪舍发病、死亡情况的比较
2.1.3.3群间分布 此次疫情暴发过程中,各生长阶段猪群均有发病。其中,母猪表现为流产,仔猪与育肥猪表现为咳嗽、气喘、发烧等症状。各猪群发病顺序为育肥猪→母猪→哺乳仔猪→保育猪。比较而言,保育仔猪发病最为严重,发病率达到0.46例/猪-月,死亡率为0.13例/猪-月;其他猪群发病率均不超过0.08,且死亡率均在0.06以下,母猪无死亡(图4)。
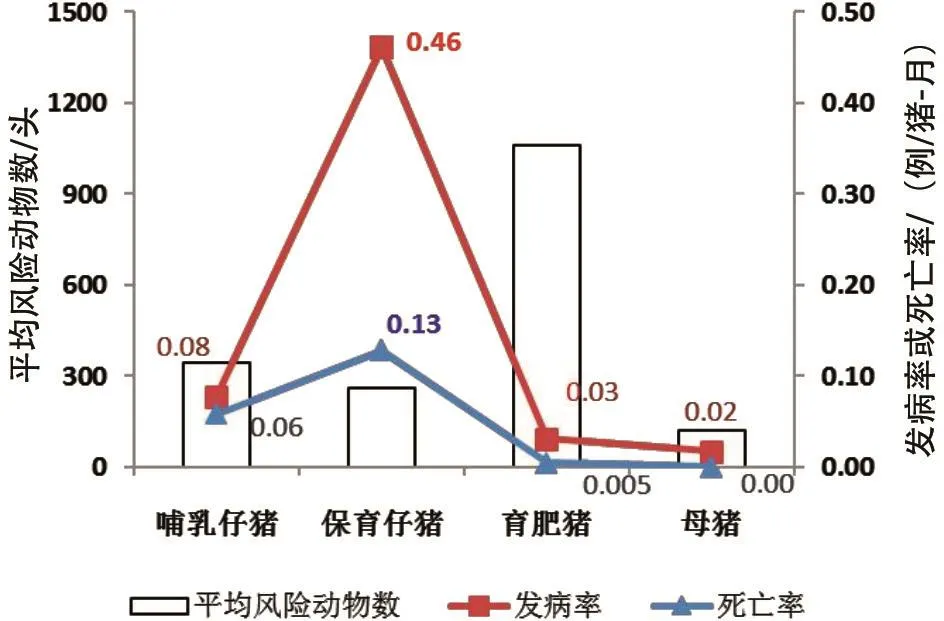
图4 不同生长阶段猪群发病、死亡情况比较
2.1.4临床诊断及病理剖检 临床诊断发现,产房哺乳仔猪有咳嗽、发低烧(40 ℃)等症状;保育舍仔猪有咳嗽、气喘、发低烧(40 ℃)等症状;此时育肥猪和母猪均无发病现象。现场剖检1头20日龄左右的发病哺乳仔猪,发现腹股沟淋巴结边缘出血,切面有坏死点;扁桃体有坏死灶。剖检1头前1日死亡的保育仔猪,发现脾脏有大面积出血斑;下颌淋巴结肿大,切面有坏死灶;扁桃体有坏死斑;气管粘膜出血。病理剖检变化见图5。

图5 仔猪剖检病变
2.2 实验室诊断
此次疫情中,猪只发病后仅6~7 d即死亡,符合病毒类疫病特征;对采集的淋巴结、肺、脾、扁桃体、肾等组织样品,用PCR/RT-PCR方法对临床上导致高热呼吸征候群的相关病毒性病原进行检测,并对阳性样品进行测序。结果表明:2头仔猪PRRSV核酸均为阳性,测序结果为类NADC30毒株;PRV核酸均为阳性,测序结果为野毒(表1)。

表1 样品病原学检测结果
3 干预措施
针对该场情况,建议全群紧急免疫伪狂犬病疫苗,并提高剂量;对母猪使用泰万菌素和中药制剂,对仔猪注射干扰素和长效土霉素以控制猪蓝耳病,同时缓解呼吸道症状并抑制细菌感染。加强饲养管理,采取必要的生物安全措施:在场区入口及猪舍入口设立消毒池及人员喷淋设施;转舍时务必对空栏舍进行彻底消毒;发病猪及时隔离治疗。养殖户接受了建议,并于12月11日起逐步采取了相应措施,疫情逐渐平息,12月21日后再无病死猪出现。
4 讨论
4.1 病因分析
综合临床诊断、病理剖检、实验室诊断结果,判定此次疫情系PRRSV与PRV混合感染引发的。经调查认为,邻场发病以及人员传播、寒冷应激、断奶应激可能是此次疫情暴发的诱因。相关事件发生顺序见图6。
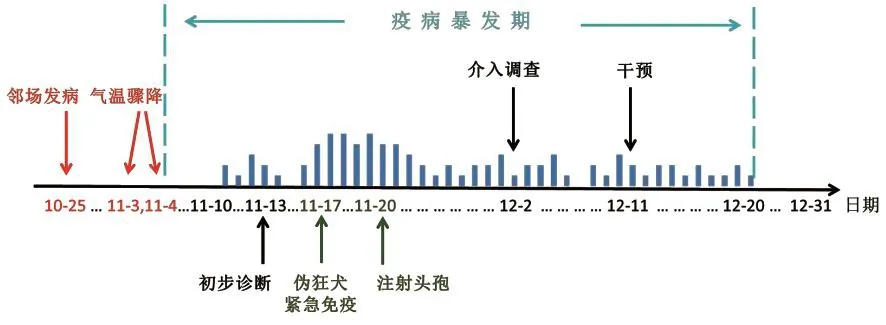
图6 事件发生的时间顺序
4.1.1邻场发病与人员传播 据了解,与该发病场仅一路之隔有两个小规模猪场(图1右),3个猪场距离非常近,给疫病传播提供了极为便利的条件。另外,这两个小规模猪场系该场主的兄弟姐妹所有。这3个猪场的管理人员常穿梭于3场之间。10月25日,猪场A暴发与该场类似的仔猪高热疫情,但未采取任何措施,约1个月后,疫情平息,共损失近100头仔猪。因猪场A发病时间早于并接近该调查场发病时间,且猪群发病症状类似,认为猪场A发病与管理饲养人员携带传播是此次疫情暴发的原因之一。此外,疫病在该场各栋舍之间的传播与饲养人员的交叉污染也有关系。虽然6位饲养员各自负责1栋猪舍,但吃饭、休息都在一起,且进出猪舍没有消毒或更衣,因此饲养员的相互接触加速了场内疫病的传播。
4.1.2寒冷应激 10—11月,正值初冬时节,该县气温波动较为明显。11月3—4日气温连续骤降,最高气温、最低气温分别下降了9 ℃、8 ℃(图7)。4日,该场猪只便开始出现病症,因此怀疑与气温骤降所致的寒冷应激有关。

图7 2017年10月16日-11月30日该县气温变化
4.1.3断奶应激 据了解,该场保育猪大多在断奶后开始发病。断奶后,饲料的转变对生长发育旺盛期的仔猪造成强烈应激,再由于缺少了母源抗体的保护,使得抵抗力急剧下降。因此,认为断奶应激是保育仔猪发病的主要诱因。
4.1.4其他诱因 现场调查发现,该场生物安全措施不健全,具体表现为:进场没有任何人员或车辆消毒设施;场内卫生条件较差;发病猪没有隔离饲养,7#舍虽设计为病猪舍,但目前已成为鸡、鹅舍,在场区中乱跑的鸡、鹅也可能是病原传播的重要媒介。此外,11月13日初步诊断后,养殖户分别于11月17日和20日进行了伪狂犬病紧急注射免疫和头孢类抗生素注射治疗,结果引起20余头发病哺乳仔猪死亡,可见注射应激是引起部分发病哺乳仔猪死亡的原因。
4.2 局限性分析
此次调查时间较滞后,如能尽早介入并控制住疫情,便可减少不必要损失。由于此次疫情持续时间较长,约1个半月,仔猪生长阶段变化较大,因此无法计算袭击率,故只能以发病率和死亡率来评估疫情的严重程度。此外,由于该场缺乏详尽的生产记录、用药记录和发病记录,故调查组获得的数据均是场主和技术人员回忆的大概数字,无法进行深入的数据分析,且存在一定的回忆性信息偏倚。
5 结论
通过流行病学调查,确认此次疫情系PRRSV与PRV混合感染所引起的母猪流产和生长猪呼吸道症状及死亡,邻场发病以及人员传播、寒冷应激、断奶应激等均可能是导致疫情暴发的原因。
参考文献:
[1] ALBINA E. Epidemiology of porcine reproductive and respiratory syndrome(PRRS):an overview[J].Veterinary microbiology,1997,55(1/2/3/4):309-316.
[2] PEJSAK Z,STADEJEK T,MARKOWSKA-DANIEL I.Clinical signs and economic losses caused by porcine reproductive and respiratory syndrome virus in a large breeding farm[J]. Veterinary microbiology,1997,55(1/2/3/4):317-322.
[3] 周峰,常洪涛,赵军,等. 2012—2013年猪繁殖与呼吸综合征病毒河南流行株的分离鉴定及分子流行病学调查[J]. 中国兽医学报,2014(9):1398-1404.
[4] ZHOU L,WANG Z,DING Y,et al. NADC30-like Strain of Porcine reproductive and respiratory syndrome virus,China[J]. Emerging infectious diseases,2015,21(12):2256-2257.
[5] ZHAO K,YE C,CHANG X B,et al. Importation and Recombination Are Responsible for the Latest Emergence of Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus in China[J]. Journal of virology,2015,89(20):10712-10716.
[6] BAI X,WANG Y,XU X,et al. Commercial vaccines provide limited protection to NADC30-like PRRSV infection[J]. Vaccine,2016,34(46):5540-5545.
[7] ZHANG Q,JIANG P,SONG Z,et al. Pathogenicity and antigenicity of a novel NADC30-like strain of porcine reproductive and respiratory syndrome virus emerged in China[J]. Veterinary microbiology,2016,197:93-101.
[8] 殷震,刘景华. 动物病毒学[M]. 2版. 北京:科学出版社,1997:988-1080.
[9] JEFFREY J Z,LA K,ALEJANDRO R,et al. Diseases of swine[M]. 10th ed. Ames:John Wiley & Sons Inc,1958:1541-1574.
[10] 黄保续. 兽医流行病学[M]. 北京:中国农业出版社,2010:30-38.
