不同前处理对总状绿绒蒿种子萌发特性的影响
2018-04-09,,,,,,
, , , , , ,
(西南林业大学园林学院,园林植物与观赏园艺省高校重点实验室, 云南 昆明 650224)
总状绿绒蒿(MeconopsisracemosaMaxim.Mel.Biol.)为罂粟科绿绒蒿属(Meconopsis)一年生草本植物,为中国特有植物。生于海拔3 300~5 300 m的草坡或岩坡上。分布于西藏、云南、四川、青海和甘肃。花蓝紫色或深蓝色,为云南“八大名花”之一,颇具观赏价值,是著名的高山野生花卉[1]。总状绿绒蒿是藏族、纳西族民间常用的一种草药,又称“红毛洋参”,其根具有补中益气、止咳平喘之功效,全草有止痛作用。在《中国藏药》、《云南省药品标准》等本草书籍上均有记载[2-4],具有很高的开发利用价值。然而由于较低的种子萌发率及幼苗补充,生境的破坏和过度采挖,导致总绿绒蒿属植物以小种群分布于狭窄的范围内。有研究发现,将长年生于高寒山区, 生态幅度较小的绿绒蒿引种时, 以种子进行繁殖比移植效果更好[5]。因此研究总状绿绒蒿种子的萌发特性将为这一珍贵园林与药用资源的保护、栽培和引种驯化等提供重要依据。
总状绿绒蒿常分布于高山流石滩,高山流石滩是高山特有的生态系统类型,是垂直分布的特殊地带,植物形成了多种适应策略[6]。高山植物种子具有休眠的特性,其萌发需要较低的温度和赤霉素(GA3)的处理[7]。有学者研究了温度、光照、土壤的净提物、生长调节剂以及贮存条件、种子的覆土情况等对锥花绿绒蒿和单叶绿绒蒿萌发率的影响,发现这2个种的种子在100 mg/L的GA3,10 h/d的光照以及(20±2)℃的条件下萌发最好。同时还发现,所观察的种子不管它们对生境的选择如何,都有相似的休眠方式;温度、光照、黑暗条件或者这三者的结合都不能打破种子的休眠[8]。石慧珍等研究发现,采自高海拔的红花绿绒蒿和五脉绿绒蒿只有通过5 ℃冷处理后才能萌发,表明种子的最佳萌发温度与采集地海拔相关[9]。
对总状绿绒蒿种子萌发的研究主要有最适温度的选择、不同浓度的GA3处理以及不同实验条件的影响。王朝文等对5~30 ℃温度条件下总状绿绒蒿种子的萌发特性进行了研究,结果表明,20 ℃最有利于总状绿绒蒿的萌发[10]。对采集于滇西北不同海拔梯度的3个总状绿绒蒿居群种子,分别采用不同浓度的赤霉素(GA3)处理后,发现100~250 mg/L的GA3处理可提高种子的发芽率和发芽势,且差异极显著[11]。另外,通过温度、湿度和光照设定条件和模拟自然条件对各居群种子进行萌发实验,结果表明,除发芽启动时间的变化趋势出现居群差异外,其它萌发指标均表现为恒定条件更有利于种子萌发[12]。
虽然不同前处理对种子萌发的影响研究较多[13-15](如采用外源激素,如GA3、细胞分裂素6-苄氨基腺嘌呤(6-BA)、生长素萘乙酸(NAA)等[15-16],或采用物理方法,如清水浸泡、热水浸泡、低温处理等方法[17]),但除了用GA3对总状绿绒蒿进行前处理外,其它前处理方法均未见报道。因此,本研究拟对不同外源激素、热水浸泡及不同时间的清水浸种及低温处理等前处理方法进行比较分析,以期筛选出打破总状绿绒蒿种子休眠的最佳前处理方法,提高其种子的萌发率,为其引种栽培提供参考。
1 材料与方法
1.1 实验材料
本实验所采用的总状绿绒蒿(MeconopsisracemosaMaxim.Mel.Biol.)种子,为2015年10月采自丽江玉龙雪山海拔4 200 m高山流石滩的野生群体。种子自然干燥后保存备用。种子千粒重为(0.241 7±0.010 5)g。
1.2 研究方法
1.2.1种子吸水率的测定
分别称取9组0.1 g总状绿绒蒿的种子,置于加有蒸馏水的小烧杯中25 ℃进行吸胀,分别于2,4,8,12,24,36,48,60,72 h后取出种子,用滤纸吸干种子表面的水分,进行称量,重复3次,计算吸水率。
吸水率(%)=(浸种后质量-浸种前质量)/浸种前质量×100%。
1.2.2种子前处理方法
种子用2%的双氧水消毒,再用蒸馏水清洗待用。设置3种不同质量浓度外源激素,分别为赤霉素(GA3)(50,100,150,200,250,300 mg/L)、细胞分裂素6-苄氨基腺嘌呤(6-BA)(0.5,1,5,10,15 mg/L)、生长素萘乙酸( NAA )(10,25,50,100 mg/L)浸种12 h、不同时间清水浸种(12,24,36 h),不同温度(40,60,80 ℃)热水浸种30 min、不同时间(40,80,160 d)低温贮藏等4种种子前处理方法。每处理设3次重复,每重复100粒种子,对照分别为未经任何前处理的种子。
1.2.3种子萌发实验
将已进行前处理的种子置于已高温灭菌的培养皿中,放入恒温培养箱进行萌发实验,培养条件:温度20 ℃,光照2 000 lx,湿度75%。
以芽长与种子等长作为发芽标准,每隔24 h记录种子的发芽情况并及时移出。分别计算种子的发芽势、发芽率、平均发芽时间和发芽启动时间。
发芽率为种子萌发结束时所有发芽种子数占供试种子总数的百分率。
发芽率(%)=(已发芽种子数/供试种子总数)×100%。
发芽势为种子发芽达到高峰时正常发芽种子数与供试种子总数的百分比。
平均发芽时间=∑(D×n)/∑n,式中,D为从种子置床起算的天数;n为相应各天的发芽粒数。平均发芽时间是指供试种子发芽所需的平均时间。平均发芽速度是衡量种子发芽快慢的一个指标,其值越小,表示种子发芽越迅速,发芽能力越强。
发芽启动时间为第1粒种子发芽所需天数。
1.3 数据分析
不同处理种子的各萌发指标进行单因素方差(One-way ANOVA)分析。文中所有数据处理均在SPSS 21.0中完成,p<0.05为显著,p<0.01为极显著。
2 结果与分析
2.1 种子吸水率测定
如表1所示,清水浸泡时间24 h,总状绿绒蒿种子的吸水率达到峰值,为61.20%。在24 h内,种子的吸水率随着浸泡时间的增加而升高;24 h后呈现较为稳定的状态。
表1总状绿绒蒿种子吸水率测定结果

时间(h)吸水率(%)时间(h)吸水率(%)223.40±3.363654.27±3.95426.13±3.334854.97±4.77838.63±2.356058.80±2.361244.00±3.867256.27±3.252461.20±3.58
2.2 不同浓度GA3处理对总状绿绒蒿种子萌发的影响
从图1和表2可看出,GA3100~300 mg/L处理的种子均高于对照组发芽率和发芽势,其中100 mg/L处理后的种子发芽率最高,达97%;250 mg/L 处理后的种子发芽势最高,达98.38%;而且GA3对总状绿绒蒿种子的发芽率和发芽势影响均为极显著(p<0.01)。另外,GA3也可显著缩短平均发芽时间(p<0.05),其中50 mg/L GA3浓度处理后,可比对照组缩短21 d左右;但GA3对发芽启动时间影响不显著(p>0.05)。

注:各萌发指标单位,发芽率(%);发芽率(%);发芽启动时间(d);平均发芽时间(d)。图1 赤霉素浓度对总状绿绒蒿种子萌发特性的影响
2.3 不同6-BA浓度处理对总状绿绒蒿种子萌发的影响
如图2和表2所示,虽然6-BA处理相对于对照组均能使发芽率提高,发芽平均时间均缩短,且1 mg/L 6-BA处理时发芽率可达90.95%;0.5 mg/L 6-BA处理时平均发芽时间最短,约为21 d,但影响均不显著(p>0.05)。同时,6-BA处理降低了发芽势,且影响极显著(p<0.01)。6-BA使发芽启动时间提前或延后1~2 d,且6-BA处理对发芽启动时间影响显著(p<0.05)。
表2不同前处理对总状绿绒蒿种子萌发指标影响的单因素方差分析(ANOVA)
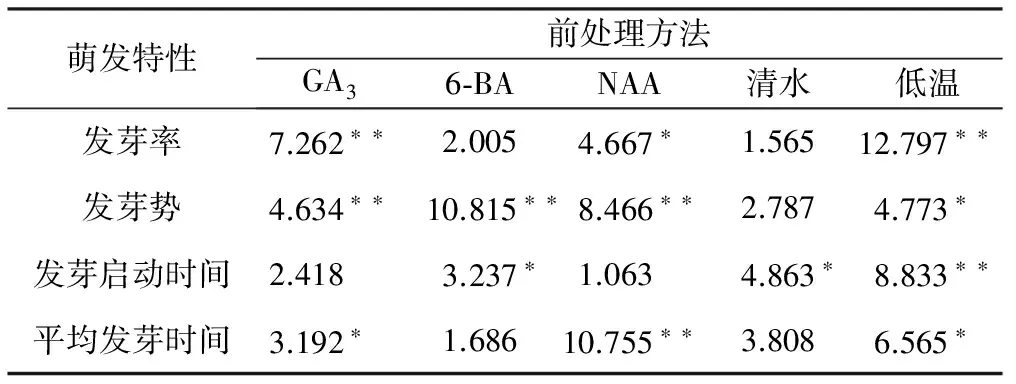
萌发特性前处理方法GA36⁃BANAA清水低温发芽率7.262∗∗2.0054.667∗1.56512.797∗∗发芽势4.634∗∗10.815∗∗8.466∗∗2.7874.773∗发芽启动时间2.4183.237∗1.0634.863∗8.833∗∗平均发芽时间3.192∗1.68610.755∗∗3.8086.565∗
注:表中为F值;“**”为p<0.01 差异极显著;“*”为p<0.05差异显著。

图2 6-BA浓度对总状绿绒蒿种子萌发特性的影响
2.4 不同NAA浓度处理对总状绿绒蒿种子萌发的影响
如图3和表2所示,与对照组种子相比,10~25 mg/L NAA能显著提高发芽率。NAA 25 mg/L为最佳,达到84.43%。而10 mg/L NAA能显著提高种子的发芽势,达到74.34%,同时能缩短平均发芽时间(17 d左右。)而且,NAA处理对发芽率、发芽势和平均发芽时间影响均为显著(p<0.05),但对发芽启动时间影响不显著(p>0.05)。
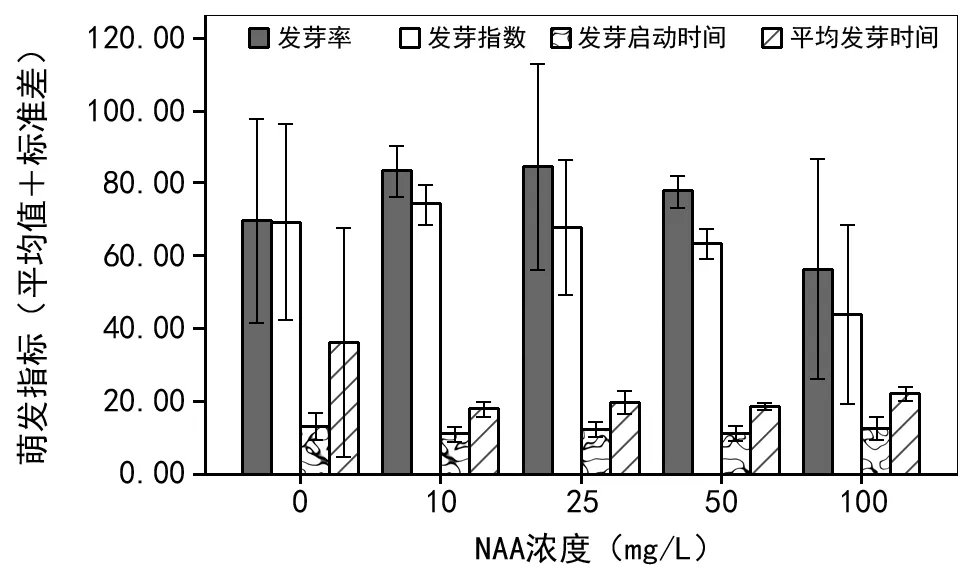
图3 NAA浓度对总状绿绒蒿种子萌发特性的影响
2.5 不同时间清水浸泡对总状绿绒蒿种子萌发的影响
如图4和表2所示,与对照组种子相比,清水浸种虽能增加发芽率,浸种24 h,发芽率增至86.11%,但影响不显著(p>0.05)。另外,清水浸种36 h,发芽势可达77.51%。其它时间浸泡则小于对照组种子发芽势,但影响仍不显著(p>0.05)。从发芽启动时间和平均发芽时间两方面来看,清水浸泡后均较对照组缩短。其中12 h浸种后可达最短,发芽启动时间和平均发芽时间分别为9.33 d和17.21 d。但清水浸种仅对发芽启动时间影响显著(p<0.05)。
2.6 不同温度热水浸泡对总状绿绒蒿种子萌发的影响
热水浸种30 min处理后1周,60 ℃与80 ℃处理的总状绿绒蒿种子在并未受到霉菌侵袭的情况下纷纷出现熟烂现象,无一萌发,只有40 ℃热水处理的种子有少量萌发现象,因此该组未作统计。
2.7 低温处理对总状绿绒蒿种子萌发的影响
如图5和表2所示,与对照组种子相比,低温贮藏能增加种子发芽率、发芽势,缩短发芽启动时间和平均发芽时间,且对发芽率和发芽启动时间影响极显著(p<0.01),对发芽势和平均发芽时间影响显著(p<0.05)。同时,随贮藏时间增加,发芽率和发芽势增加,发芽启动时间和平均发芽时间缩短。低温贮藏160 d的种子发芽率和发芽势最大,分别可达96.67%和85.33%。平均发芽时间比对照组可缩短25 d左右,发芽启动时间可提前4~5 d。
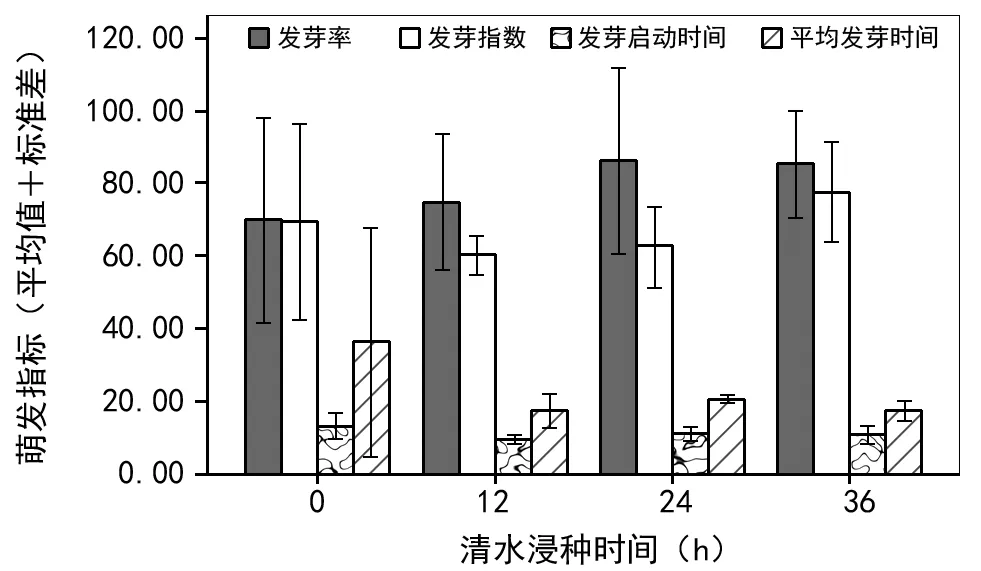
图4 清水浸种对总状绿绒蒿种子萌发特性的影响
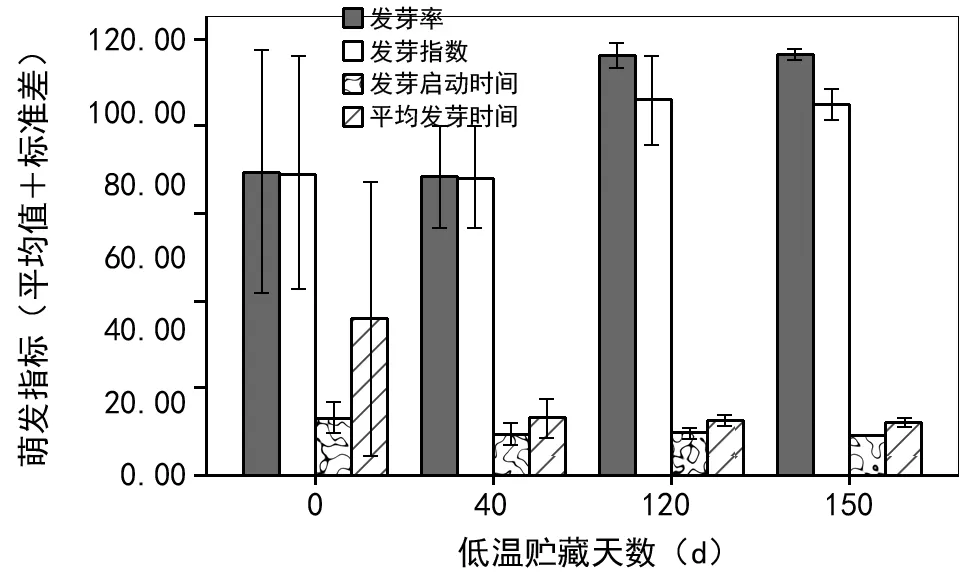
图5 低温贮藏期对总状绿绒蒿种子萌发特性的影响
2.8 各前处理结果综合比较
选取前处理后,各萌发指标综合效果最佳的组进行比较(图6)。单因素方差分析表明,各处理使发芽率差异显著(F=3.953,p<0.05);使发芽势差异极显著(F=15.888,p<0.01);使发芽启动时间差异极显著(F=10.722,p<0.01);使平均发芽时间差异显著(F=4.238,p<0.05)。
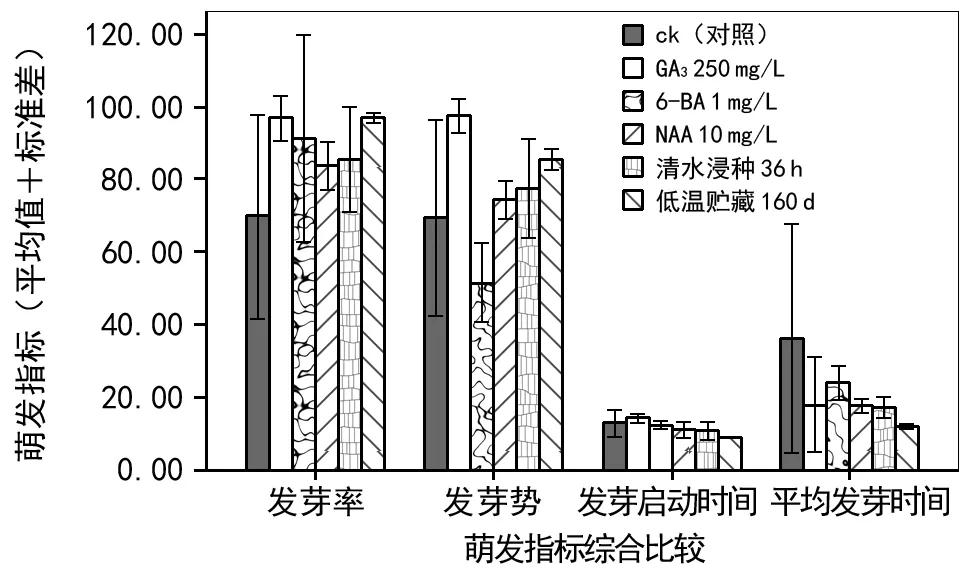
图6 不同前处理下总状绿绒蒿萌发特性
如图6所示,发芽率和发芽势均较对照组有所增加。其中GA3250 mg/L和低温贮藏160 d效果最佳。发芽启动时间除GA3250 mg/L处理有所延迟外,其余处理均比对照组提前。其中,低温处理160 d 可提前4~5 d。另外,平均发芽时间均较对照组缩短,低温处理160 d 效果最为明显。
3 结论与讨论
使用外源植物激素提高种子发芽率,已在很多不同物种上得到了广泛应用。张瑞博等用GA3(100,400,800,1 200,1 600,2 000 mg/L)浸泡桔梗种子,结果显示,6个浓度GA3处理均可促进桔梗种子的萌发[18]。100~1 000 mg/L GA3处理可明显缩短滇龙胆种子萌发时间,其中500 mg/L GA3处理可使种子发芽率提高至95%[19];另外,刘建成等采用6-BA处理黑麦种子,结果表明,6-BA在一定程度上阻碍种子打破休眠的速度,但能提高黑麦种子的发芽率和发芽势[15]。李旭等利用不同浓度NAA溶液浸泡苦瓜种子,结果表明,NAA 2 mg/L时苦瓜种子的发芽势、发芽率、活力指数均最佳,而高浓度(>10 mg/L)处理会抑制苦瓜种子萌发[20]。本研究结果表明,3种外源激素能在一定程度上促进种子萌发。其中GA3和NAA处理均能显著提高总状绿绒蒿种子的发芽率、发芽势,同时缩短平均发芽时间(p<0.05),但两者均对发芽启动时间影响不显著(p>0.05)。而6-BA处理虽能提高总状绿绒蒿种子发芽率,但影响不显著(p>0.05)。而且6-BA显著降低了其发芽势(p<0.05),说明6-BA可能抑制种子的萌发。这与之前研究发现,6-BA在一定程度上阻碍黑麦种子打破休眠速度的研究结果相一致。
清水浸泡,热水浸泡和低温处理是比较常用的破除休眠的物理方法。房海灵等研究了清水浸种不同时间对薄荷种子萌发的影响,结果显示,其中用清水浸种12~24 h可使薄荷种子提前1~3 d萌发, 浸种时间过长或过短均会延长种子的发芽启动时间,浸种时间在24 h内, 薄荷种子的发芽率和发芽势基本高于对照[21]。胡小文等研究表明,80 ℃热水处理豆科种子,破除休眠的效果最好,60 ℃ 仅破除少部分种子休眠,而95 ℃则导致大部分种子死亡[22]。同时成仿云等研究表明,低温处理对解除“凤丹”种子上胚轴休眠有效;低温天数增加,初萌期缩短,发芽指数和发芽率提高[23]。因此,不同物种要求的浸泡时间和温度各不相同。本研究中,总状绿绒蒿种子24 h吸胀后,最高吸水率达到61.20 %,吸水率较低,吸水时间较长。吸水速率的大小与种子萌发有密切关系,吸水率低可能导致种子萌发速度较慢。因此,适当的清水或温水浸泡有助于软化种皮,使得种子表面的蜡质层变薄或者有部分蜡质与种皮分离,提高透性和浸出种子内的发芽抑制物,从而促进种子的萌发[11]。清水浸种虽对发芽率、发芽势和平均发芽时间影响不显著(p>0.05)。但清水浸种24~36 h,均可增加种子发芽率和发芽势, 缩短发芽时间。且清水浸种后均对发芽启动时间影响显著(p<0.05)。可比对照种子提前3~4 d萌发。而热水处理导致了大部分种子的死亡。这可能与总状绿绒蒿种皮较薄,40 ℃以上热水浸泡,导致大部分种子失活所致。
值得注意的是,从各项指标综合来看,总体效果最好的是低温贮藏。且随低温贮藏时间的增加,种子萌发的各项指标达到最佳效果。寒冷是温带地区春季萌发的物种打破休眠的自然机制,对于寒冷有响应的种子来说,寒冷长度是一种重要的萌发暗示。有学者对一些蔷薇科种子萌发特性研究发现,来自高海拔生境的种子萌发有较长时期的寒冷需求[24]。同时,研究发现,来自各海拔生境的糙皮桦和紫果云杉种群种子萌发率和萌发速率随低温贮藏时间的延长而增大[25]。本研究中,总状绿绒蒿种子采的生境为海拔4 300 m左右的丽江玉龙雪山高山流石滩,种子成熟后较长时间暴露在冬季低温条件和积雪覆盖下,因此,种子低温贮藏满足了其较长时间的寒冷需求。这也是植物在长期环境压力下对环境的生态适应,是高山地区特殊环境条件下的种子萌发对策[26]。
综上,低温贮藏是打破总状绿绒蒿种子休眠的最有效方法,而外源激素GA3250 mg/L和NAA 10 mg/L处理后的种子也能达到较好的萌发效果。
参考文献:
[1]吴征缢主编.云南植物志(第二卷)[M].北京:科学出版社,1979.
[2]青海省藏医药研究所,青海省药品检验所主编.中国藏药[M].上海:上海科技出版社,1996.
[3]云南省卫生厅主编.云南省药品标准[M].昆明:云南大学出版社,1996.
[4]郭世民,赵远,王曙光.总状绿绒蒿药效的初步研究[J].云南中医中药杂志,2003,24(1):25-27.
[5]董晓东.云南绿绒蒿植物种质资源及评价[J].大理师专学报(自然科学版),1995,28(2):42-46.
[6]邓敏,周浙昆.滇西北高山流石滩植物多样性[J].云南植物研究,2004,26(1):23-34.
[7]Vinay P,Hemlata B,Nautiyal MC.Seed germination Enhancement in high altitude medicinal plants of Garhwal himalaya by some pre-sowing treatments[J].Res J of Seed Sci,2011,4(4):199-205.
[8]Sulaiman IM.Seed germination studies in three species of threatened,ornamenta,Himalaya poppy,Meconopsis Vig.(Papaveraceae).Seed Sci Technol,1993,21 (3):593-603.
[9]石慧珍,刘明霞,许静,等.青藏高原高寒草甸罂粟科植物种子萌发特性研究[J].西北植物学报,2008,28(9):1 880-1 884.
[10]王朝文,李兆光,和寿星,等.不同温度对总状绿绒蒿种子萌发的影响[J].种子,2009,28(2):25-27.
[11]屈燕,区智,尤小婷,等.赤霉素对总状绿绒蒿三个居群种子萌发特性的影响[J].植物生理学报,2014,50(9):13 74-1 378.
[12]屈燕,区智,尤小婷,等.不同实验条件总状绿绒蒿种子萌发特性的影响[J].种子,2015,34(2):90-93.
[13]张春平,何平,何俊星,等.不同处理对药用紫苏种子萌发特性的影响[J].中草药,2010,41(8):1 361-1 365.
[14]葛淑俊,孟义江,甄瑞,等.不同处理方法对柴胡种子萌发的影响[J].中国农学通报,2006,22(4):178-180.
[15]刘建成,龚卫化,向芬,等.不同处理对鱼香草种子萌发的影响[J].中草药,2012,43(5):1 000-1 002.
[16]陈玉燕,李立芹.3种植物生长调节剂对黑麦种子萌发的影响[J].种子,2011,30(7):91-94.
[17]单宇,赵海光,郑玉红,等.繁缕(Stellariamedia(L.)Vill.)种子萌发特性的研究[J].种子,2011,30(1):42-45.
[18]张瑞博,李思峰,黎斌,等.不同处理方法对桔梗种子萌发的影响[J].种子,2010,29(5):84-85.
[19]杨美权,杨维泽,赵振玲,等.滇龙胆种子萌发特性研究[J].中国中药杂志,2011,36(5):556-558.
[20]李旭,王垠敦,张卫君,等.不同NAA,IAA,IBA处理对苦瓜种子萌发的影响[J].广东农业科学,2008(12):47-48.
[21]房海灵,李维林,梁呈元,等.不同前处理条件对薄荷种子萌发的影响[J].植物资源与环境学报,2009,18(4):53-57.
[22]胡小文,武艳培,王彦荣,等.豆科种子休眠破除方法初探[J].西北植物学报,2009,29(3):568-573.
[23]成仿云,杜秀娟.低温与赤霉素处理对‘凤丹’牡丹种子萌发和幼苗生长的影响[J].园艺学报,2008,35(4):553-558.
[24]Pendleton BK,Meyer SE.Habitat-correlated variation in blackbrush (Coleogyneramosissima:Rosaceae) seed germination response[J].J of Arid Environment,2004,59:229-243.
[25]王桔红,张勇,崔现亮,等.不同海拔梯度糙皮桦和紫果云杉种子的萌发变异[J].生态学杂志,2009,28(4):589-594.
[26]Cavieres LA,Arroyo MTK.Seed germination response to cold stratification period and thermal regime in Phacelia secunda (Hydrophyllaceae)-Altitudinal variation in the Mediterranean Andes of central Chilie[J].Plant Ecol,2000,149:1-8.
