Notch1信号对银屑病患者外周血Th17细胞分化和功能的影响
2018-04-09马蕾薛海波高梅兰舒春梅于娟张俊花
马蕾 薛海波 高梅兰 舒春梅 于娟 张俊花
256603山东,滨州医学院附属医院皮肤科(马蕾、舒春梅、于娟、张俊花),内分泌与代谢病科(薛海波),检验科(高梅兰)
银屑病是免疫相关的慢性复发性炎症性皮肤病,其皮损组织中大量的T淋巴细胞及分泌的细胞因子形成异常的免疫微环境,导致表皮角质形成细胞异常分化[1⁃2]。Th17细胞是以分泌白介素17(IL⁃17)为特点的CD4+T淋巴细胞亚群,在以银屑病为代表的皮肤疾病中发挥重要作用[3⁃5]。Notch信号通路作为一种高度保守的信号转导通路,在细胞分化、发育过程中尤其是在T淋巴细胞分化中起关键作用[6]。有研究表明,在小鼠和人促Th17细胞分化的细胞因子环境中均有Notch1信号分子的活化[7⁃8]。本研究通过检测银屑病患者外周血单个核细胞(PBMC)Notch1信号通路的表达变化以及抑制Notch1信号对银屑病患者Th17细胞分化和功能的影响,探讨Notch1信号通路在银屑病中的作用及机制。
对象与方法
一、研究对象
2015年9月至2016年10月滨州医学院附属医院门诊就诊的35例寻常性银屑病患者,男19例,女16例,年龄18~42(28.7± 6.4)岁,皮损面积与疾病严重程度评分(PASI)为 12.6~27.8(20.42±3.83)。入选标准:初诊未治或近1个月内未采用系统药物、光疗、生物制剂及外用药物治疗者。健康对照组为32例健康体检者,男18例,女14例,年龄20~43(32.5±6.7)岁。两组间性别分布、年龄差异无统计学意义(P>0.05)。本研究通过滨州医学院附属医院医学伦理委员会批准,受试者均签署知情同意书。
二、主要试剂及仪器
聚蔗糖、磷酸盐缓冲液(PBS)、佛波酯、钙离子载体、布雷菲德菌素A、二甲基亚砜(DMSO)、(2S)-N-N-(3,5-二氟苯乙酰基)-L-丙氨酰-2-苯基甘氨酸叔丁酯(DAPT)(美国Sigma公司),胎牛血清、RPMI 1640培养液(美国Gibco公司),异硫氰酸荧光素(FITC)标记的CD4单克隆抗体、藻红蛋白(PE)标记的IL⁃17单克隆抗体、抗CD3单克隆抗体、抗CD28单克隆抗体、重组人白介素1β(IL⁃1β)、重组人肿瘤坏死因子β(TGF⁃β)、重组人IL⁃6、重组人IL⁃23、抗干扰素γ(IFN⁃γ)抗体、抗IL⁃4抗体(美国eBioscience公司),Trizol RNA提取试剂(美国Invitrogen公司),Quantscript RT Kit反转录试剂盒、RealMaster Mix试剂盒[天根生化科技(北京)有限公司],IL⁃17酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司),FACS Calibur流式细胞仪(美国BD公司),Rotor⁃Gene 3000实时PCR仪(澳大利亚Corbett Research公司)。
三、方法
1.标本采集:采集受试对象空腹外周静脉血10 ml,3 ml用于分离血清,7 ml采用聚蔗糖密度梯度离心法分离获取PBMC。
2.流式细胞仪检测Th17细胞占CD4+T淋巴细胞的比例:用含10%胎牛血清的RPMI 1640培养液调整PBMC至2×106/ml,分别加入50 μg/L佛波酯、1 mg/L钙离子载体和10 mg/L布雷菲德菌素A,37℃、5%CO2条件下共刺激培养5 h;细胞膜FITC⁃CD4单克隆抗体标记,透膜、固定后PE⁃(IL⁃17)单克隆抗体胞内染色;应用FACS Calibur流式细胞仪检测,每例重复3次,winMDI 2.9软件分析数据。
3.实时定量反转录PCR检测PBMC中维A酸相关孤儿核受体γt(RORγt)、IL⁃17、Notch1及发状分裂相关增强子 1(Hes⁃1)mRNA 表达水平:采用Trizol RNA提取试剂提取PBMC中总RNA,紫外分光光度仪测定纯度,吸光度比值(A260/A280)在1.8~2.0之间为合格标本。反转录合成cDNA第1链。RORγt、IL⁃17、Notch1、Hes⁃1及β肌动蛋白引物由生工生物工程(上海)股份有限公司合成,序列见表1。实时PCR定量检测,每份标本设3个复孔。计算mRNA相对表达量(2⁃△△Ct),△△Ct=(Ct试验样本目的基因-Ct试验样本内参基因)-(Ct校准样本目的基因)-Ct校准样本内参基因)。
4.ELISA检测IL⁃17含量:将倍比稀释的标准品、血清或经上述刺激的PBMC培养上清液及样品稀释液分别加至标准品孔、样品孔及空白对照孔,每例设3个复孔,按照试剂盒说明书检测IL⁃17浓度。
5.γ分泌酶抑制剂DAPT阻断Notch1信号:将10例银屑病患者PBMC分别接种于24孔板,每孔 0.5 ml,密度为1× 106/ml;每例患者PBMC随机分为5组,以DMSO溶解DAPT,RPMI 1640培养液调整DAPT终浓度分别为0(对照组)、2.5、5.0、10.0、20.0 μmol/L,DMSO终浓度低于0.1%,对照组为含等量DMSO的RPMI 1640培养液;每组细胞设3个平行孔,37℃、5%CO2条件下培养72 h。
6.CD4+T淋巴细胞的活化与极化:将上述PBMC转移至被5 g/L抗CD3单克隆抗体及2 g/L可溶性抗CD28单克隆抗体包被的培养板中,加入10 μg/L重组人IL⁃1β、50 μg/L重组人IL⁃6、20 μg/L 重组人 IL⁃23、10 mg/L抗IFN⁃γ 抗体及10 mg/L抗IL⁃4抗体,37℃、5%CO2条件下培养72 h。
7.统计学方法:采用SPSS17.0软件包进行统计学处理,计量资料以x±s表示,外周血中各检测指标表达水平比较采用独立样本t检验,各指标之间的相关性检测采用Pearson相关分析;各浓度DAPT处理组检测指标表达水平比较采用单因素方差分析,组间多重比较采用LSD法。以P<0.05为差异有统计学意义。

表1 Notch1、发状分裂相关增强子1(Hes⁃1)、维A酸相关孤儿核受体γt(RORγt)、白介素17(IL⁃17)和β肌动蛋白引物序列

图1 流式细胞仪检测健康对照(1A)和银屑病患者(1B)外周血单个核细胞Th17细胞比例
结 果
一、银屑病患者PBMC中Th17细胞比例
银屑病患者PBMC中Th17细胞占CD4+T淋巴细胞比例为2.863%±0.969%,对照组为0.604%±0.124%,两组比较,t=13.677,P< 0.01。见图1。
二、银屑病患者外周血RORγt等mRNA表达水平及血清IL⁃17含量
银屑病患者 PBMC 中 RORγt、IL⁃17、Notch1、Hes⁃1 mRNA表达水平及血清中IL⁃17含量均高于对照组(P<0.01)。见表2。
三、银屑病患者PBMC中Notch1 mRNA表达水平与PASI等指标的相关性
银屑病患者外周血Notch1 mRNA表达水平与PASI(r=0.584)、Th17细胞比例(r=0.544)、RORγt mRNA表达水平(r=0.518)、IL⁃17 mRNA表达水平(r=0.549)及血清IL⁃17含量(r=0.511)均呈正相关(P< 0.05)。
四、DAPT阻断Notch1信号对银屑病患者PBMC中Th17细胞比例等指标的影响
不同浓度DAPT组Th17细胞比例、RORγt mRNA表达水平、IL⁃17 mRNA表达水平及培养上清液IL⁃17含量差异均有统计学意义(P<0.01),2.5、5.0、10.0、20.0 μmol/L DAPT组各检测指标均低于对照组(P<0.05),且随DAPT浓度增加,Th17细胞比例、RORγt及IL⁃17表达水平呈降低趋势。见表3。
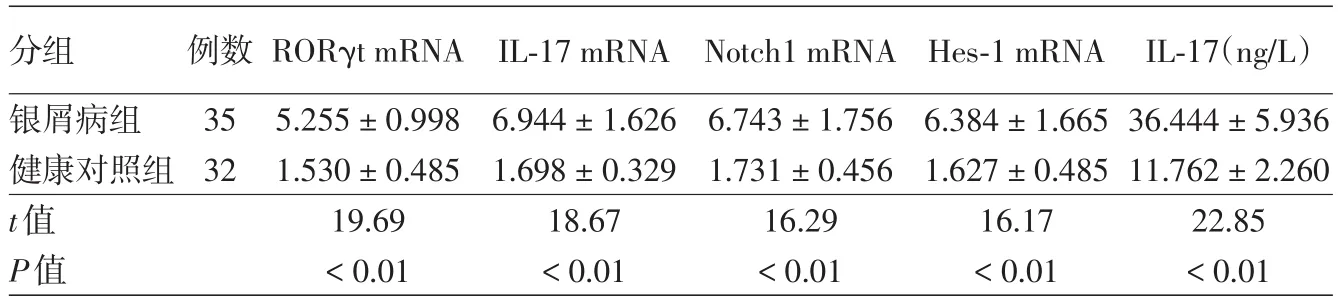
表2 银屑病患者外周血单个核细胞中维A酸相关孤儿核受体γt(RORγt)、白介素17(IL⁃17)、Notch1、发状分裂相关增强子l(Hes⁃1)mRNA表达水平(2⁃△△Ct)及血清中IL⁃17含量(x±s)

表3 不同浓度γ分泌酶抑制剂DAPT处理组银屑病患者外周血单一核细胞Th17细胞比例和维A酸相关孤儿核受体γt(RORγt)、白介素17(IL⁃17)mRNA表达水平(2⁃△△Ct)及培养上清液IL⁃17含量(x± s)
讨 论
本研究结果显示,Th17细胞及其特异性转录因子RORγt、效应性细胞因子IL⁃17在银屑病患者外周血中均呈高水平表达,说明Th17细胞在银屑病病程中发挥重要作用。
有研究表明,Notch1信号分子在银屑病皮损组织中高表达,并参与角质形成细胞的分化调控[2,9⁃12]。本研究结果显示,Notch1信号分子及其靶基因Hes⁃1在银屑病患者外周血中明显高表达,且与Th17细胞比例、RORγt及IL⁃17表达水平呈正相关,表明Notch1信号分子参与银屑病发生发展过程。阻断Notch1信号通路可明显下调Th17细胞相关细胞因子产生,减轻Th17细胞及其效应细胞因子IL⁃17介导的实验性自身免疫脑脊髓膜炎的疾病进程,利用siRNA特异性阻断Notch1信号分子表达同样能够抑制IL⁃17在极化的人Th17细胞中的表达和分泌[7⁃8]。Notch1信号通路亦能调控Th17细胞特异性转录因子RORγt[13],特异性阻断Notch1信号分子能导致RORγt的表达水平降低[7]。本研究结果显示,Notch1信号阻断剂DAPT能降低银屑病患者PBMC中Th17细胞比例及其特异性RORγt、IL⁃17的表达与分泌,且随DAPT浓度增加上述指标呈降低趋势。我们前期研究发现,DAPT能够剂量依赖性降低银屑病小鼠模型脾脏Th17细胞比例及RORγt、IL⁃17的表达[14]。以上研究结果表明,在银屑病疾病过程中,Notch1信号分子发挥对Th17细胞分化和功能的调控作用。进一步开展Notch1信号干扰或过表达对银屑病Th17细胞分化和功能影响的研究,将更加明确该信号通路对银屑病Th17细胞的调控机制。
综上,银屑病患者高表达的Notch1信号分子可能通过促进Th17细胞分化及IL⁃17表达与分泌,增加Th17细胞的致炎作用,促发和加重银屑病皮损的炎症反应,Notch1信号分子可能成为银屑病治疗的一个新靶点。
[1]Nograles KE,Zaba LC,Guttman⁃Yassky E,et al.Th17 cytokines interleukin(IL)⁃17 and IL⁃22 modulate distinct inflammatory and keratinocyte⁃response pathways[J].Br J Dermatol,2008,159(5):1092⁃1102.doi:10.1111/j.1365⁃2133.2008.08769.x.
[2]Abdou AG,Maraee AH,Sharaf A,et al.Up⁃regulation of Notch⁃1 in psoriasis:an immunohistochemical study[J].Ann Diagn Pathol,2012,16(3):177 ⁃184.doi:10.1016/j.anndiagpath.2011.09.005.
[3]陈永锋,常树霞,郑道城.寻常性银屑病患者外周血和皮损中Th17细胞及相关因子的表达[J].中华皮肤科杂志,2011,44(1):11⁃14.doi:10.3760/cma.j.issn.0412⁃4030.2011.01.004.
[4]林熙然,黄畋.Th17细胞与皮肤病[J].中国皮肤性病学杂志,2009,23(2):65⁃67,109.
[5]Fotiadou C,Lazaridou E,Sotiriou E,et al.IL⁃17A,IL⁃22,and IL⁃23 as markers of psoriasis activity:a cross⁃sectional,hospital⁃based study[J].J Cutan Med Surg,2015,19(6):555 ⁃560.doi:10.1177/1203475415584503.
[6]Amsen D,Helbig C,Backer RA.Notch in T cell differentiation:all things considered[J].Trends Immunol,2015,36(12):802 ⁃814.doi:10.1016/j.it.2015.10.007.
[7]Keerthivasan S,Suleiman R,Lawlor R,et al.Notch signaling regulates mouse and human Th17 differentiation[J].J Immunol,2011,187(2):692⁃701.doi:10.4049/jimmunol.1003658.
[8]Jiao Z,Wang W,Hua S,et al.Blockade of Notch signaling ameliorates murine collagen⁃induced arthritis via suppressing Th1 and Th17 cell responses[J].Am J Pathol,2014,184(4):1085 ⁃1093.doi:10.1016/j.ajpath.2013.12.010.
[9]李新华,安鹏,李俊琴,等.银屑病患者外周血T细胞Notch信号通路相关基因表达的研究[J].中华皮肤科杂志,2013,46(3):188⁃190.doi:10.3760/cma.j.issn.0412⁃4030.2013.03.013.
[10]Kim JE,Bang SH,Choi JH,et al.Interaction of Wnt5a with Notch1 is critical for the pathogenesis of psoriasis[J].Ann Dermatol,2016,28(1):45⁃54.doi:10.5021/ad.2016.28.1.45.
[11]Ota T,Takekoshi S,Takagi T,et al.Notch signaling may be involved in the abnormal differentiation of epidermal kerati⁃nocytes in psoriasis[J].Acta Histochem Cytochem,2014,47(4):175⁃183.doi:10.1267/ahc.14027.
[12]Rooney P,Connolly M,Gao W,et al.Notch⁃1 mediates endothelial cell activation and invasion in psoriasis[J].Exp Dermatol,2014,23(2):113⁃118.doi:10.1111/exd.12306.
[13]Mukherjee S,Schaller MA,Neupane R,et al.Regulation of T cell activation by Notch ligand,DLL4,promotes IL⁃17 production and Rorc activation[J].J Immunol,2009,182(12):7381 ⁃7388.doi:10.4049/jimmunol.0804322.
[14]马蕾,高梅兰,舒春梅,等.Notch1信号通路调控银屑病模型小鼠Th17细胞分化和功能[J].中国免疫学杂志,2017,33(7):985⁃990.doi:10.3969/j.issn.1000⁃484X.2017.07.006.
