金柑果肉组织总RNA 提取方法比较
2018-04-08唐志鹏秦荣耀欧克纬
张 宇,唐志鹏,秦荣耀,欧克纬
(1.广西大学 农学院,广西 南宁 530004;2.广西壮族自治区亚热带作物研究所,广西 南宁 530001)
金柑Fortunella japonica亦称金弹、宁波金柑、金橘,起源于中国,植物学分类属芸香科Rutaceae金柑属Fortunella[1-3]。金柑果实香气怡人、风味独特、营养多样,具有减缓衰老、理气止咳、健胃化痰、预防哮喘及支气管炎等医疗功效[2]。随着生活水平的提高,相关部门对金柑资源的保护与开发越来越关注,在金柑品种资源优良性状的挖掘和利用方面取得了积极的研究成果。龚小庆[4]对金柑FcWRKY70、FcWRKY40、FcSISP3 个逆境响应基因进行克隆,分析它们各自的功能及潜在作用机制,得到如下结论:FcWRKY70超表达可明显增强转基因烟草的抗旱性,FcWRKY40基因可被低温、盐、ABA 和SA 诱导表达,但被干旱抑制。超表达FcWRKY40可明显增强转基因烟草对氧化胁迫的抗性。FCSISP基因在烟草中超表达,可以提高转基因植株的耐盐性。胡颖[5]以广西融安金柑为材料,克隆了37 个MADS box基因序列信息,并进行了生物信息学和聚类分析,筛选得到12 个特异调控花器官发育关键基因,构建6 个MADS box家族基因植物表达载体。以上研究结果的获得均是以获取高质量的总RNA 为基础,徐昌杰等[6]、吴秀兰等[7]针对近缘种柑橘富含多糖多酚类物质的特点,报道了总RNA 的获取。但较详细获取金柑果实总RNA 的方法鲜见报道,笔者以果实为材料研究了适合金柑果实总RNA 的提取方法。
1 材料与方法
1.1 材 料
供试材料为‘桂金柑一号’、‘桂金柑二号’、‘融安金柑’、‘滑皮金柑’、‘脆密金柑’。于2017年10月21日从广西融安县雅瑶乡采摘5 个金柑品种的果实,每个品种收集果实约200 g,放入装有液氮的冰壶迅速运回广西大学农学院实验室,用双蒸水清洗果实并滤干水分,置于-80 ℃冰箱内保存备用[8-13]。
1.2 方 法
1.2.1 提取RNA 的试剂
①异硫氰酸胍变性液;②2 mol/L NaAc;③水饱和苯酚(pH 5.2);④氯仿/异戊醇(体积比24 ∶1);⑤异丙醇;⑥ 75%乙醇;⑦ EDPC 处理水(质量分数0.1%);⑧ CTAB 提取液[0.15 mol/L Tris-HCl,1.6 mol/L NaCl,20 g/L CTAB,0.25 mol/L EDTA,3% β-巯基乙醇,20 g/L PVP-40(pH 8.0)];⑨0.15 mol/L Tris-HCl,0.8 mol/L NaCl,SDS(质量分数5%),0.06 mol/L EDTA,β-巯基乙醇(质量分数2%),20 g/L PVP-40(pH8.0)]。
1.2.2 提取RNA 的步骤
异硫酸胍提取法:(1)金柑果实用经75%酒精消毒过的手术刀切割成1 cm3大小后,取约0.5 g在液氮中研磨成粉末,将研磨后的粉末放入经液氮预冷后的10 mL 离心管;(2)加入4 mL ①,上下颠倒混匀,依次加入0.3 mL ②、3 mL ③、0.7 mL ④上下颠倒混匀,冰浴15 min;(3)4 ℃,12 500 r/min 离心28~30 min;(4)取上清液,加入和上清液等体积预冷的⑤,混匀,-30 ℃静置1 h;(5)4 ℃,12 500 r/min 离心25 min,弃上清,用⑥洗涤沉淀2~3 次,超净台上风干,用100 μL ⑦溶解,-80 ℃保存备用。
CTAB 提取法:(1)第一步同异硫酸胍提取法;(2)加入5 mL ⑧,上下颠倒混匀,置于65 ℃水浴1 h,期间颠倒混匀3 次,水浴结束后,加入等体积预冷的④,4 ℃,12 500 r/min 离心25 min;(3)取上清,加入1/2 体积③,混匀,冰浴静置5 min,取上清液,加入1/10 体积的②,-30 ℃ 静置30 min,4 ℃,12 500 r/min 离心25 min;(4)取上清,加入到2.0 mL 离心管中,加入等体积的⑤,-30 ℃静置1 h,4 ℃,12 500 r/min 离心25 min,弃上清;(5)用⑥洗涤2~4 遍,自然干燥,100 μL ⑦溶解,-70 ℃保存备用。
SDS 提取法:参考罗聪等[14]的方法。(1)第一步同异硫酸胍提取法;(2)加入65 ℃预热的5.5 mL ⑨,上下颠倒混匀,65 ℃温浴45 min,期间不时晃动离心管3~5 次,4 ℃,12 500 r/min,离心15 min,留上清液;(3)加入与清液同体积提取试剂③,震荡混匀,4 ℃,静置3~5 min,12 500 r/min,离心15 min,取上清液,加1/10 体积③和等体积⑤,混匀,-30 ℃静置20 min,4 ℃,12 500 r/min 离心20~25 min;(4)弃上清,用⑥洗沉淀2~3 次,超净台上风干,用100 μL ⑦溶解,-70 ℃保存备用。
试剂盒提取法:选0.15 g 果实样品,研磨前处理同异硫酸胍提取法,使用TakaRa 公司的RNAisoTM plus Trizol,提取步骤遵照Trizol 试剂产品说明书操作。
1.2.3 RNA 提取质量检验及浓度计算
用0.5 倍TBE 电泳缓冲液,在含1%琼脂糖凝胶上于4~5 V/cm 条件下进行电泳检测,利用凝胶电泳成像仪拍照,分析提取的总RNA 质量[15-16]。
取10 µL RNA 样 品,用0.1%EDPC 处 理 水将原液稀释20 倍,使用Eppendorf Biophotometre核酸蛋白分析仪测定230、260 及280 nm 波长的吸收光度值,对照为0.1%EDPC 处理水,计算A260/A230和A260/A280,检测RNA 纯度。
1.2.4 RT-PCR 反应
根据近缘植物甜橙基因组序列的CrAI 序列设计1 对引物,如下。
primer-F:ATGCACACCCGATACGATCAT CTCGA;
primer-R:GCGTTAAATTTGATCCAATGGC AAAGC。
PCR 扩增体系为20 µL:2 µL 10 倍的buffer、0.8 µL DNTP(2.5 µmol/L)、0.5 µL(10 µmol/L)引物、0.5 µL cDNA(25 ng)、用0.1%EDPC 水补足。扩增程序为95 ℃预变性5 min;95 ℃变性 1 min,53 ℃退火 50 s,72 ℃延伸3 min,34 个循环,72 ℃延伸10 min。
2 结果与分析
2.1 总RNA 纯度及浓度检测
比较分析提取金柑果实总RNA 的4 种方法,结果表明(见表1):4 种方法均能够提取金柑果实总RNA,但浓度和纯度有所不同。CTAB 提取法、SDS 提取法和试剂盒提取法提取金柑果实总RNA 的A260/A280比值在1.88~1.97 区间内,说明采用这3 种方法提取的RNA 不存在或者极少存在DNA 和蛋白质等大分子物质以及次生代谢物质的干扰。以上3 种方法所提取总RNA 的A260/A280分别在1.90~1.95、1.89~1.92、1.95~1.97 区间内,比较分析3 种方法所提取总RNA 的A260/A280可知:CTAB 提取法和试剂盒提取法所提取金柑果实总RNA 的A260/A280均大于1.9,说明这2 种方法具有较好的去除蛋白质、多糖等大分子物质的能力,且采用试剂盒提取法所提取的金柑果实总RNA 的A260/A280值更集中,采用试剂盒法提取金柑果实总RNA时去除大分子干扰的效果最佳;采用SDS 提取法所提取金柑果实时总RNA 的A260/A280有部分品种小于1.9,由此可知该法与其它2种方法相比,去除蛋白质、多糖等大分子物质干扰的能力较弱;采用异硫酸胍提取法所提取金柑果实时总RNA 的A260/A280值分布在1.69~1.73 区间内,远小于A260/A280值应大于1.90 的提取标准,说明采用该法所提取的金柑果实总RNA 存在相对较严重的大分子物质(如蛋白质和多糖)的干扰,尽管可以获得总RNA,但难以胜任对RNA 质量要求较高的后续试验。

表1 用4种方法所提取不同金柑品种果实总RNA的比较†Table 1 Comparison of total RNA from different cultivars of kumquat fruit extracted by four methods
采用CTAB 提取法、SDS 提取法和试剂盒提取法所提取的金柑果实总RNA 的A260/A230在2.00~2.10 区间内,说明采用这3 种方法所提取的金柑果实总RNA 完整性较好,小分子物质的干扰较少,而采用异硫酸胍法所提取的金柑果实总RNA 的A260/A280值分布在2.14~2.35 区间内,说明该方法虽然可以提取金柑果实总RNA,但RNA存在降解问题,且有小分子杂质的干扰。
根据所提取的金柑果实总RNA 浓度从高到低排序,4 种方法依次是异硫酸胍提取法、CTAB 提取法、SDS 提取法、试剂盒提取法。采用异硫酸胍提取法所提取金柑果实总RNA 浓度是采用试剂盒法所提取金柑果实总RNA 浓度的4~5 倍,差异显著,而采用CTAB 提取法所提取金柑果实总RNA 浓度略大于采用SDS 法所提取金柑果实总RNA 浓度。说明提取方法、采用的试验步骤和试剂组合对金柑果实总RNA 提取结果影响显著。
2.2 RNA 琼脂糖凝胶电泳检测
观察分析RNA 凝胶电泳图谱是评判RNA 质量的一种重要途径,从18S、28S 和5S RNA 条带的带型和亮度可以判断RNA 的提取质量。在质量分数为1%琼脂糖凝胶上,用4 种方法所提取总RNA 电泳结果如图1所示。
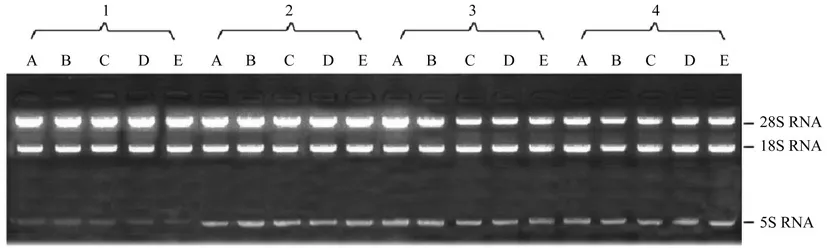
图1 用4 种方法所提取金柑果实总RNA 琼脂糖凝胶电泳结果的比较Fig.1 Comparison of agarose electrophoresis results of total RNA from kumquat fruit extracted by four methods
采用4 种方法均可提取金柑果实总RNA,且28S 条带亮度大于18S 条带亮度,采用异硫酸胍提取法所提取金柑果实总RNA 亮度较高,采用试剂盒提取法所提取金柑果实总RNA 亮度相对较差,这与表1中总RNA 浓度结果相一致,总RNA 浓度越高条带亮度越高,说明采用异硫酸胍提取法所提取金柑果实总RNA 可以获得较高浓度的RNA,但该法提取的金柑果实总RNA 点样孔有少量杂质存留,且5S RNA 条带微弱,肉眼不易观察。其余3种方法提取的金柑果实总RNA,亮度高、带型完整,说明提取质量较高,可用于后续相关试验的开展。
2.3 RT-PCR 扩增反应检测
以用4 种方法所提取金柑果实总RNA 作为模板进行反转录,结果如图2所示。由图2可知,所提取RNA样品均可被检测到该基因的转录表达,获得100~150 bp 的目的片段。

图2 用4 种方法所提取金柑果实总RNA 的RT-PCR 结果的比较Fig.2 Comparison of RT-PCR electrophoresis results of total RNA from kumquat fruit extracted by four methods
3 结 论
由230、260 和280 nm 紫外吸收波长不同组合的比值以及总RNA 浓度可知:试剂盒提取法去除大分子和小分子物质干扰的能力最强;就所提取总RNA 的浓度来说,异硫酸胍提取法所提取总RNA 浓度最高;综合比较4 种提取方法可知,尽管采用CTAB 提取法和SDS 提取法所提取总RNA浓度不是最高,但可以从金柑果实中提取到符合质量要求的总RNA,两者所提取总RNA 浓度相比,CTAB 提取法略高于SDS 提取法;试剂盒提取法虽然可以提取质量最高的总RNA,但其提取的总RNA 浓度显著低于其他3 种方法,并非是进行后续相关研究的首选方法。RT-PCR 扩增效果显示:4 种方法均可以获得清晰、整洁的RNA 反转录产物。比较分析3 种检测方法可以得出,CTAB 提取法是提取金柑果实总RNA 的最优选择。
4 讨 论
金柑果实富含金桔甙、柠檬萜、橙皮甙、脂肪酸、蛋白质、糖类、酚类、单宁及色素等次生代谢物质,这些物质的存在严重阻碍了总RNA 的提取。因此,一般提取总RNA 的方法有可能并不适用于金柑果实总RNA 的提取。4 种提取方法中,采用CTAB 提取法和SDS 提取法所提取金柑果实总RNA 浓度相接近,且总RNA 提取质量也相对较高,可能是因为采用这2 种方法提取过程中均加入了β-巯基乙醇和PVP-40,将金柑果实切割成小块,减少了研磨难度,同时使得研磨更加充分,经过人工研磨的机械损伤,植物细胞壁、细胞膜破碎,β-巯基乙醇与细胞内的蛋白质进行生化反应,打断了蛋白质的肽链,降解了蛋白质,也抑制了多种氧化酶的活性;PVP 粉末与酚类物质发生络合反应,阻止酚类物质被氧化成醌类物质,醌类物质无法生成,就不存在醌类物质与氢键络合,进而遏制了总RNA 氧化后的褐变现象;总RNA提取的同时往往伴随着白色粉面的多糖形成,降低了RNA 纯度,也严重阻碍了后续试验进展,CTAB 提取法和SDS 提取法均使用了2 mol/L 除杂试剂NaAc,该试剂可有效去除多糖物质对RNA提取质量的影响[17]。由图1和表1可知:采用异硫酸胍提取法所提取的RNA 浓度最高,进行琼脂糖凝胶电泳,其点样孔有极少蛋白质残留,笔者根据试验结果分析认为异硫酸胍提取法操作步骤少,使用试剂少,较大程度地保留了金柑果实中总RNA,但也因此连带未能较好地去除许多杂质(蛋白质),说明该法是把双刃剑,未能达到两全其美的提取效果;CTAB 提取法和SDS 提取法未见蛋白质残留,与异硫酸胍提取法相比,这有可能是因为采用了65 ℃水浴,提取试剂中加入了PVP 粉末和β-巯基乙醇的缘故,虽然这样操作增加了试验时间、耗材成本以及复杂程度,但提取结果优于异硫酸胍提取法,而采用CTAB 提取法所提取金柑果实总RNA 浓度大于采用SDS 提取法所提取金柑果实总RNA 浓度,有可能是因为前者提取试剂组成成分以及操作流程在更彻底地去除蛋白质等杂质的同时更大程度地保留了RNA;按照说明书操作的试剂盒提取法,适合大批量提取RNA,操作简单,节省时间,但成本相对较高,该法所提取金柑果实总RNA 质量最优,但浓度也最低,可能是因为该提取法选用了除杂能力极强的试剂配比组合,同时连带与部分RNA 发生络合反应的杂质均被去除掉,获取高纯化的RNA 同时也较其他提取法损失掉更多的RNA,因此出现了高质量RNA 的同时伴随着低浓度RNA。综合4种方法的提取效果,CTAB 提取法更适合金柑果实总RNA 的提取。
将采用4 种提取方法所提取的金柑果实总RNA 进行RT-PCR 扩增得到的反转录扩增产物在100~200 bp 之间(见图2)。但肉眼无法区分其差异,还应进行后续试验进一步分析。笔者选用的4 种方法均能够提取出金柑果实总RNA,但采用4 种方法所提取的总RNA 浓度和纯度存在一定程度的差异。其中CTAB 提取法能够较好地除去金桔甙、柠檬萜、多酚、单宁、橙皮甙、脂肪酸、多糖、色素以及蛋白质等杂质,提取的RNA 纯度较高,浓度也较理想,可进一步用于开展基因克隆、差异表达、转录组数据分析等相关研究工作[18-22]。
查阅前人的研究资料,未见提取金柑RNA 的相关报道,但关于其近缘植物柑橘的RNA 提取的研究报道较多,吴秀兰等[23]、叶庆亮等[24]、徐昌杰等[25]采用不同方法提取柑橘不同组织RNA,虽然得出一些结论,但采用的改良Asif 法和改良Bugos 法费时费力,偏离了方法简便、易普及和效果良好的选择方向;而柑橘果实汁囊总RNA 提取,只是比较了不同厂家生产的试剂盒之间的差异,选用提取方法范围不够广泛,具有片面性;柑橘虽然与金柑是近缘植物,但其内含物成分、比例以及浓度差异较大,适用于柑橘RNA 提取的方法未必适用于金柑RNA 提取,因此笔者选用普通实验室常用的4 种方法针对金柑果实RNA 的提取结果进行比较分析。
本研究也存在一定的局限性。如同一种提取方法所提取总RNA 结果不可能最高浓度和最佳质量并存,提取效果较好的方法往往费时、费力、成本高,RT-PCR 反应未能区分4 种提取方法的差异。若要克服上述研究的不足,需要制订更精细全面的试验方案、投入更多的研究成本,并需要大量详实的试验数据作为支撑。
