氧化钙-氢氧化钙热化学储热系统放热数值分析
2018-04-04潘智豪赵长颖
邓 畅,潘智豪,闫 君,赵长颖
氧化钙-氢氧化钙热化学储热系统放热数值分析
邓 畅,潘智豪,闫 君,赵长颖
(上海交通大学工程热物理研究所,上海 200240)
热化学储热与显热、潜热储热相比,储热密度高且能够实现常温下季节性储热。基于氧化钙-氢氧化钙热化学储热系统,建立了二维轴对称非稳态气固化学反应模型,对直接传热式氧化钙-氢氧化钙储热装置的放热过程进行了研究,并分析了压力、流量、床体孔隙率、床体高度等参数对放热过程的影响。该模型耦合了气固化学反应、多孔介质内的传热传质和流体流动。模拟结果表明,在反应床内存在一个反应速率较快的区域,随着放热的进行该区域由入口逐渐向出口移动;压力、流量分别是影响出口温度、放热功率的主要因素;改变反应物高度,系统的最大放热功率不变。
热化学储热;氢氧化钙;数值计算
目前,热量的储存主要有3种形式:显热储热、潜热储热和热化学储热。热化学储热利用可逆的化学反应来实现热量的储存与释放。与显热储热和潜热储热相比,热化学储热的储热密度更高,并且可以在常温下长期的储存热量。氧化钙-氢氧化钙来源广泛、价格低廉、储热密度高、储热温度适宜、系统潜在的应用领域广阔,包括太阳能集热发电[1-4]、工业余热回收、热泵[5-6]和引擎预热[7-8]等,是中高温热化学储热的研究热点。目前氧化钙-氢氧化钙热化学储热研究已经得到了热物性参数和动力学参 数[9-14],储热装置研究主要在实验室级别[16-22]。然而,由于实验系统的限制,已报道的少量储热系统的实验研究中反应条件较单一,缺乏不同反应条件对氧化钙-氢氧化钙热化学储热系统影响的系统总结和分析。针对以上问题,本工作建立了氧化钙-氢氧化钙二维轴对称非稳态模型,利用数值模拟,系统地研究了固定床反应器中温度、压力、反应速率、流动和放热功率的变化过程,确定了压力、流量、反应床孔隙率、反应物高度对储热性能指标的影响效果,为该储热系统的设计和开发提供指导。
1 模型的建立
1.1 物理模型
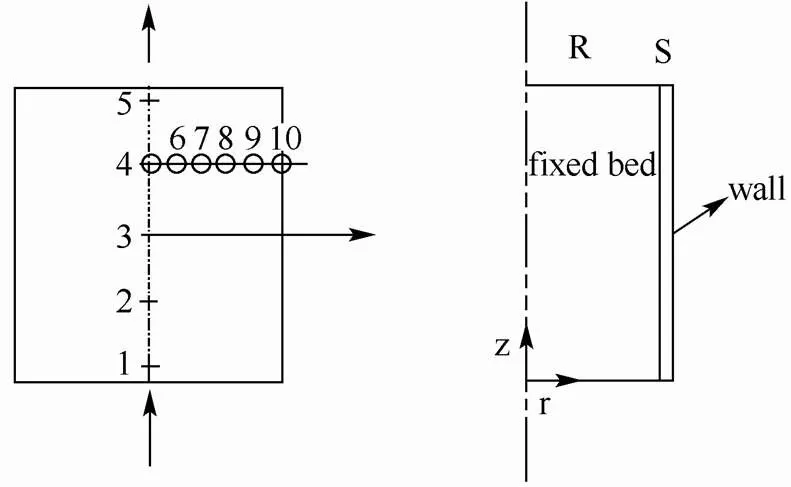
图1 氧化钙-氢氧化钙反应器
本工作研究的物理模型为一个圆柱形的反应器,底部半径为54.5 mm,高为61 mm。反应过程中,气体从反应器底部通入,流经固定床与氧化钙发生反应,从上部排出并带走热量。反应器壁面为不锈钢材质,厚度为3 mm,外部环境温度设置为30 ℃,并如图1所示设置监测点1~5,坐标为(0,-30),(0,-15),(0,0),(0,15),(0,30),监测点6~10,坐标为(5,15),(10,15),(15,15),(20,15),(25,15)。
1.2 数学模型
基于相关研究,对本工作中的模型做出以下合理假设:①反应器中气体看作理想气体;②反应过程中反应床的孔隙率和体积不发生变化;③反应床内任意点固体和气体之间没有温差;④不考虑辐射换热。
1.2.1 反应动力学方程
在氧化钙-氢氧化钙储放热过程中,化学反应的动力学方程如式(1)
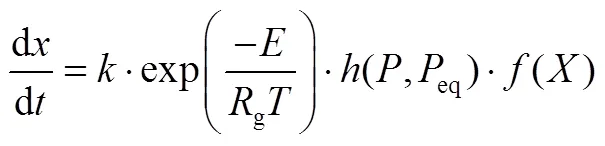
式中,前两项是Arrhenius项,其中是指前因子,是反应的活化能,g是理想气体常数。第3项表示反应系统所处状态与平衡状态的差异对反应速率的影响,第4项表示反应进度对反应速率的影响。具体的反应动力学方程参考文献[15]。
1.2.2 能量方程
研究表明由于反应物粒径很小,反应物和气体的传热系数足够大,因此气体和固体间温差可以忽略不计。固体、气体和反应器壁面分别有能量方程
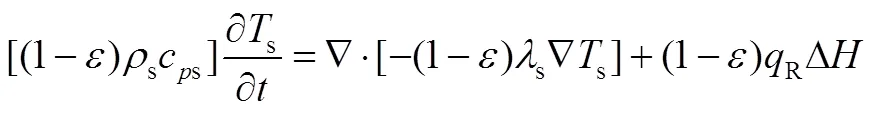
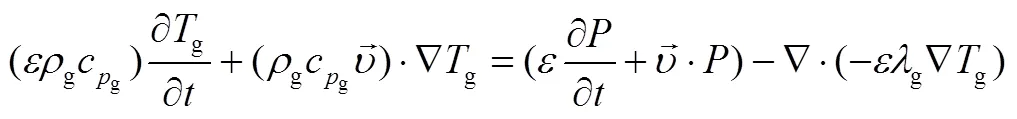

参考文献[22],反应床体的导热系数和温度的关系可以表示为

1.2.3 质量方程
对固体、气体和水蒸气建立质量方程


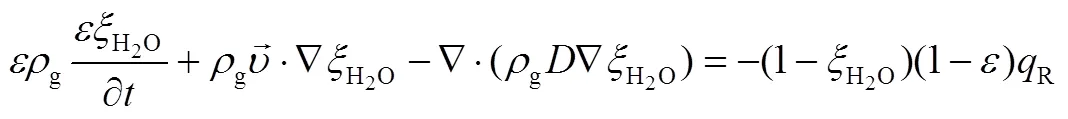
R为单位体积水蒸气质量反应速率
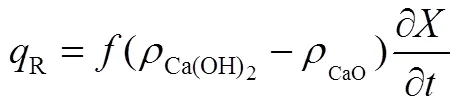
是实际反应物反应比例取0.9。
1.2.4 动量方程
反应床内部气体流动遵从达西定律,由达西定律可知
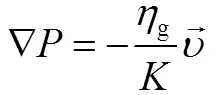
由Kozeny-Carman方程知渗透率、反应物粒径、孔隙率存在如下关系
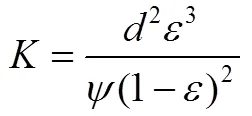
参考文献[25],取180。

表1 反应物的物化性质及系统的操作参数
2 结果与讨论
2.1 氧化钙放热反应
在放热反应中,反应器入口通入氮气和水蒸气的混合气体,其中水蒸气与氧化钙反应放热,而氮气则作为主要的传热流体。在本研究中,设定氮气流量为280 g/h,水蒸气流量为120 g/h,气体和固定床初始温度为300 ℃,反应器初始压力和出口压力为2 bar(1bar=105Pa),反应器外部温度为30 ℃,换热系数为12 W·(m2·K)-1。
反应床内温度随时间变化如图2所示。由图2(a)可知,反应开始阶段,反应床中心温度迅速上升并保持在490 ℃,反应一段时间后入口到出口5个监测点温度依次下降。由图2(b)可知,对于反应床内同一高度不同半径处,温度也是先上升后下降,靠近壁面处温度更低,最高温度维持时间更短,温度上升和下降更缓慢。这是由于反应床壁面附近传热效果更好,壁面附近的点不会达到平衡温度,而反应床中心处传热效果较差,当温度到达对应水蒸气下平衡温度后,放热反应停止,温度曲线出现明显的平台。图3是不同时间反应器对称轴上反应速率的分布,由图可知反应床中存在一个化学反应速率明显较快的区域从入口向出口推进,这与其它文献的研究结果相符合[23-24]。图4给出了=500 s,沿对称轴=0,反应速率、温度和水蒸气分压的分布。
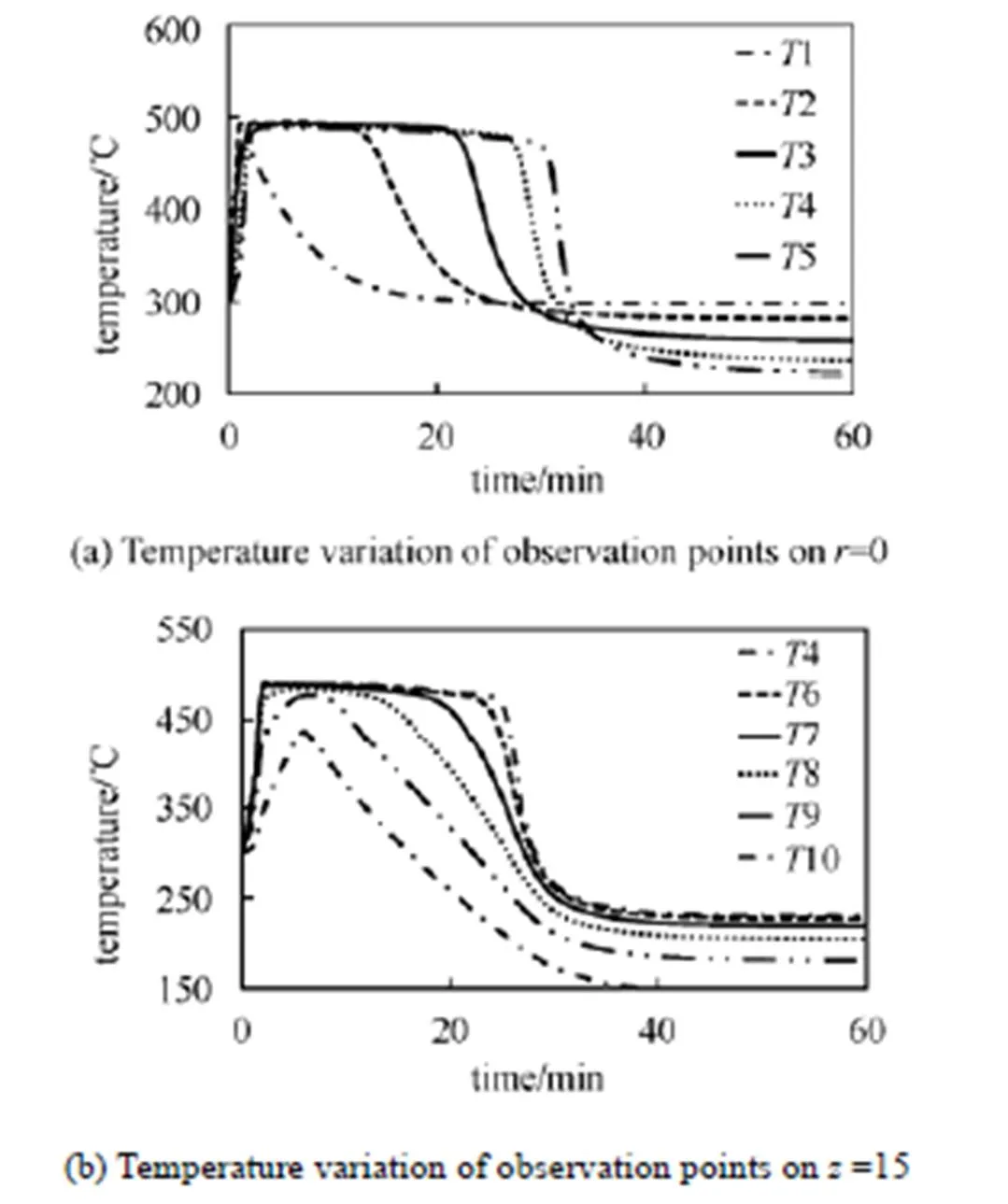
图2 监测点温度随时间变化
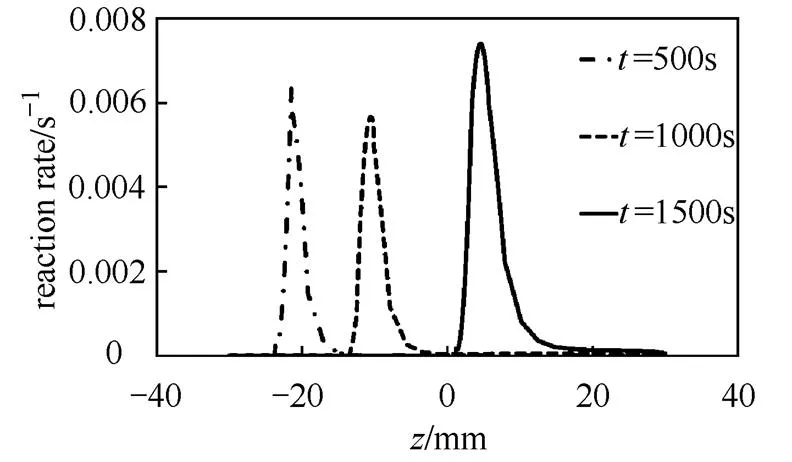
图3 不同时间对称轴上反应速率的分布
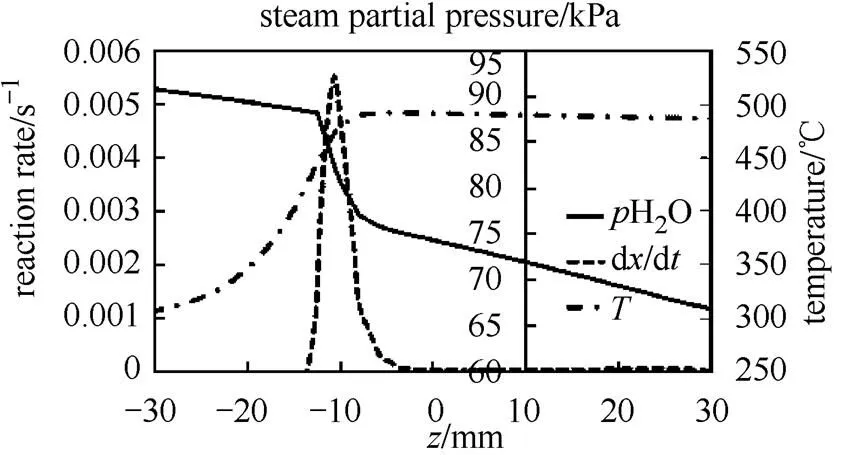
图4 t =500 s, r =0反应速率、温度和水蒸气分压的分布
由图可知,靠近入口的区域反应消耗了水蒸气并放出了热量,导致靠近出口区域温度升高的同时水蒸气分压下降,放热反应平衡逆向移动,当温度到达对应水蒸气分压下平衡温度,放热反应停止。随着入口处反应的结束,床体靠近入口侧温度下降,水蒸气分压上升,后部反应平衡正向移动,放热反应开始,化学反应区域向出口推进。
在整个反应过程中,系统的反应放热功率可以表示为

由图5可以得知,刚开始反应时,系统放热功率最大达到110 W,随着时间的进行,反应物消耗速率降低,系统的放热功率逐渐降低,约30 min后,系统反应放热功率降到0。
2.2 反应条件对放热反应影响分析
出口温度和反应放热功率是热化学储热最关键的性能指标,因此下文主要分析反应条件对这两个指标的影响。
2.2.1 水蒸气分压对放热反应的影响
水蒸气分压直接影响化学反应速率和化学反应平衡。为了研究水蒸气分压对放热反应的影响,选择其它反应条件不变出口压力分别为0.2~2.5 bar的反应系统进行研究。
水蒸气分压对出口温度的影响如图6所示,水蒸气分压越高对应的平衡温度越高,出口温度也越高。出口压力为0.5~2.5 bar 的对应出口温度在420~490 ℃。平衡温度随水蒸气分压升高而升高,但升高幅度逐渐减小。如需继续提高平衡温度,需要显著提高水蒸气压力。这一良好的特性使得系统在蒸汽压力较大波动的情况下出口温度保持相对稳定。
水蒸气分压对放热功率的影响如图7所示。水蒸气分压从0.5 bar 上升到2.5 bar,最大放热功率从80 W上升到110 W。这主要是由于提升水蒸气分压,出口温度上升,进出口温差增大。
2.2.2 气体流量对放热反应的影响
为了研究气体流量对放热反应的影响,选择其它反应条件不变,氮气和水蒸气流量分别为280 g/h 和120 g/h、560 g/h和 240 g/h、840 g/h和360 g/h的反应系统进行研究。
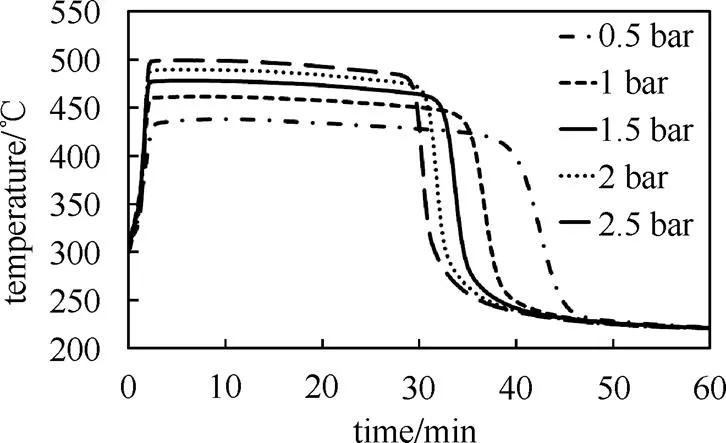
图6 不同压力出口温度

图7 不同压力反应放热功率
气体流量对出口温度的影响如图8所示。最高出口温度随水蒸气流量基本无变化,但是在高流量的情况下,出口温度下降得更快,反应提前完成,说明提高水蒸气流量可以加快反应的速率。图9给出了放热功率随时间的变化关系。系统最大反应放热功率随气体流量增加显著增加。这是由于提高气体流量增强了反应床内的传热,从而显著提升了最大放热功率,缩短了反应时间。
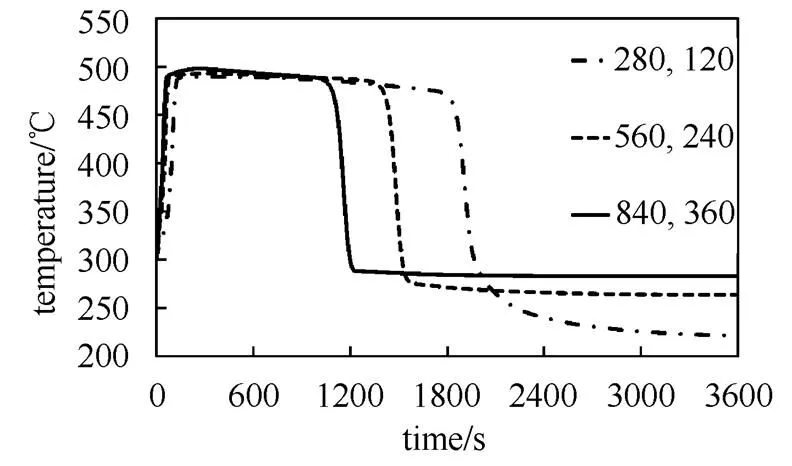
图8 不同流量下出口温度

图9 不同流量下反应放热功率
Fig.9 Variation of flow rate during hydration: impact on reaction exothermic power
在该模型当中传热流体与反应颗粒充分换热,气体的流量和进出口温差决定了换热量。此外,增加流体流量提高了水蒸气的补充速率。在这两个因素的共同作用下,增大气体流量使得放热反应平衡正向移动。综上所述,可以通过调节气体流量直接控制反应放热功率。
2.2.3 孔隙率对放热反应的影响
较高的储热密度是热化学储热相对其它储热形式的重要优势,降低孔隙率可以进一步提高氢氧化钙-氧化钙的储热密度。此外反应床可能存在孔隙率不均匀现象。为了研究孔隙率对放热反应的影响,选择其它反应条件不变,反应床孔隙率分别为0.6、0.7、0.8的反应系统进行研究。
孔隙率对出口温度的影响如图10所示。不同孔隙率下系统出口最高温度几乎一致,但低孔隙率最高温度保持的时间更长,说明完全反应所需要的时间更久。孔隙率对反应放热功率的影响如图11所示。不同孔隙率下系统稳定时最大放热功率基本不变,降低反应床孔隙率,系统放热反应完全所需的时间增加。这说明,氧化钙与水反应的速率足够快,传热功率决定了反应放热功率。总体而言,降低反应床的孔隙率不会改变最大稳定放热功率,但提高了材料的储热密度,从而延长了放热时间,限制反应的主要因素依然是传热。

图10 不同孔隙率出口温度
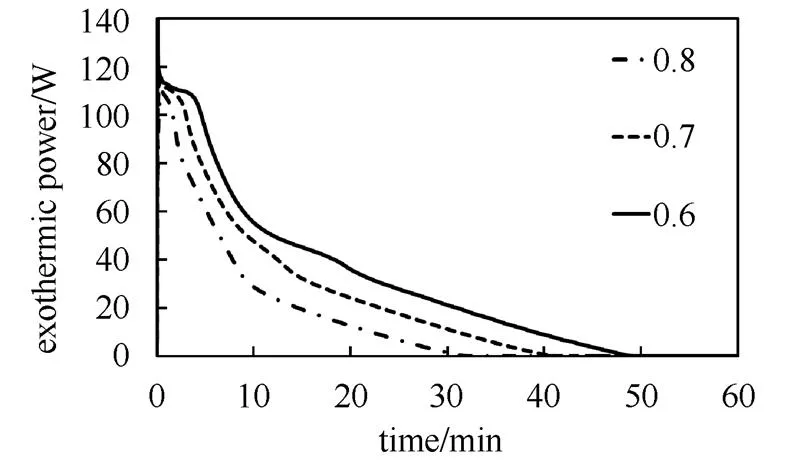
图11 不同孔隙率反应放热功率
2.2.4 反应物高度对放热反应的影响
在实际应用中,为了获得不同的功率和储热量需要将储热系统进行串联或并联。串联系统可以通过改变反应物的高度来实现。为了研究反应物高度对放热功率的影响,选择其它反应条件不变,反应物高度分别为61 mm、183 mm和305 mm的反应系统进行研究。
在一定床体高度范围内,最大反应功率随着床体高度增加而增加。继续增加反应物的高度,由于反应发生区域不再增加,最大反应功率不变,但最大反应功率持续时间和总放热量增加。因此在设计储热系统时,可以通过改变反应物高度调节储热量而保持一定的放热功率。
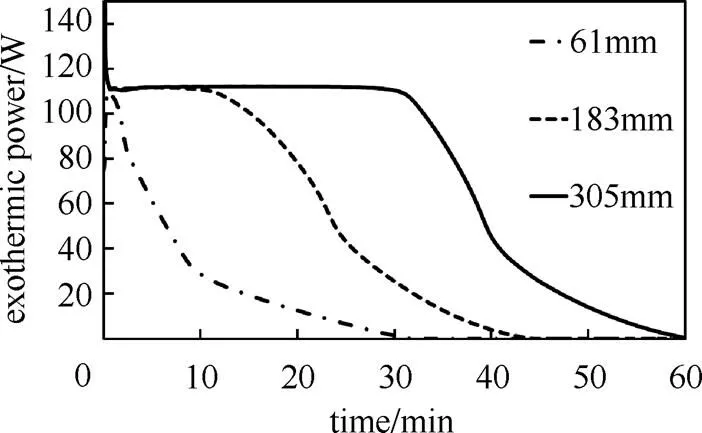
图12 不同反应物高度下放热功率
3 结 论
与其它储热方式相比热化学储热具有储热密度高和可实现常温下季节性储热等优势。本工作采用数值模拟的方法,建立了多物理场耦合的二维轴对称非稳态模型,对直接传热式固定床中氧化钙-氢氧化钙的放热过程和反应条件对放热过程的影响进行了系统地研究,得出以下结论。
(1)直接传热式氧化钙-氢氧化钙固定床反应器中存在一个化学反应速率明显较快的区域,化学反应由入口向出口逐渐进行。
(2)提高水蒸气分压可以提高放热温度和放热功率,系统在较宽幅度的水蒸气压力下保持相对稳定的出口温度。提高流量可以提高系统的放热功率,在该模型当中传热流体与反应颗粒充分换热,气体的流量决定了换热量,从而决定了放热功率。
(3)降低反应床孔隙率,放热功率不变但反应时间延长,储热密度提高。在一定范围内,通过增加反应物的高度可以增加反应物的量从而增加反应放热功率,继续增加反应物的高度,由于反应区域不再扩大,反应放热功率保持恒定。
符 号 说 明

cp——比热容,J·(kg·K)-1 D——N2-H2O两相有效扩散系数m2·s-1 d——反应颗粒半径, mm E——活化能,J·mol-1 f——实际物料反应比例 H——高度,mm ΔH——反应焓,kJ·mol-1 K——渗透率,m2 k——指前因子,s-1 M ——摩尔质量,kg·mol-1 P——压力,Pa qR——单位体积水蒸气质量反应速率,kgH2O·m-3 Rg——理想气体常数,J·(mol·K)-1 r——半径,mm T——温度,K t——时间,s ——速度,m·s-1 W——放热功率,W X——无量纲转化率 ε——孔隙率 η——动力黏度,Pa·s ξ——质量分数 ρ——密度,kg·m-3 Ψ——Kozeny-Carman常数 下角标 0——初始 CaO——氧化钙 Ca(OH)2——氢氧化钙 eq——反应平衡 g——气体 H2O——水 R——反应 reactor——反应器 s——固体 st——不锈钢 W——反应器壁面
[1] Bauerle G, Chung D, Ervin G, et al. Storage of solar energy by inorganic oxide/hydroxides[C]//Sharing the Sun: Solar Technology in the Seventies, 1976, 8: 192-218.
[2] Fujii I, Tsuchiya K, Higano M, et al. Studies of an energy storage system by use of the reversible chemical reaction: CaO+ H2O⇌ Ca(OH)2[J]. Solar Energy, 1985, 34(4/5): 367-377.
[3] Brown D R, Marche J L L, Spanner G E. Chemical energy storage system for solar electric generating system (SEGS) solar thermal power plant[J]. Journal of Solar Energy Engineering, 1992, 114(4):212-218.
[4] Schaube F, Wörner A, Tamme R. High temperature thermochemical heat storage for concentrated solar power using gas–solid reactions[J]. Journal of Solar Energy Engineering, 2011, 133:1006-1012.
[5] Ogura H, Shimojyo R, Kage H, et al. Simulation of hydration/dehydration of CaO/Ca(OH)2chemical heat pump reactor for cold/hot heat/generation[J]. Drying Technology, 1999, 17(7/8): 1579-1592.
[6] Ogura H, Yamamoto T, Kage H, et al. Effects of heat exchange condition on hot air production by a chemical heat pump dryer using CaO/H2O/Ca(OH)2reaction[J]. Chemical Engineering Journal, 2002, 86(1): 3-10.
[7] Darkwa K. Thermochemical energy storage in inorganic oxides: An experimental evaluation[J]. Applied Thermal Engineering, 1998, 18(6): 387-400.
[8] Azpiazu M N, Morquillas J M, Vazquez A. Heat recovery from a thermal energy storage based on the Ca(OH)2/CaO cycle[J]. Applied Thermal Engineering, 2003, 23(6): 733-741.
[9] Dutta S, Shirai T. Kinetics of drying and decomposition of calcium hydroxide[J]. Chemical Engineering Science, 1974, 29(9): 2000-2003.
[10] Irabien A, Viguri J R, Ortiz I. Thermal dehydration of calcium hydroxide. 1. Kinetic model and parameters[J]. Ind. Eng. Chem.Res, 1990, 29(8): 1599-1606.
[11] Lander J J. Experimental heat contents of SrO, BaO, CaO, BaCO3and SrCO3at high temperatures. dissociation pressures of BaCO3and SrCO3[J]. Journal of the American Chemical Society, 1951, 73(12): 5794-5797.
[12] Chen D, Gao X, Dollimore D. The application of non-isothermal methods of kinetic analysis to the decomposition of calcium hydroxide[J]. Thermochimica Acta, 1993, 215(4): 65-82.
[13] Long X F, Dai L, Lou B, et al. The kinetics research of thermochemical energy storage system Ca(OH)2/CaO[J]. International Journal of Energy Research, 2017, 41(7):1004-1013.
[14] Samms J A C, Evans B E. Thermal dissociation of Ca(OH)2at elevated pressures[J]. Journal of Applied Chemistry, 1968, 18(1): 5-8.
[15] Schaube F, Koch L, Wörner A, et al. A thermodynamic and kinetic study of the de- and rehydration of Ca(OH)2, at high H2O partial pressures for thermo-chemical heat storage[J]. Thermochimica Acta, 2012, 538(12):9-20.
[16] Criado Y A, Alonso M, Abanades J C. Kinetics of the CaO/Ca(OH)2hydration/dehydration reaction for thermochemical energy storage applications[J]. Industrial & Engineering Chemistry Research, 2014, 53(32): 12594-12601.
[17] Yan J, Zhao C Y. First-principle study of CaO/Ca(OH)2thermochemical energy storage system by Li or Mg cation doping[J]. Chemical Engineering Science, 2014, 117(117): 293-300.
[18] Yan J, Zhao C Y. Thermodynamic and kinetic study of the dehydration process of CaO/Ca(OH)2, thermochemical heat storage system with Li doping[J]. Chemical Engineering Science, 2015, 138(138): 86-92.
[19] Pardo P, Anxionnaz-Minvielle Z, Rougé S, et al. Ca(OH)2/CaO reversible reaction in a fluidized bed reactor for thermochemical heat storage[J]. Solar Energy, 2014, 107(9): 605-616.
[20] Schmidt M, Szczukowski C, Roßkopf C, et al. Experimental results of a 10 kW high temperature thermochemical storage reactor based on calcium hydroxide[J]. Applied Thermal Engineering, 2014, 62(2): 553-559.
[21] Schaube F, Kohzer A, Schütz J, et al. De-and rehydration of Ca(OH)2in a reactor with direct heat transfer for thermo-chemical heat storage. Part A: Experimental results[J]. Chemical Engineering Research and Design, 2013, 91(5): 856-864.
[22] SCHAUBE F, Utz I, Wörner A, et al. De-and rehydration of Ca(OH)2in a reactor with direct heat transfer for thermo-chemical heat storage. Part B: Validation of model[J]. Chemical Engineering Research and Design, 2013, 91(5): 865-873.
[23] 顾清之, 赵长颖. 镁-氢化镁热化学蓄热系统数值分析[J]. 化工学报, 2012, 63(12): 3776-3783.
Gu Q, Zhao C. Numerical study on Mg/MgH2thermochemical heat storage system[J]. Journal of Chemical Industry and Engineering (China), 2012, 63(12): 3776-3783.
[24] BOGDANOVIĆ B, Spliethoff B. Active MgH2Mg-systems for hydrogen storage[J]. International Journal of Hydrogen Energy, 1987, 12(12): 863-873.
[25] Ranjha Q, Oztekin A. Numerical analyses of three-dimensional fixed reaction bed for thermochemical energy storage[J]. Renewable Energy, 2017, 111(111): 825-835.
Numerical study on exothermic process of a CaO-Ca(OH)2thermochemical heat storage system
DENG Chang, PAN Zhihao, YAN Jun, ZHAO Changying
(Institute of Engineering Thermophysics, Shanghai Jiao Tong University, Shanghai 200240, China)
Compared to sensible and latent heat storage, thermochemical heat storage has a higher heat storage density, achieving seasonal heat storage at ambient temperature. This paper concerns a CaO-Ca(OH)2heat storage system. A 2D axisymmetric transient model was developed to study the exothermic process of the system, which is essential for reactor design and operation condition optimization. The effect of different reaction conditions and reaction bed parameters on the exothermic process was investigated systematically. The results indicated a rapid reaction zone in the reaction bed with the exothermic reaction moving from the inlet to the outlet. The outlet temperature was mainly influenced by the steam pressure and the reaction exothermic power was mainly influenced by the flow rate. The results also showed that the height of reaction bed had no effect on the maximum reaction exothermic power.
thermochemical heat storage; calcium hydroxide; numerical computation
10.12028/j.issn.2095-4239.2017.0168
TK 02
A
2095-4239(2018)02-0248-07
2017-11-23;
2017-12-06。
国家重点基础研究发展计划(2013CB228303)及国家自然科学基金(51706130)。
邓畅(1993—),男,硕士研究生,主要从事热化学储热理论与技术研究,E-mail:ycdengc@126.com;
赵长颖,教授,主要研究方向为多孔介质传热、热辐射、微纳尺度传热及储热,E-mail:changying.zhao@sjtu.edu.cn。
