KDM2B基因克隆及其在牦牛组织和卵母细胞减数分裂过程中的表达研究
2018-04-04蔡雯祎熊显荣杨显英阿果约达
蔡雯祎,熊显荣,陈 通,杨显英,韩 杰,阿果约达,李 键
(西南民族大学生命科学与技术学院,成都 610041)
组蛋白修饰主要包括甲基化、乙酰化、磷酸化、泛素化和类泛素化修饰[1],这些修饰作用影响了染色质构象并调控目的基因表达,还参与了调控发育和内环境的稳态等细胞学进程[2-3]。甲基化修饰是组蛋白共价修饰中最稳定的,2004年第1个组蛋白的去甲基化酶LSD1 (Lysine specific demethylase 1)被发现前,组蛋白的甲基化一直被认为是不可逆的[4]。之后组蛋白去甲基化酶陆续被发现,根据其酶活性功能基团的差异可以分为两大类:含Amino oxidase结构域的赖氨酸特异性去甲基化酶(Lysine specific demethylase,LSD)家族与含Jumonji特征结构域(Jumonji C domain,JmjC)的组蛋白去甲基化酶(Jumonji C domain containing histone demethylase, JHDM)家族。
JHDM1B也称FBXL10,现在统一称为KDM2B (Lysine-specific histone demethylase 2B),属于包含JmjC结构域的去甲基化酶亚家族。Y.I.Tsukada等[5]通过甲基化酶生化分析和质谱分析发现是H3K36的去甲基化酶,后来又发现其不仅仅是H3K36me1/2的去甲基化酶也是H3K4me3的去甲基化酶[6-7],而且在发育和疾病的发生中具有重要作用。KDM2B在人的胰腺癌中高表达,它通过分离转录抑制和激活程序控制肿瘤的发生[8]。KDM2B受Oct4与Sox2的直接调控,在小鼠胚胎干细胞中招募多梳抑制复合体的核心组件,并通过CXXC结构域介导与CPG岛的形成抑制分化相关基因的表达[9]。KDM2B在小鼠胚胎成纤维细胞中通过抑制p19ARF、p15lnk4b和p16Ink4a3个基因位点来调节细胞生长和衰老[10]。KDM2B能够与重编程关键基因的启动子区结合并激活转录,在诱导多功能干细胞的重编程早期发挥功能,提高诱导效率[11]。在斑马鱼上的研究发现,通过调节胚胎中KDM2B 的水平可以减缓幼体出生后眼睛残缺(Ocular coloboma)、心缺陷(Heart defects)、鼻孔闭锁(Atresia of the choanae)、生长和发育迟缓(Reta-rdation of growth and development)、生殖器畸形(Genital anomalies)和耳朵畸形或耳聋(Ear malformations/deaf-ness)的CHARGE综合症状[12]。T.Fukuda等[13]发现,在KDM2B敲除的小鼠中细胞的增殖和凋亡异常,会导致早期胚胎在神经、脑、视网膜和尾巴等方面的发育缺陷。L.Lu等[14]在非洲爪蛙上也发现,敲除KDM2B后胚胎出现头部结构的萎缩和后部结构的丧失,而且KDM2B通过调节Wnt信号通路中β-Catenin的稳定性来调控非洲爪蛙胚胎形成过程中前后体轴的形成。综上,KDM2B对细胞增殖、凋亡、分化、衰老、肿瘤的形成以及胚胎的发育等都起到调控作用[15]。
牦牛是青藏高原地区的主要畜种,有“高原之舟”的美誉,但其繁殖力较低,大部分为两年一胎或三年两胎。目前还未见关于KDM2B基因在牦牛上的相关报道。本试验以牦牛卵丘卵母细胞复合体为研究对象,通过RT-PCR克隆得到KDM2B基因的序列,进行生物信息学分析。并用qRT-PCR检测KDM2B分别在不同时期卵母细胞及其对应卵丘细胞中的表达水平,旨在为进一步研究牦牛KDM2B基因功能及其在生理生殖过程中所发挥的作用提供理论依据。
1 材料与方法
1.1 试验样品的采集
所有样本均采自成都市青白江屠宰场,牦牛被屠宰后,迅速用无菌剪刀采集脑、小肠、肾、肺、脾、肝、心、胃、睾丸、肌肉、子宫和卵巢12种组织。无菌生理盐水清洗,剪成小块装入冻存管,并在液氮中保存备用。另外选择3~5岁、体质良好、体型相似的且处于非黄体期的健康雌性牦牛采集卵巢,冲洗后,放入含有双抗的25 ℃生理盐水中,在保温壶中保存,并于2 h内,送回实验室。
1.2 卵丘-卵母细胞复合体(Cumulus-oocyte complex,COCs)的收集与培养
加有双抗的生理盐水预热后,冲洗牦牛卵巢3遍,选择卵巢上直径为3~8 mm的卵泡,用10 mL的一次性注射器(带12号针头)抽取卵泡液,置于90 mm的平皿中,轻轻摇匀,在体视显微镜下,收集COCs。挑选卵丘颗粒细胞3层以上、卵母细胞质均匀且结构致密,用卵母细胞成熟液清洗3次后,置于含3 mL成熟液的培养皿中,每个平皿放30个COCs,在含5.5%的CO2,38.5 ℃湿度饱和的培养箱中体外成熟培养。从卵巢取出来的卵丘细胞包裹紧密的COCs处于GV期,成熟12 h后,卵丘细胞松散处于MI期,成熟24 h后,能观察到第一极体的排除,处于MII期。因此,分别在0、12和24 h获得GV、MI和MII期3个时期的COCs,用0.5%透明质酸酶将卵母细胞和卵丘颗粒细胞分离,进行后续研究。
1.3 试剂与培养液的配置
Trizol购自Invitrogen公司,DEPC购自天根生化科技有限公司,Single Cell-to-CTTM试剂盒购自Invitrogen公司,PrimeScriptTMRT Reagent Kit反转录试剂盒、Premix TapTMDNA聚合酶、SYBR®Premix Ex TaqTMⅡ试剂盒、pMD-19T载体、DNA Marker均购自TaKaRa公司,DNA胶回收试剂盒购自OMEGA公司,胎牛血清(FBS)、Medium1培养基购自Gibco公司,促黄体素(LH)、促卵泡素(FSH)、雌二醇、丙酮酸钠、谷氨酰胺购自Sigma公司,石蜡油购自Vitrolife公司,地衣红购自上海源叶生物,其他无特殊说明的试剂均为国产分析纯。卵母细胞成熟液:M199+10% FBS+0.01 μg·L-1FSH+0.01 μg·L-1LH+0.001 μg·L-1E2+0.02 ng·L-1EGF。
1.4 总RNA的提取和反转录
根据Trizol法提取各个组织的总RNA,紫外分光光度计检测浓度和OD值。质量符合要求的RNA样品,按照PrimeScriptTMRT Reagent Kit反转录试剂盒说明书合成cDNA,用GAPDH基因的特异性引物检测cDNA的质量,电泳出现亮条带的cDNA放在-20 ℃保存备用。将分离得到的不同时期的卵丘颗粒细胞和卵母细胞,按照Single Cell-to-CTTM试剂盒说明书直接合成cDNA,-20 ℃保存。
1.5 引物的设计与合成
根据GenBank中普通牛KDM2B基因的mRNA序列(登录号:XM_019977355.1)和GAPDH基因mRNA序列(登录号:AC_000162.1),利用Primer5.0软件分别设计PCR扩增引物(表1)。同时用NCBI中Primer-BLAST在线比对工具检测引物的质量,引物由生工生物工程股份有限公司合成。
表1引物序列及其反应条件
Table1Primersequencesandreactionconditions

引物名称Primersymbol引物序列(5'-3')Primersequence退火温度/℃Tm产物长度/bpProductsizeKDM2B-CF:CCCACAACTGCTGAAAATR:GAGCAATGGTCCAGAAAGCA58.54259KDM2B-QF:CAGACGGAAGCCACGAATR:CAGCACCCACTCCTCATACA60207GAPDH-QF:TGCTGGTGCTGAGTAGTTGGTGR:TCTTCTGGGTGGCAGTGATGG60290
KDM2B-C.克隆引物;KDM2B-Q和GAPDH-Q.定量引物。F.正向引物;R.反向引物
KDM2B-C. The cloning primer; KDM2B-Q and GAPDH-Q.The quantitative primers. F.Sense primer; R.Antisense primer
1.6 KDM2B基因的克隆测序
PCR扩增反应体系为25 μL:2×LA Taq Master Mix 12.5 μL,上下游引物(10 μmol·L-1)各1 μL,模板1 μL,补ddH2O 9.5 μL。反应条件:94 ℃预变性4 min;94 ℃变性20 s,58.5 ℃退火45 s,72 ℃延伸4 min,35个循环;72 ℃再延伸7 min,最后4 ℃保存。15 g·L-1琼脂糖凝胶电泳检测PCR产物,紫外光下切目的条带按照胶回收试剂盒说明书回收目的DNA。胶回收产物与PMD-19T载体16 ℃连接10 h,转化到感受态细胞DH5α中。将菌液均匀接种在含有100 μg·mL-1氨苄的LB固体培养基上,37 ℃培养过夜,随机挑取单菌落在摇床震荡培养8 h,PCR筛选阳性克隆送交生工(上海)生物工程股份有限公司测序。
1.7 KDM2B蛋白生物信息学分析
NCBI中ORF Finder分析KDM2B序列的开放阅读框,BLAST在线工具进行同源性比较, Protparam和ProtScale预测牦牛KDM2B蛋白的基本理化性质和亲疏水性,PredictProtein和SWISS-MODEL预测KDM2B的二级结构和三级结构。
1.8 KDM2B基因组织表达谱分析
以GAPDH为参照,用实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)检测KDM2B基因在牦牛脑、小肠、肾、肺、脾、肝、心、胃、睾丸、肌肉、子宫和卵巢中的表达。qRT-PCR反应体系:SYBR-Premix Ex TaqTMⅡ 7.5 μL,上下游引物各0.5 μL,cDNA 1 μL,补ddH2O至15 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。每个样品重复3次。
1.9 KDM2B基因在牦牛卵母细胞减数分裂过程中的表达规律
qRT-PCR检测KDM2B基因在牦牛卵母细胞减数分裂的3个不同阶段(GV、MI、MII期)及其相应卵丘颗粒细胞中的表达规律。qRT-PCR反应体系同1.8,每个样品重复3次。
1.10 数据分析
2-△△Ct法对实时荧光定量结果进行均一化处理,SPASS软件进行方差分析,P<0.05表示差异显著,P<0.01表示差异极显著,Duncan法对各组织间的mRNA表达量进行多重比较。
2 结 果
2.1 牦牛KDM2B基因的克隆及序列分析
以牦牛卵巢组织的总RNA为模板,利用RT-PCR对KDM2B基因的CDS区进行扩增,测序获得4 259 bp的核苷酸序列(图略),开放阅读框为3 930 bp,共编码1 309个氨基酸。
目前GenBank中已经测定的KDM2B基因序列仅有3种:人、小鼠和褐家鼠,其他动物的KDM2B基因均为预测序列。将克隆得到的牦牛KDM2B基因与黄牛(Bostaurus)、野牦牛(Bosmutus)、猪(Susscrofa)、绵羊(Ovisaries)、山羊(Caprahircus)、人(Homosapiens)、黑猩猩(Panpaniscus)、小鼠(Musmusculus)、褐家鼠(Rattusnorvegicus)、骆驼(Camelusdromedarius)、猫(Feliscatus)、原鸡(Gallusgallus)和斑马鱼(Daniorerio)的KDM2B基因进行相似性比对,结果见表2。与其他哺乳动物相比,克隆得到的KDM2B基因的核苷酸序列的相似性达到90%以上,其中与人、小鼠和褐家鼠的相似性分别为92%、89%和90%;氨基酸序列相似性大都95%以上,其中与人、小鼠和褐家鼠的相似性都为96%。由此可见,KDM2B基因在进化过程中相对保守,而且碱基突变多为同义突变。
表2牦牛KDM2B基因与其他物种的相似性比对

Table 2 Alignment of yak KDM2B gene with the corresponding sequences of various species %
2.2 牦牛KDM2B蛋白结构和功能预测
ExPASy在线工具分析牦牛KDM2B蛋白的理化性质,该蛋白分子量为149 737.23,分子式为C6556H10474N1894O1971S74。脂肪族系数为71.40,半衰期为30 h,等电点为8.63,不稳定系数为64.01,推测该蛋白为碱性不稳定蛋白。KDM2B蛋白包含20种氨基酸,出现频率较高的有Leu(9.3%)、Glu(9.2%)、Lys(8.0%)、Ser(7.9%)和Arg(7.7%)。其中带正电荷的氨基酸残基(Arg+Lys)有206个,带负电荷的氨基酸残基(Asp+Glu)有187个,所以KDM2B蛋白整体上带正电。
Signal P和TM pred分析发现,牦牛KDM2B蛋白为不含跨膜结构和信号肽的非分泌蛋白。亲疏水性分析发现,牦牛KDM2B蛋白存在293、294、295、296位点存在最小亲水指数-3.544,在539位点达到最大疏水指数2.222,平均亲水指数为-0.728。牦牛KDM2B蛋白修饰预测发现,磷酸化位点有126个,包含79个Ser,39个Thr和8个Tyr;N-糖基化位点有3个;O-糖基化位点有84个,且阈值均在0.5以上。
牦牛KDM2B基因包括几个主要的功能结构域:JmjC功能域,CXXC型锌指结构域和PHD型的锌指结构域,F-Box功能域和8个LRR(Leucine-rich repeat)重复序列(图1)。KDM2B 蛋白的二级结构预测结果显示,该蛋白的α-螺旋占35.14%,β-转角占6.95%,延伸链占14.36%,无规卷曲占43.54%,同时,KDM2B蛋白的三级结构进一步验证了二级结构的预测(图2)。

图1 KDM2B蛋白的结构域预测Fig.1 The predicted domain of yak KDM2B protein

图2 KDM2B蛋白三级结构预测Fig.2 The predicted tertiary structure of yak KDM2B protein
2.3 牦牛KDM2B基因的组织表达谱
KDM2B基因在牦牛脑、小肠、肾、肺、脾、肝、心、胃、睾丸、肌肉、子宫和卵巢组织中的表达谱如图3所示,结果表明,牦牛KDM2B基因在各个组织中均有表达,但表达量存在一定的差异,在脾、子宫、睾丸和卵巢中表达量较高,且与其他组织比差异极显著(P<0.01),而在胃、脑、肌肉中表达量较低。
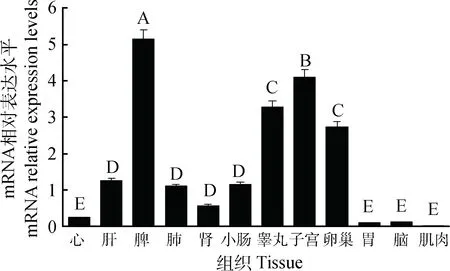
不同大写字母表示差异极显著(P<0.01),相同大写字母表示差异不显著(P>0.05)。下同Different capital letters mean extremely significant difference (P<0.01),the same capital letter mean no significant difference (P>0.05).The same as below图3 KDM2B基因组织表达水平Fig.3 Tissues expression levels of yak KDM2B gene
2.4 KDM2B在牦牛卵母细胞不同成熟阶段的表达
以GAPDH基因为内参,用qRT-PCR方法分别检测KDM2B基因在牦牛卵母细胞减数分裂的不同时期及其相应卵丘颗粒细胞中的表达情况(图4)。在卵母细胞中GV期和MII期KDM2B的表达水平相差不大(P>0.05),而MI期的表达水平极显著高于这两个时期(P<0.01)。在卵丘颗粒细胞中KDM2B的表达水平随成熟时间的进行而极显著增加(P<0.01)。
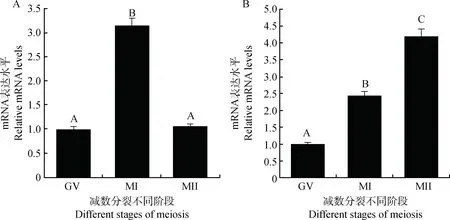
图4 KDM2B基因在牦牛卵母细胞(A)和卵丘颗粒细胞(B)减数分裂不同阶段的表达Fig.4 The expression of KDM2B in different stages during meiosis of the oocyte (A)and the cumulus cells(B) in yak
3 讨 论
组蛋白修饰介导的表观遗传调控对哺乳动物的胚胎发育有至关重要的作用,其中组蛋白的甲基化修饰方式是最稳定的。组蛋白的甲基化可以发生在精氨酸和赖氨酸的侧链,每个残基上的氨基氮都可以发生一次或多次的甲基化。组蛋白H3上特异性赖氨酸残基的甲基化位点参与了多数基因的调节,包括一些与发育和分化相关的基因,如H3K4和H3K36上的甲基化与转录激活相关,H3K9和H3K27上的甲基化与基因沉默相关[16-17]。组蛋白去甲基化酶的发现推翻了组蛋白甲基化是单向发展的理论,这为人们解开了很多细胞内无法解释的难题。迄今为止,已发现组蛋白去甲基化酶家族成员有27个,其中KDM2B对细胞增殖、凋亡、分化、衰老、肿瘤的形成以及胚胎的发育等都起到调控作用。本研究在克隆牦牛KDM2B基因序列的基础上,检测其在不同组织中的表达,并研究其在卵母细胞减数分裂过程中的表达规律,为KDM2B的功能研究提供了试验依据,同时也为提高牦牛的胚胎质量奠定基础。
目前GenBank中已经测定的KDM2B基因序列仅有3个:人、小鼠和褐家鼠,其他动物的KDM2B基因均为预测序列,而且不管是已确定的序列还是预测序列都有多个转录本。在人上有两个转录本,分为长型和短型,长型与短型相比在5′端多出90 bp,在2 450 bp后多出114 bp。在黄牛上有8个预测转录本,在牦牛上有1个预测转录本,而本研究中只获得了1条牦牛转录本。现在还不清楚牦牛上是否有其他转录本的存在,而转录本的差异也导致了牦牛基因与其他物种基因相似性和蛋白结构上的差异[18]。笔者克隆得到的牦牛KDM2B序列要比GenBank中预测的牦牛序列长一些,可能是长型与短型的区别,由此导致了蛋白上的差异,因此,还需后续研究进一步验证牦牛上KDM2B基因是否还存在其他转录本。但从结构域的分析结果发现5个主要功能结构域:JmjC功能域(和组蛋白去甲基化酶活性有关):CXXC型的锌指结构域(结合DNA),PHD型的锌指结构域(结合DNA),F-Box功能域(结合蛋白质)和LRR重复序列都存在,说明这些主要功能域在不同的物种间是高度保守的[13,19]。而且同源性分析发现,该基因与黄牛和野牦牛的同源性最高,表明,牦牛KDM2B基因在进化过程中具有较高的保守性。
组织表达谱的结果发现,牦牛KDM2B基因在脾和睾丸中的表达量较高,与R.Pfau等[20]的研究结果一致,还发现在子宫和卵巢中表达量也较高,而在胃、脑、肌肉中表达量最低。表观遗传学的变化被认为是癌症细胞的显著特征之一[21-22],KDM2B由于其有效的抑癌作用被用作不同疾病的新的治疗靶点,包括造血细胞肿瘤[23]和胃癌[24]等。脾是全身最大的免疫器官,KDM2B在脾中高表达说明其抑癌作用可能与机体的免疫系统有关系,该问题有待进一步的研究。在KDM2B缺失的细胞中KDM5A的表达量会显著下降,并发现了一条KDM2B-KDM5A/Myc的调控通路[7],而KDM5A与生殖息息相关[25],通常只在生殖器官中表达。
KDM2B在胚胎发育过程中起至关重要的作用,一旦缺失会导致早期胚胎在神经、脑、视网膜和尾巴等方面的发育缺陷[13]。在雌性胚胎中KDM2B的缺失会导致X染色体相关基因表达的减少以及常染色体基因的异常表达[26]。胚胎是由卵母细胞受精而成,而敲除KDM2B的雄性小鼠附睾的精子数量显著降低[13],之后M.Ozawa等[27]发现,KDM2B在长期可持续的精子发生中通过调节细胞周期起重要作用。已有研究发现,KDM2B在卵母细胞减数分裂的不同时期都有表达,且主要在细胞核中表达。本试验研究发现KDM2B在MI期显著高于GV期和MII期的表达水平,这可能与卵母细胞减数分裂过程中的两次分裂阻滞有关。在体内环境下,减数分裂从双线期停滞恢复是由促性腺激素LH启动的[28]。在LH的刺激下,壁颗粒细胞中cAMP水平上升,PKA和PKC通路被激活,合成大量的EGF样因子,这些EGF样因子激活卵丘细胞中MAPK的活性,促进减数分裂恢复后的细胞进程[29]。卵丘细胞中活化的MAPK通过磷酸化CX43导致间隙连接关闭,打断卵丘细胞和卵母细胞之间的联系[30],使体细胞中的抑制因子无法进入卵母细胞,从而导致卵母细胞内cAMP水平的下降,进入第二次减数分裂中期停滞。KDM2B与cAMP在卵母细胞中的表达模式相一致,由此推测KDM2B可能参与了卵母细胞的减数分裂过程,这需要进一步的研究来验证。
4 结 论
本试验成功克隆了牦牛KDM2B基因序列,与牦牛已有预测序列相比,属于长型转录本;生物信息学分析发现CDS区的保守性较强;在脾、子宫、睾丸和卵巢中的表达量较高,而在胃、脑、肌肉中的表达量较低。为KDM2B基因在牦牛繁殖调控中的进一步研究提供理论依据。在卵母细胞中GV期和MII期KDM2B的表达水平相差不大(P>0.05),而MI期的表达水平极显著高于GV期和MII期(P<0.01)。在卵丘细胞中KDM2B的表达水平随成熟时间的进行而极显著增加(P<0.01)。这可能与减数分裂过程中的两次分裂阻滞有关,为进一步研究牦牛卵母细胞减数分裂机制及改善牦牛繁殖效率提供基础资料。
参考文献(References):
[1]KOOISTRA S M, HELIN K. Molecular mechanisms and potential functions of histone demethylases[J].NatRevMolCellBiol, 2012, 13(5): 297-311.
[2]KIMWA H, SATO Y, ZHANG J, et al. Histone modification sensors in living cells[J].GeophysJInt, 2015(1): 201-202.
[3]LI C W, GUO S S, ZHANG M, et al. DNA methylation and histone modification patterns during the late embryonic and early postnatal development of chickens[J].PoultSci, 2015, 94(4): 706-721.
[4]SHI Y J, LAN F, MATSON C, et al. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J].Cell, 2004, 119(7): 941-953.
[5]TSUKADA Y I, FANG J, ERDJUMENT-BROMAGE H, et al. Histone demethylation by a family of JmjC domain-containing proteins[J].Nature, 2006, 439(7078): 811-816.
[6]JANZER A, STAMM K, BECKER A, et al. The H3K4me3 histone demethylase Fbxl10 is a regulator of chemokine expression, cellular morphology, and the metabolome of fibroblasts[J].JBiolChem, 2012, 287(37): 30984-30992.
[7]TZATSOS A, PASKALEVA P, LYMPERI S, et al. Lysine-specific Demethylase 2B (KDM2B)-let-7-Enhancer of Zester Homolog 2 (EZH2) pathway regulates cell cycle progression and senescence in primary cells[J].JBiolChem, 2011, 286(38): 33061-33069.
[8]TZATSOS A, PASKALEVA P, FERRARI F, et al. KDM2B promotes pancreatic cancer via Polycomb-dependent and-independent transcriptional programs[J].JClinInvest, 2013, 123(2): 727-739.
[9]HE J, SHEN L, WAN M, et al. KDM2B maintains murine embryonic stem cell status by recruiting PRC1 complex to CpG islands of developmental genes[J].NatCellBiol, 2013, 15(4): 373-384.
[10]KOTTAKIS F, POLYTARCHOU C, FOLTOPOULOU P, et al. FGF-2 regulates cell proliferation, migration, and angiogenesis through an NDY1/KDM2B-miR-101-EZH2 pathway[J].MolCell, 2011, 43(2): 285-298.
[11]LIANG G Y, HE J, ZHANG Y. KDM2B promotes induced pluripotent stem cell generation by facilitating gene activation early in reprogramming[J].NatCellBiol, 2012, 14(5): 457-466.
[12]BALOW S A, PIERCE L X, ZENTNER G E, et al. Knockdown offbxl10/kdm2bbrescueschd7 morphant phenotype in a zebrafish model of CHARGE syndrome[J].DevBiol, 2013, 382(1): 57-69.
[13]FUKUDA T, TOKUNAGA A, SAKAMOTO R, et al. Fbxl10/Kdm2b deficiency accelerates neural progenitor cell death and leads to exencephaly[J].MolCellNeurosci, 2011, 46(3): 614-624.
[14]LU L, GAO Y, ZHANG Z, et al. Kdm2a/b lysine demethylases regulate canonical Wnt signaling by modulating the stability of nuclear β-catenin[J].DevCell, 2015, 33(6): 660-674.
[15]DAVID G. Regulation of oncogene-induced cell cycle exit and senescence by chromatin modifiers[J].CancerBiolTher, 2012, 13(11): 992-1000.
[16]BERGER S L. The complex language of chromatin regulation during transcription[J].Nature, 2007, 447(7143): 407-412.
[17]LI B, CAREY M, WORLANAN J L. The role of chromatin during transcription[J].Cell, 2007, 128(4): 707-719.
[18]朱江江, 林亚秋, 左璐璐, 等. 牦牛KLF5、KLF6、KLF7基因的克隆表达及其与肌内脂肪含量的相关性分析[J]. 畜牧兽医学报, 2017, 48(3): 416-424.
ZHU J J, LIN Y Q, ZUO L L, et al. Molecular cloning, tissue expression ofKLF5,KLF6,KLF7 genes, and their correlations with intramuscular fat content in yak[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(3): 416-424. (in Chinese)
[19]WANG T, CHEN K S, ZENG X M, et al. The histone demethylases Jhdm1a/1b enhance somatic cell reprogramming in a vitamin-C-dependent manner[J].CellStemCell, 2011, 9(6): 575-587.
[20]PFAU R, TZATSOS A, KAMPRANIS S C, et al. Members of a family of JmjC domain-containing oncoproteins immortalize embryonic fibroblasts via a JmjC domain-dependent process[J].ProcNatlAcadSciUSA, 2008, 105(6): 1907-1912.
[21]SHEN H, LAIRD P W. Interplay between the cancer genome and epigenome[J].Cell, 2013, 153(1): 38-55.
[23]ANDRICOVICH J, KAI Y, PENG W Q, et al. Histone demethylase KDM2B regulates lineage commitment in normal and malignant hematopoiesis[J].JClinInvest, 2016, 126(3): 905-920.
[24]ZHAO E H, TANG C L, JIANG X L, et al. Inhibition of cell proliferation and induction of autophagy by KDM2B/FBXL10 knockdown in gastric cancer cells[J].CellSignal, 2017, 36: 222-229.
[25]NAVARRO-COSTA P, MCCARTHY A, PRUDNCIO P, et al. Early programming of the oocyte epigenome temporally controls late prophase I transcription and chromatin remodelling[J].NatCommun, 2016, 7: 12331.
[26]BOULARD M, EDWARD J, BESTOR T H, et al. Abnormal X chromosome inactivation and sex-specific gene dysregulation after ablation of FBXL10[J].EpigeneticsChromatin, 2016, 9: 22.
[27]OZAWA M, FUKUDA T, SAKAMOTO R, et al. The histone demethylase FBXL10 regulates the proliferation of spermatogonia and ensures long-term sustainable spermatogenesis in mice[J].BiolReprod, 2016, 94(4): 92.
[28]MEHLMANN L M. Signaling for meiotic resumption in granulosa cells, cumulus cells, and oocyte[M]//COTICCHIO G, ALBERTINI D, DE SANTIS L. Oogenesis. London: Springer, 2013: 171-182.
[29]MEHLMANN L M. Stops and starts in mammalian oocytes: Recent advances in understanding the regulation of meiotic arrest and oocyte maturation[J].Reproduction, 2005, 130(6): 791-799.
[30]SUN Q Y, MIAO Y L, SCHATTEN H. Towards a new understanding on the regulation of mammalian oocyte meiosis resumption[J].CellCycle, 2009, 8(17): 2741-2747.
