宿主细胞感染支原体后的“宿命”
2018-04-04吴习习罗海霞郝秀静马春骥
吴习习,罗海霞,郝秀静,马春骥,3,李 敏*
(1.西部特色生物资源保护与利用教育部重点实验室(宁夏大学),银川 750021;2.宁夏大学生命科学学院,银川 750021;3.宁夏职业技术学院生物与制药技术系,银川 750021)
支原体(Mycoplasma)是介于细菌与病毒之间、无细胞壁的一类原核微生物。这类微生物最早是1898年由法国E. Nocard及E. R. Roux从患肺疫的牛中分离出来,当时命名为类胸膜肺炎微生物(pleuropneumonia like organism,PPLO),1956年正式命名为支原体[1]。支原体种类众多,可引起动物和人类多种疾病,严重影响畜牧业的发展,威胁人类健康。现有研究发现,支原体作为一种病原菌,感染宿主细胞后通过黏附于宿主细胞表面,干扰宿主细胞膜功能导致细胞损伤。细胞凋亡、自噬能抵抗病原微生物入侵,是维持细胞内环境稳态的基本生理过程,可以缓解病原菌感染早期对宿主细胞的损伤。随着病原菌与细胞互作研究的深入,发现支原体感染宿主细胞后对细胞的损伤影响不容忽视。因此,本文从支原体感染宿主细胞引发的细胞凋亡、自噬、癌变方面进行概述。
1 支原体感染与细胞凋亡
支原体通过黏附宿主细胞表面侵染细胞[2],引起细胞凋亡,有利于菌体的入侵和毒素的释放,为支原体的定植和致病提供有利条件。支原体的荚膜、脂质相关膜蛋白(lipid-associated membrane proteins,LAMPs)等表面结构和支原体感染宿主细胞后产生的代谢物在诱导细胞凋亡过程中发挥重要作用。
1.1 支原体荚膜介导的细胞凋亡
荚膜是多种支原体细胞膜外的一层黏性结构,其化学成分主要是多糖。支原体的荚膜结构与其致病性密切相关,是致病支原体重要的毒力因子[3]。
刘紫玲等[4]在研究人肺炎支原体(Mycoplasmapenumoniae,MP)的过程中发现荚膜多糖可以通过与树突细胞(dendritic cell,DC)表面的树突细胞特异性细胞间黏附分子-3-结合非整合素分子(dendritic cell-specific intercellular adhesion molecule-3-grabbing nonintegrin,DC-SIGN)结合促进抑制性细胞因子IL-10的分泌,进而启动相应的凋亡信号。M. Niang等[5]利用钌红染色技术,在绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)菌株中首先观察到荚膜的存在,并证实了荚膜在介导菌体与宿主黏附过程中发挥重要作用。Z. J. Jiang等[6]在研究MO与绵羊气管上皮细胞间的互作时首次分离和纯化了MO荚膜多糖,深入研究发现荚膜多糖感染宿主细胞可以破坏线粒体膜的完整性,引起细胞线粒体膜电位的降低。同时荚膜通过上调FAS/FASL信号蛋白和半胱氨酸天冬氨酸蛋白酶-8(caspase-8)诱导外源性细胞凋亡,并通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)JNK和p38信号促进活性氧(reactive oxygen species,ROS)依赖的内源性细胞凋亡(图1)。荚膜作为支原体重要的毒力因子,还可以通过诱导宿主细胞免疫损伤,对宿主细胞造成一定的毒害作用。Z. J. Jiang等[7]研究还发现,MO荚膜感染绵羊气管上皮细胞后激活TLRs/MYD88信号介导的炎症反应,诱导宿主细胞的免疫损伤。
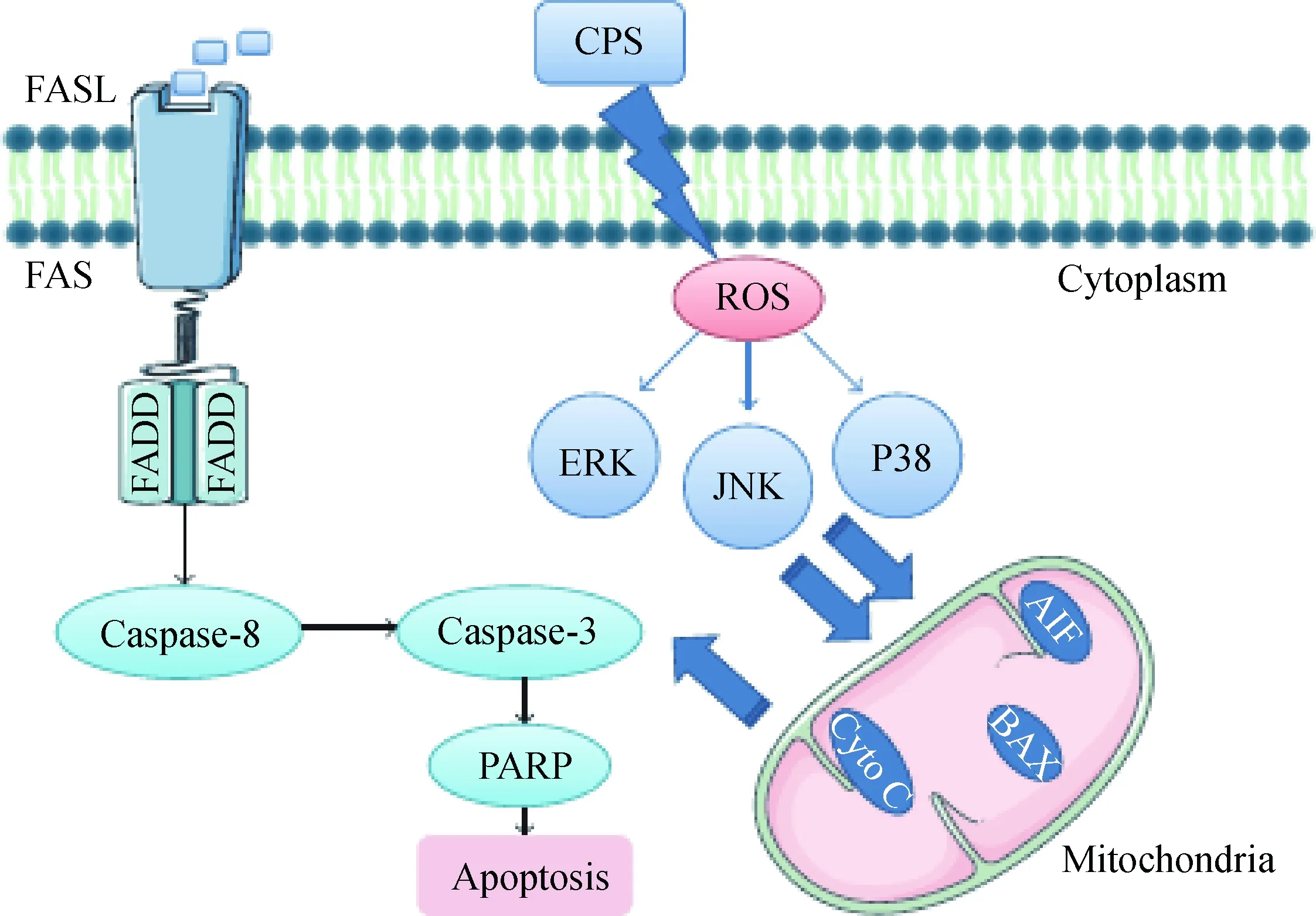
图1 CPS诱导绵羊支气管上皮细胞凋亡的caspase-3依赖性途径示意[6]Fig.1 Scheme showed a possible mechanism of CPS-induced caspase-dependent apoptosis in ALI cultures of sheep bronchial epithelial[6]
1.2 支原体LAMPs介导的细胞凋亡
LAMPs是支原体细胞膜内在蛋白和外周膜蛋白的统称[8]。LAMPs是支原体的一种重要的毒力蛋白,具有很强的抗原性,在很大程度上决定着支原体对细胞的毒害作用[9]。
研究发现猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)LAMPs可诱导猪外周血单个核细胞(PBMC)外源性途径和半胱氨酸天冬氨酸蛋白酶-3(caspase-3)途径的细胞凋亡,LAMPs通过促炎细胞因子NO和ROS的释放,激活p38 MAPK信号通路,经过Bax/Bcl-2信号进而激活caspase-3;同时LAMPs介导外源性途径通过caspase-8激活caspase-3,随后激活的caspase-3将PARP切割成两个片段以招募ATP,进而与相应底物作用执行凋亡活动[10]。汪洋[11]在建立的鸡毒支原体(MycoplasmaGalliscepticum,MG)LAMPs与鸡胚成纤维细胞(DF1)相互作用的模型中,确定了LAMPs具有诱导DF1细胞凋亡的作用,进一步研究证实LAMPs可以激活DF1细胞中caspase-3的活性,裂解PARP,启动凋亡信号。此外,LAMPs作为TLR2的主要识别受体,可以直接与宿主细胞膜上的TLR2相互作用,通过分泌TNFα、IL-1β等凋亡启动因子参与细胞凋亡[12],例如在MP感染过程中[13],LAMPs可通过作用于单核细胞TLR2、TLR6激活NF-κB通路,诱导促炎因子TNFα、IL-1β、IL-6的表达,进而启动细胞凋亡活动;在牛肺炎支原体(Mycoplasmabovis,Mb)[14]中同样发现LAMPs通过TLR2、MYD88途径激活NF-κB通路过表达IL-1β,调控细胞凋亡;丝状支原体(Mycoplasmamycoidessubsp.mycoides,Mmm)的LAMPs[15]亦可通过TLR2、MyD88、IRAK4途径激活NF-κB介导IL-1β的高表达,即通过诱发宿主系列炎症反应,进而启动相应的凋亡信号传导。
1.3 支原体代谢产物介导的细胞凋亡
支原体感染宿主后的代谢产物也是导致宿主细胞损伤的重要诱因。当支原体突破宿主屏障在呼吸道富集时,可以产生大量的H2O2和ROS,同时H2O2的沉积也会造成红细胞裂解、支气管纤毛运动被抑制,同时诱导细胞产生ROS,进而抑制抗氧化物酶的产生,造成细胞损伤[16]。
在MP引发的特发性间质性肺炎(idiopathic interstitial pneumonias,IIP)中发现,MP可以导致肺部上皮细胞的细胞色素C(cytochrome C,Cyc-C)从线粒体释放,从线粒体释放到细胞质的Cyc-C易与凋亡蛋白激活因子1(apoptotic protease activating facter-1,Apaf-1)形成凋亡小体,并在ATP作用下激活caspase-3和caspase-9,通过线粒体途径导致肺部上皮细胞凋亡[17]。在MO感染气管上皮细胞后发现,其可产生大量的ROS并激发宿主氧化应激,从而造成线粒体损伤进而释放Cyc-C[18],ROS作为MAPK通路重要的激活因子[19],可通过氧化磷酸化激活MEK1/2/ERK1/2信号通路,进而导致细胞抗凋亡能力下降,同时线粒体释放Cyc-C活化caspase的级联反应,最终导致宿主细胞发生凋亡(图2)。此外,MO感染产生的ROS还可以激活气管上皮细胞的p38-MAPK和caspase-3信号传导,通过caspase-3/PRAP信号通路诱导细胞凋亡[20],即MO可以通过激活MAPK信号通路,同时伴随着caspase级联反应的活化诱导细胞凋亡[21-22]。此外,ROS还可以直接激活NF-κB或通过氧化还原因子(Ref-1)间接激活NF-κB,激活的NF-κB进入细胞核与c-myc等凋亡相关因子结合,诱导细胞凋亡[23-24]。
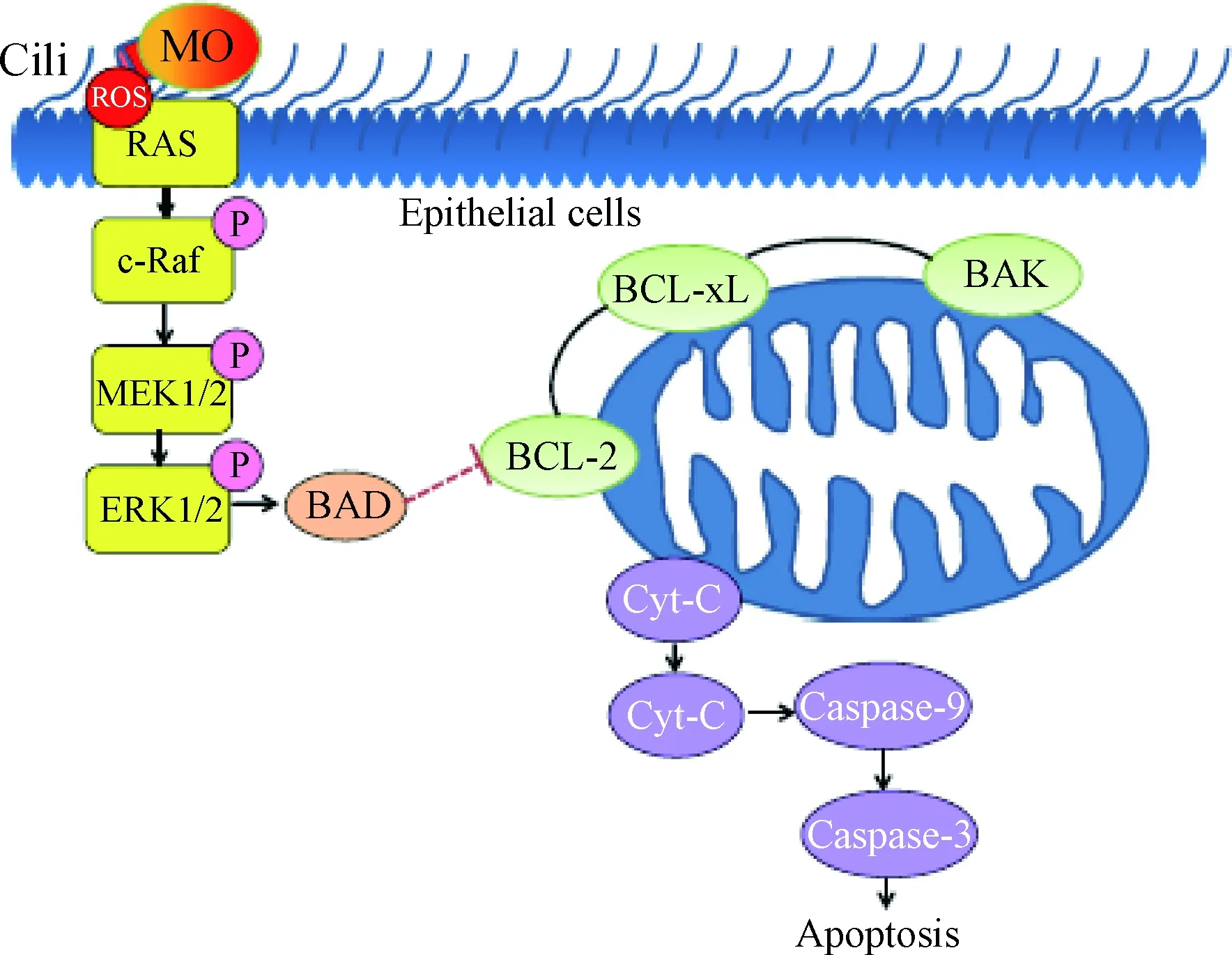
图2 MO感染诱导细胞凋亡的线粒体途径示意[18]Fig.2 Schematic diagram of an apoptotic cell death induced by M. ovipneumoniae infection via signalling pathways converging at mitochondria[18]
2 支原体感染与细胞自噬
细胞自噬是一种溶酶体依赖性降解途径,通过降解胞内衰老损伤的细胞器维持细胞内环境稳定,是细胞应对恶劣环境的一种主动反应[25],同时细胞自噬在抵抗病原菌感染过程中也起到一定作用[26]。
2.1 支原体诱导细胞自噬
在MG感染小鼠巨噬细胞细胞系RAW264.7中,可以通过TLR2调控细胞自噬,此过程同时有多个信号通路(包括ERK1/2、JNK和p38)被激活,然而干扰TLR2后只有ERK1/2磷酸化的表达水平显著降低,当ERK1/2信号通路被抑制剂PD98059抑制时,自噬相关蛋白质表达显著下调,细胞内LC3斑点的数量显著减少,即MG通过TLR2激活ERK信号通路触发巨噬细胞自噬[27]。T. Shimizu等[28]研究发现MP感染巨噬细胞后,可被吞噬进入胞内,诱导自噬发生,与此同时MP也通过TLR4途径诱导强烈的炎症反应,然而自噬抑制剂能下调该过程促炎因子的释放,表明自噬的发生同时介导炎症反应,此外,MP的ABC-转运体(MPN333)和ATP合成酶F0F1亚基(MPN597)对于自噬/TLR4介导通路的活化是必不可少的[29]。本课题组成员孙远航[30]研究发现MO感染小鼠肺上皮细胞(TC-1)可以诱导细胞发生自噬,进一步研究发现,MO也可诱导RAW264.7发生自噬,在MO感染前期,TC-1、RAW264.7细胞通过自噬水平的增强对MO有一定的清除作用,随着支原体感染时间的延长,细胞自噬对其的清除有所限制,沉默自噬关键基因P62和Atg7后,MO的存活率升高,即自噬参与了MO在胞内增殖的过程。
2.2 支原体逃避细胞自噬
支原体长期定植、感染宿主细胞的过程中已经形成了逃避自噬,进而长期存活于胞内的机制。支原体感染宿主细胞后,可以与宿主细胞膜融合,通过募集Rab7和LC3-II形成自噬体包裹支原体,诱导宿主细胞发生自噬,并且研究发现支原体诱导自噬有助于减少胞内支原体积累,Rab7是支原体在宿主细胞内积累所必需的,Rab7的上调可促进自噬体的融合,进而扰乱内吞体和自噬体的动力学,抑制自噬的降解过程,为胞内支原体提供生存环境,从而促进了支原体的细胞内感染与长期存活[31],这种通过上调Rab7和抑制自噬降解途径帮助支原体在细胞内积累的过程,可能是支原体逃避细胞对自身清除的作用机制。在解脲支原体(Ureaplasmaurealyticum,Uu)感染HeLa细胞的研究中发现,Uu可以通过网格蛋白依赖性内吞作用进入细胞,并被运送至早期内体,即诱导细胞自噬反应,此外被运送至内体的Uu还可以通过内体循环、细胞外分泌或胞吐作用被运输至胞外,逃避细胞自噬对自身的清除,并且纯化的Uu脂蛋白具有抗原性,可以诱导宿主免疫反应,造成宿主免疫损伤[32],即Uu可以利用宿主细胞膜囊泡逃避宿主自噬和免疫系统对自身的损伤,进而促进其对宿主细胞的长期感染和毒害。
3 支原体感染与细胞癌变
近年来研究发现,支原体感染与肿瘤的发生有一定的关系[33],如支原体感染宿主细胞后与细胞膜成分的互换,促使信号从细胞膜到核的转导,进而改变许多基因的表达,为细胞癌变提供可能。此外,支原体的长期存在可以通过炎症反应诱导各种细胞因子产生,对细胞的增生和分化发挥作用,进而有可能影响肿瘤的发生发展。
随着分子生物学技术的发展和应用,在人类的一些实体瘤中相继发现有支原体的存在。R. Y. H. Wang等[34]检测414例H1V-1阳性感染者血清中抗穿透支原体抗体的水平,发现高滴度者患Kaposi肉瘤的危险性是低滴度者的11.7倍,穿透支原体(Mycoplasmapenetrans,Mpe)与Kaposi肉瘤的形成密切相关。Y. A. Barykova等[35]研究发现前列腺上皮内瘤变(HGPIN)或前列腺癌症(PCa)患者中Uu含量是良性患者的三倍,并且通过对PCa患者的血清样品分析发现其携带更高水平的Uu抗体[36]。近年来,结肠癌、胃癌、肺癌[37-39]组织中均被发现有猪鼻支原体(Mycoplasmahyorhinis,Mhy)的存在,Mhy的存在和肺癌、结肠癌等肿瘤细胞的侵袭能力增强相关。
现有研究证明一些支原体在慢性组织培养侵袭期间具有诱导其核型变化和恶性转化的潜力,S.Tasi等[40]用发酵支原体(Mycoplasmafermentans,Mf)及Mpe感染极少自发转化的小鼠胚胎细胞系C3H10T1/2,在感染6周后,C3H细胞显示出形态学的改变;11周后细胞出现恶性改变,此时用抗生素杀灭支原体,细胞的恶性特征迅速消失;18周之后,细胞转化已不可逆,且在软琼脂上形成集落,在裸鼠体内成瘤。另有研究发现支原体能够感染并转化正常肺细胞,并能够诱导骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)表达上调[41],高表达的BMP2激活致癌途径并促进小鼠肺部肿瘤生长[42]。CYP1A1作为细胞色素酶亚家族成员,是前致癌物质代谢活化的主要功能酶,参与癌症病变及肿瘤发生过程,当Mhp感染宿主后,CYP1A1基因表达水平显著变化,此过程可能存在潜在的致癌风险,同时CYP1A1和PPAR-γ还参与调控由Mhp诱导的宿主炎症反应[43]。支原体与宿主细胞长期互作的过程中,对宿主细胞的恶性影响不容忽视,目前支原体与细胞癌变的关系及分子机制还有待进一步研究。
4 讨论及展望
支原体侵染宿主细胞的首要条件是黏附,支原体细胞膜的一端向外突起形成“附着细胞器”或“尖端结构”介导支原体与宿主的黏附作用[44-45],并在黏附蛋白的帮助下沿着突起的方向滑动,使其转移到宿主细胞表面,支原体动力学与细胞浸润能力相结合增强了支原体对宿主细胞的感染能力[46]。因此,在支原体感染宿主细胞过程中,鉴定支原体黏附宿主细胞的膜组分,以及宿主细胞识别支原体的膜受体,了解黏附因子与宿主细胞互作的分子机制,同时深入探究支原体如何逃避或破坏宿主的保护机制是今后的主要研究方向。
细胞凋亡、自噬作为维持细胞内环境稳定的基本生理过程,在抵抗胞内病原菌过程中发挥一定作用。支原体作为病原菌,可诱导宿主细胞发生凋亡、自噬,且宿主细胞可以通过凋亡、自噬方式,或通过有效的免疫反应产生IgM、IgG、IgA[47]抗体等途径缓解支原体感染早期对宿主细胞的损伤。随着支原体感染时间的延长和支原体对细胞微环境的改变,其释放的毒素,为支原体的定植和致病提供有利条件,甚至某些支原体可以利用宿主细胞自噬过程以躲避宿主的免疫清除,造成宿主细胞对支原体的抵抗能力减弱,促使支原体在宿主细胞内存活并增殖,最终导致其从细胞扩散到更深的组织和器官,难以被根除。在支原体长期感染过程中,通过炎症反应诱导各种细胞因子产生,对细胞的增生和分化发挥作用,进而为细胞肿瘤的发生提供可能[33]。目前研究已经证实一些支原体在慢性组织培养侵袭期间具有诱导核型变化和恶性转化的潜力,且通过临床检测发现在人类的一些实体瘤中存在支原体,因此支原体致癌的危害不容小觑。本课题组在研究MO诱导TC-1、RAW264.7细胞自噬的过程中,发现随着支原体感染时间的延长,细胞自噬对其的清除作用有所限制,关于MO是否可利用、修饰或干扰自噬过程,以及是否存在其他自我保护机制逃避宿主细胞的免疫清除,进而实现自身在宿主细胞内的长期感染等恶性影响,还需要更深入的研究。最新研究发现的cell-in-cell作为一种细胞程序性死亡方式,越来越多的引起人们的关注,此途径也为支原体感染情况下细胞的宿命研究提供新的方向。
临床表现的多样性及诊断工具的灵敏性限制,使得临床上支原体疾病较难治愈,因此深入研究支原体感染致病机制,才能为研发用于支原体感染的预防、诊断、控制的新型疫苗及诊断试剂,有效控制支原体感染提供保障。
参考文献(References):
[1]吴移谋, 叶元康. 支原体学[M]. 2版. 北京: 人民卫生出版社, 2008: 1.
WU Y M, YE Y K. Mycoplasmology[M]. 2nd ed. Beijing: People′s Medical Publishing House, 2008: 1. (in Chinese)
[2]TOUATI A, CAZANAVE C, BÉBÉAR C. Strain typing ofMycoplasmapneumoniaeand its value in epidemiology[J].CurrPediatrRev, 2013, 9(4): 334-342.
[3]BANSAL P, ADEGBOYE D S, ROSENBUSCH R F. Immune responses to the capsular polysaccharide ofMycoplasmadispar in calves and mice[J].CompImmunolMicrobiolInfectDis, 1995, 18(4): 259-268.
[4]刘紫玲, 游晓星, 彭志平, 等. 肺炎支原体荚膜多糖与DC-SIGN结合并促进IL-10的分泌[J]. 细胞与分子免疫学杂志, 2013, 29(1): 10-13.
LIU Z L, YOU X X, PENG Z P, et al.Mycoplasmapneumoniaecapsular polysaccharides bind to DC-SIGN and promote the secretion of IL-10[J].ChineseJournalofCellularandMolecularImmunology, 2013, 29(1): 10-13. (in Chinese)
[5]NIANG M, ROSENBUSCH R F, ANDREWS J J, et al. Demonstration of a capsule onMycoplasmaovipneumoniae[J].AmJVetRes, 1998, 59(5): 557-562.
[6]JIANG Z J, SONG F Y, LI Y N, et al. Capsular polysaccharide is a main component ofMycoplasmaovipneumoniaein the pathogen-induced Toll-like receptor-mediated inflammatory responses in sheep airway epithelial cells[J].MediatorsInflamm, 2017, 2017: 9891673.
[7]JIANG Z J, SONG F Y, LI Y N, et al. Capsular polysaccharide ofMycoplasmaovipneumoniaeinduces sheep airway epithelial cell apoptosisviaROS-dependent JNK/P38 MAPK pathways[J].OxidMedCellLongev, 2017, 2017: 6175841.
[8]王素果. 支原体脂质相关膜蛋白致病机制的研究进展[J]. 微生物学免疫学进展, 2016, 44(4): 42-47.
WANG S G. Pathogenic mechanisms onMycoplasmalipid-associated membrane proteins[J].ProgressinMicrobiologyandImmunology, 2016, 44(4): 42-47. (in Chinese)
[9]ARCHER D B. The structure and functions of theMycoplasmamembrane[J].IntRevCytol, 1981, 69: 1-44.
[10]BAI F F, NI B, LIU M J, et al.Mycoplasmahyopneumoniae-derived lipid-associated membrane proteins induce inflammation and apoptosis in porcine peripheral blood mononuclear cellsinvitro[J].VetMicrobiol, 2015, 175(1): 58-67.
[11]汪洋. 鸡毒支原体生物被膜相关基因筛选及其LAMPs诱导细胞凋亡的研究[D]. 北京:中国农业科学院, 2017.
WANG Y. Screening of biofilm-forming mutants and effect of LAMPs on apoptosis of chicken embryo fibroblast forMycoplasmagallisepticum[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese)
[12]HE J, WANG S P, ZENG Y H, et al. Binding of CD14 toMycoplasmagenitalium-derived lipid-associated membrane proteins upregulates TNF-α[J].Inflammation, 2014, 37(2): 322-330.
[13]欧广利. 核因子Nrf2负向调节肺炎支原体LAMPs诱导人THP-1细胞产生炎症物质[D]. 衡阳: 南华大学, 2015.
OU G L. Nuclear factor Nrf2 negatively regulated inflammatory substances production induced by lipid-associated membrane proteins derived fromMycoplasmapneumoniaein human monocyte cell line THP-1 cells[D]. Hengyang: University of South China, 2015. (in Chinese)
[14]WANG Y, LIU S L, LI Y, et al.Mycoplasmabovis-derived lipid-associated membrane proteins activate IL-1β production through the NF-κB pathway via Toll-like receptor 2 and MyD88[J].DevCompImmunol, 2016, 55: 111-118.
[15]WANG Y, WANG Q, LI Y, et al. Mmm-derived lipid-associated membrane proteins activate IL-1β production through the NF-κB pathway via TLR2, MyD88, and IRAK4[J].SciRep, 2017, 7(1): 4349.
[16]WELLS P G, MILLER-PINSLER L, BHATIA S, et al. Reactive Oxygen Species (ROS) formation, oxidative DNA damage and repair in teratogenesis[J].BirthDefectsResA, 2015, 103(5): 359-359.
[17]KUWANO K, HAGIMOTO N, MAEYAMA T, et al. Mitochondria-mediated apoptosis of lung epithelial cells in idiopathic interstitial pneumonias[J].LabInvest, 2002, 82(12): 1695-1706.
[18]LI Y N, JIANG Z J, XUE D, et al.Mycoplasmaovipneumoniaeinduces sheep airway epithelial cell apoptosis through an ERK signalling-mediated mitochondria pathway[J].BMCMicrobiol, 2016, 16: 222.
[19]MCCUBREY J A, LAHAIR M M, FRANKLIN R A. Reactive oxygen species-induced activation of the map kinase signaling pathways[J].AntioxidRedoxSignal, 2006, 8(9-10): 1775-1789.
[20]XUE D, LI Y N, JIANG Z J, et al. A ROS-dependent and caspase-3-mediated apoptosis in sheep bronchial epithelial cells in response toMycoplasmaovipneumoniaeinfections[J].VetImmunolImmunopathol, 2017, 187: 55-63.
[21]INOSHITA S, TAKEDA K, HATAI T, et al. Phosphorylation and inactivation of myeloid cell leukemia 1 by JNK in response to oxidative stress[J].JBiolChem, 2002, 277(46): 43730-43734.
[22]SON Y, CHEONG Y K, KIM N H, et al. Mitogen-activated protein kinases and reactive oxygen species: how can ROS activate MAPK pathways?[J].JSignalTransduct, 2011, 2011: 792639.
[23]NAKAJIMA S, KITAMURA M. Bidirectional regulation of NF-κB by reactive oxygen species: a role of unfolded protein response[J].FreeRadicBiolMed, 2013, 65: 162-174.
[24]MORGAN M J, LIU Z G. Crosstalk of reactive oxygen species and NF-κB signaling[J].CellRes, 2011, 21(1): 103-115.
[25]PAVEL M, RUBINSZTEIN D C. Mammalian autophagy and the plasma membrane[J].FEBSJ, 2017, 284(5): 672-679.
[26]SHIMIZU T. Pathogenic factors ofMycoplasma[J].NihonSaikingakuZasshi, 2015, 70(4): 369-374.
[27]LU Z Y, XUE D Y, CHEN Y, et al. TLR2 mediates autophagy through ERK signaling pathway inMycoplasmagallisepticum-infected RAW264.7 cells[J].MolImmunol, 2017, 87: 161-170.
[28]SHIMIZU T, KIMURA Y, KIDA Y, et al. Cytadherence ofMycoplasmapneumoniaeinduces inflammatory responses through autophagy and toll-like receptor 4[J].InfectImmun, 2014, 82(7): 3076-3086.
[29]SHIMIZU T. Inflammation-inducing factors ofMycoplasmapneumoniae[J].FrontMicrobiol, 2016, 7: 414.
[30]孙远航. 绵羊肺炎支原体诱导肺脏上皮细胞自噬的初步研究[D]. 银川: 宁夏大学, 2016.
SUN Y H. Preliminary study of Autophagy in lung epithelial cells induced byM.ovipneumoniaeinfection[D]. Yinchuan: Ningxia University, 2016. (in Chinese)
[31]HU X, YU J, ZHOU X, et al. Synergism between upregulation of Rab7 and inhibition of autophagic degradation caused by mycoplasma facilitates intracellularMycoplasmainfection[J].MolMedRep, 2014, 9(3): 793-800.
[32]NISHIUMI F, OGAWA M, NAKURA Y, et al. Intracellular fate ofUreaplasmaparvumentrapped by host cellular autophagy[J].Microbiologyopen, 2017, 6(3): e441.
[33]张必雄,熊祺琰,王佳,等. 猪鼻支原体表面可变脂蛋白vlpA黏附宿主细胞功能研究[J]. 畜牧兽医学报, 2016, 47(9): 1897-1904.
ZHANG B X,XIONG Q Y,WANG J,et al. The function of the variable lipoprotein A ofMycoplasmahyorhinisin adherence to host cell[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(9): 1897-1904. (in Chinese)
[34]WANG R Y H, SHIH J W K, WEISS S H, et al.Mycoplasmapenetransinfection in male homosexuals with AIDS: high seroprevalence and association with Kaposi's sarcoma[J].ClinInfectDis, 1993, 17(4): 724-729.
[35]BARYKOVA Y A, LOGUNOV D Y, SHMAROV M M, et al. Association ofMycoplasmahominisinfection with prostate cancer[J].Oncotarget, 2011, 2(4): 289-297.
[36]HRBACEK J, URBAN M, HAMSIKOVA E, et al. Serum antibodies against genitourinary infectious agents in prostate cancer and benign prostate hyperplasia patients: a case-control study[J].BMCCancer, 2011, 11: 53.
[37]刘斌波. 猪鼻支原体抗原在人结肠腺癌细胞表达的研究[D]. 南宁: 广西大学, 1999.
LIU B B. Expression ofMycoplasmahyorhinisantigens expressing in human colon adenocarcinoma cells[D]. Nanning: Guangxi University, 1999. (in Chinese)
[38]马华崇, 马泓, 张艳丽, 等. 胃癌组织中猪鼻支原体的分离培养与鉴定[J]. 中国人兽共患病杂志, 2003, 19(2): 31-33.
MA H C, MA H, ZHANG Y L, et al. Detection and confirmation ofMycoplasmahyorhinisin gastric carcinoma specimens by culture and PCR[J].ChineseJournalofZoonoses, 2003, 19(2): 31-33. (in Chinese)
[39]厉建蕾, 施嘉骏, 李泉, 等. 猪鼻支原体(Mycoplasmahyorhinis)诱导NCI-H446等小细胞肺癌细胞在FIGNL1沉默时出现S期阻滞[J]. 微生物学通报, 2017, 44(2): 411-419.
LI J L, SHI J J, LI Q, et al.Mycoplasmahyorhinisinduces S phase arrest when suppressing expression ofFIGNL1 in NCI-H446 and NCI-H1688 human small cell lung cancer cells[J].MicrobiologyChina, 2017, 44(2): 411-419. (in Chinese)
[40]TSAI S, WEAR D J, SHIH J W, et al.Mycoplasmasand oncogenesis: persistent infection and multistage malignant transformation[J].ProcNatlAcadSciUSA, 1995, 92(22): 10197-10201.
[41]JIANG S, ZHANG S M, LANGENFELD J, et al.Mycoplasmainfection transforms normal lung cells and induces bone morphogenetic protein 2 expression by post-transcriptional mechanisms[J].JCellBiochem, 2008, 104(2): 580-594.
[42]MUSHABEN E M. BMPR2 and mTOR signaling pathways in inflammatory lung diseases[D]. Cincinnati: University of Cincinnati, 2012.
[43]徐杰, 赵为民, 任守文, 等.CYP1A1与PPAR-γ在猪肺炎支原体感染炎性反应调控中的作用关系[J]. 畜牧兽医学报, 2016, 47(3): 574-580.
XU J, ZHAO W M, REN S W, et al. Interaction effect ofCYP1A1 andPPAR-γ in the regulation of inflammation of mycoplasma pneumonia in swine[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(3): 574-580. (in Chinese)
[44]RELICH R F, BALISH M F. Insights into the function ofMycoplasmapneumoniaeprotein P30 from orthologous gene replacement[J].Microbiology, 2011, 157(10): 2862-2870.
[45]MIYATA M, HAMAGUCHI T. Integrated information and prospects for gliding mechanism of the pathogenic bacteriumMycoplasmapneumoniae[J].FrontMicrobiol, 2016, 7: 960.
[46]NAKANE D, ADAN-KUBO J, KENRI T, et al. Isolation and characterization of P1 adhesin, a leg protein of the gliding bacteriumMycoplasmapneumoniae[J].JBacteriol, 2011, 193(3): 715-722.
[47]MEYER SAUTEUR P M, JACOBS B C, SPUESENS E B M, et al. Antibody responses toMycoplasmapneumoniae: role in pathogenesis and diagnosis of encephalitis?[J].PLoSPathog, 2014, 10(6): e1003983.
