FGF7亚家族在小鼠毛囊第一生长周期的表达
2018-04-04程笳琪高淑媛曹校瑞吴晋强闫瑞琴赫晓燕
牛 姝,程笳琪,高淑媛,曹校瑞,吴晋强,陆 娜,闫瑞琴,赫晓燕
(山西农业大学动物科技学院,太谷 030801)
毛囊(Hair follicle,HF)是一个高度敏感的小器官,具有重建自身的能力。在出生后的生活中,其周期变换从快速生长期(生长期)开始,通过凋亡驱动回归期(退行期)到达相对静止(静止期)[1-2]。这种周期性变化受多种因素的影响。其中,成纤维细胞生长因子(Fibroblast growth factor,FGF)家族由7个亚家族组成,相关研究表明,FGF7亚家族(包括FGF7、FGF10和FGF22)对皮肤发育和修复起重要作用[3-5]。D.Schmid等[6]研究表明,FGF7和头蛋白(Noggin)对于诱导新的毛发生长周期起到重要作用。FGF10多存在于小鼠的肺、心和皮肤真皮部分,具有促进毛发生长的生物活性,对于治疗脱发有重要作用[7]。在成年小鼠皮肤中,FGF22在毛囊的内根鞘中表达[8]。FGF22也可用作受损伤口愈合和其他上皮中可能出现的损伤的治疗工具,对皮肤发育和修复起重要作用[9]。而在小鼠第一个毛囊生长周期中,FGF7亚家族对其作用的研究未见报道。根据前人对于小鼠毛囊周期结构的研究,结合本试验小鼠出生后毛囊的生长情况,确定毛囊第一个生长周期的划分大致为第1~11天为生长期,第12~17天为退化期,第18~19天为静止期,第20天毛囊开始进入下一个生长周期。本研究利用实时荧光定量PCR技术、免疫组织化学技术和Western blot技术,对FGF7/FGF10/FGF22在小鼠第一生长周期不同阶段皮肤组织中的表达进行研究,观察FGF7/FGF10/FGF22在小鼠第一个毛囊生长周期不同阶段的差异表达,以了解FGF7/FGF10/FGF22对小鼠第一个毛囊生长周期的作用,为揭示FGF7亚家族对小鼠毛发生长调节机制奠定理论基础。
1 材料与方法
1.1 试验动物
出生后第1、3、5、8、16、18、20、23 天的白色ICR(Institute of Cancer Researcch)小鼠,每天各取3只,每只背部取约2 cm2的皮肤组织块2份。1份液氮保存;1份浸蜡固定包埋。
1.2 主要仪器与试剂
FGF7兔抗多克隆抗体(Thermo公司);FGF10兔抗多克隆抗体(Santa Cruz Biotechnology,Inc);FGF22兔抗多克隆抗体(Novus Biologicals公司);兔Streptavidin-HRP DAB试剂盒和高灵敏度化学发光检测试剂盒(康为世纪公司);凝胶配制试剂盒和RIPA裂解液(强)(碧云天公司);SYBR Premix Ex Taq Ⅱ和PrimeSciptTMRT-PCR Kit(TaKaRa公司)。
1.3 方法
1.3.1免疫组织化学按照兔Streptavidin-HRP试剂盒(DAB)说明书进行试验。将组织切片于高浓度至低浓度的梯度酒精中复水,滴加试剂Ⅰ(H2O2内源性过氧化物酶封闭液)于37 ℃烘箱内10 min,PBS冲洗。滴加试剂Ⅱ(正常山羊血清)封闭,37 ℃静置10 min。弃掉血清,切片上一组滴加1∶60稀释的兔抗FGF7多克隆抗体(1∶45稀释的兔抗FGF10多克隆抗体;1∶50稀释的兔抗FGF22多克隆抗体),对照组滴加等量的血清封闭液,37 ℃烘箱30 min后,置于冰箱4 ℃过夜,第2天室温复温30 min,PBS冲洗,滴加试剂Ⅲ(生物素标记羊抗兔二抗工作液),37 ℃放置10 min。PBS冲洗,滴加试剂Ⅳ(HRP标记的链霉亲和素),PBS冲洗;滴加DAB显色液,观察显色效果适当调整时间(最多不超过5 min),蒸馏水冲洗,苏木精复染1 min,蒸馏水冲洗,再经低浓度至高浓度酒精脱水二甲苯透明,中性树胶封片。利用Leica光学显微镜观察切片,并采集图片。每一个样本选择3张片子,每个片子上选取至少3个以上视野进行拍照。并且应用图像分析软件Image-Proplus 6.0对出生前后小鼠切片中FGF7、FGF10和FGF22的阳性反应物进行光密度测定,并进行数据分析。
1.3.2Western blot检测根据RIPA裂解液(强)说明书提取总蛋白,每孔蛋白上样量为400 ng,在12% SDS-PAGE进行电泳分离,电泳完120 V 1 h转至NC膜,5%的脱脂蛋白干粉封闭1 h,4 ℃过夜孵育一抗(1∶800稀释的兔抗FGF7多克隆抗体;1∶500稀释的兔抗FGF10多克隆抗体;1∶700稀释的兔抗FGF22多克隆抗体)。次日室温复温30 min,TBST缓冲液冲洗10 min×3,孵育二抗(1∶12 000,HRP-山羊抗兔IgG,康为世纪公司;1∶12 000,HRP-山羊抗鼠IgG,康为世纪公司),37 ℃摇床1 h,TBST缓冲液 5 min×4,最后,NC膜涂发光液利用凝胶成像系统进行曝光,并在暗室中压胶片。使用Image J软件对FGF7、FGF10、FGF22和内参β-actin蛋白的结果图进行灰度值测定。
1.3.3实时荧光定量PCR(RT-PCR)检测根据NCBI中登录的小鼠(Musmusculus)FGF7(序列号:NM_008008.4)、FGF10 (序列号:NM_008002.4)和FGF22(序列号:NM_023304.1)与β-actin(序列号:NM_007393.5)基因的序列,运用Primer5.0进行特异性引物设计,并送华大基因公司合成。引物序列见表1。
表1目的基因与内参β-actin引物序列
Table1Primersequencesoftargetgenesandβ-actin

基因Gene引物序列(5'-3')Primersequence产物大小/bpProductssize退火温度/℃AnnealtemperatureFGF7F:ATGCTTCCACCTCGTCTGTR:ATCTCCTGGGTCCCTTTCA22258FGF10F:TGGTGTCTTCGTTCCCTGTR:GCTGACCTTGCCGTTCTT21858FGF22F:TGGGTTGCGGGTCTACTCTR:TCGTGTCCGTCTGCCTTGC15762β-actinF:GCTGTCCCTGTATGCCTCTR:GATGTCACGCACGATTTCC22258~62
取液氮罐中的组织按照 Trizol试剂盒说明书提取不同天数小鼠皮肤组织的总RNA。1%琼脂糖凝胶电泳检测,并回收目的片段DNA,送华大基因公司测序。按照试剂盒说明书反转录合成cDNA,并调整浓度为100 ng·μL-1。每个样本进行3次有效重复。反应体系:SYBR Premix Ex Taq II(Tli RNaseH Plus)(2×)5 μL,ROX Reference Dye(50×)0.2 μL,FGF7/FGF10/FGF22/β-actin正反向引物各0.4 μL,cDNA模板1 μL,dH2O(灭菌蒸馏水)3 μL。FGF7和FGF10反应条件:95 ℃预变性10 min;94 ℃变性5 s,58 ℃退火30 s,72 ℃延伸20 s,40个循环;FGF22反应条件:95 ℃预变性10 min;94 ℃变性5 s,62 ℃退火30 s,72 ℃延伸20 s,40个循环。扩增结束得到CT值,利用2-ΔΔCT法计算目的基因相对表达水平,各基因差异倍数以2-ΔΔCT表示。
1.4 数据分析
免疫组化光密度值结果用“平均值±标准差(mean±SE)”表示,免疫组化光密度值、Western blot和RT-PCR统计结果利用SPSS17.0统计分析软件对数据进行单因素方差分析,各基因蛋白表达差异显著程度均以最低表达天数为对照。其中,*P<0.05表示差异显著,**P<0.01表示差异极显著。
2 结 果
2.1 FGF7、FGF10和FGF22蛋白在出生后小鼠皮肤组织中的定位
免疫组织化学结果显示,在毛囊第一生长周期,FGF7主要表达于毛囊内根鞘及表皮(图1)。第1天主要表达于表皮;第3、5、8、16和18天主要表达于内根鞘和表皮;第20 天表达较为广泛,在内外根鞘及毛囊间真皮成纤维细胞等均有表达;第23天主要在内根鞘和表皮有阳性反应。FGF10在出生后毛囊的表达较为广泛,在表皮、皮脂腺等均有阳性反应(图2)。第1天主要表达于表皮,第3 天开始在毛囊各结构广泛表达,第18天皮脂腺处阳性反应较强。FGF22在毛囊第一生长周期中表达较为广泛,毛基质、内根鞘及外根鞘等均有阳性反应,但在不同阶段,其表达的强弱不同(图3)。光密度数据分析结果显示,FGF7、FGF10和FGF22蛋白在不同阶段组织中的表达水平均存在显著差异,其中FGF7在第5天表达量最高,第16天降至最低,伴随静止期的开始,FGF7在毛囊中的表达量逐渐升高。第1、3、5、8、18、20、23天的表达量极显著高于第16 天(P<0.01),其表达量分别是第16 天的1.250倍、1.470倍、1.636倍、1.142倍、1.102倍、1.335倍和1.616倍(表2,图4A′)。FGF10与FGF7趋势相似,在第3天表达量达到最高,第8天表达量降至最低,退化期~第二生长期的相对表达量逐渐增高。第1、3、5、16、18、20、23天的表达量极显著高于第8天(P<0.01),其表达量分别是第8天的1.302倍、1.975倍、1.244倍、1.218倍、1.300 倍、1.350倍和 1.680倍(表2,图4B′)。FGF22在第16天表达量达到最高,之后随着时间增加表达量逐渐降低。第1、3天的表达量显著高于第23天(P<0.05),第5、8、16、18、20天的表达量极显著高于第23 天(P<0.01)。第1、3、5、8、16、18、20 天分别是第23天的1.093倍、1.147倍、1.235倍、1.336 倍、1.712倍、1.506倍和 1.358倍(表2,图4C′)。

A~H.不同天数小鼠背部皮肤毛囊的阴性反应;a~h.不同天数小鼠背部毛囊的阳性反应。A和a.1 d;B和b.3 d;C和c.5 d;D和d.8 d;E和e.16 d;F和f.18 d;G和g.20 d;H和h.23 d。1.毛乳头;2.毛基质;3.内根鞘;4.外根鞘;5.表皮;6.皮脂腺。下同A-H.Hair follicle negative reaction of different days in mice back skin; a-h.Hair follicle positive reaction of different days in mice back skin. A and a.1 d; B and b.3 d; C and c.5 d; D and d.8 d; E and e.16 d; F and f.18 d; G and g.20 d; H and h.23 d. 1.Dermal papilla; 2.Hair matrix; 3.Inner root sheath; 4.Outer root sheath; 5.Epidermis; 6.Sebaceous glands.The same as below图1 FGF7蛋白在小鼠毛囊第一生长周期皮肤的定位(20×)Fig.1 Location of FGF7 protein in mice skin in the first hair follicle cycle(20×)
图2 FGF10蛋白在小鼠毛囊第一生长周期皮肤的定位(20×)Fig.2 Location of FGF10 protein in mice skin in the first hair follicle cycle(20×)
表2阳性表达的平均光密度
Table2Averageopticaidensityofpositivecellsinpostnatalmiceskin

项目Item1d3d5d8d16d18d20d23dFGF70.2039±0.005**0.2398±0.001**0.2669±0.003**0.1863±0.003**0.1631±0.00020.1798±0.0001**0.2179±0.010**0.2637±0.006**FGF100.2236±9.615E-06**0.3391±0.005**0.2136±0.001**0.1717±0.0010.2091±0.001**0.2229±0.009**0.2319±0.002**0.2885±0.002**FGF220.2504±0.002*0.2626±0.012*0.2829±0.004**0.3060±0.006**0.3939±0.007**0.3450±0.003**0.3111±0.005**0.2290±0.009
*.P<0.05;**.P<0.01。下同
*.P<0.05;**.P<0.01.The same as below

图3 FGF22蛋白在小鼠毛囊第一生长周期皮肤的定位(20×)Fig.3 Location of FGF22 protein in mice skin in the first hair follicle cycle(20×)

A.生长期;C.退行期;T.静止期。下同A.Anagen.C.Catagen,T.Telogen.The same as below图4 FGF7(A′)、FGF10(B′)和FGF22(C′)蛋白在小鼠皮肤的平均光密度分析Fig.4 Average optical density analysis of FGF7(A′), FGF10(B′) and FGF22(C′) protein in mice skin
2.2 FGF7、FGF10和FGF22蛋白在小鼠皮肤组织中的表达
Western blot结果显示,在小鼠毛囊第一生长周期中均存在与FGF7、FGF10、FGF22多克隆抗体发生阳性反应的条带,FGF7大小为27 ku,FGF10大小为23 ku,FGF22大小为21 ku(图5)。通过分析得出,FGF7蛋白在第16天表达量最低,伴随静止期的开始,表达量逐渐升高。第1、3、5、18、20、23天的表达量极显著高于第16天(P<0.01),第8 天的表达量显著高于第16天(P<0.05)。第1、3、5、8、18、20、23 天分别是第16天的1.643倍、2.045倍、1.523倍、1.407倍、1.739倍、1.974倍、2.035倍(图6A′)。FGF10蛋白在第8天表达量最低,第1、3、5、16、18、20、23天的表达量极显著高于第8天(P<
0.01),其表达量分别是第8 天的1.390倍、2.632倍、1.403倍、1.374倍、2.468倍、2.755倍、3.101倍(图6B′)。FGF22在第16天的相对表达量达到最高,其后随着毛囊萎缩进入静止期表达量逐渐降低。第3、5、8、16、18、20、23天的表达量极显著高于第1 天(P<0.01),且表达量是第1天的1.601倍、1.870倍、2.198倍、2.474倍、2.378倍、1.878倍、1.533倍(图6C′)。

图5 FGF7、FGF10和FGF22蛋白在小鼠皮肤的蛋白印迹Fig.5 Western blot band of FGF7,FGF10 and FGF22 protein in mice skin

图6 FGF7(A′)、FGF10(B′)和FGF22(C′)蛋白在小鼠皮肤的相对表达量Fig.6 Relatire expression of FGF7(A′),FGF10(B′) and FGF22(C′) proteins in mice skin
2.3 FGF7、FGF10和FGF22基因在小鼠皮肤组织中的表达
RT-PCR结果显示,在小鼠毛囊第一生长周期中,FGF7在第16天的表达量最低,伴随静止期的开始,FGF7在毛囊中的表达量逐渐升高,第1、3、5、8、20、23 天极显著高于第16天(P<0.01),第18 天显著高于第16天(P<0.05)。第1、3、5、8、18、20、23 天的表达量分别是第16天的1.819倍、3.703倍、3.551倍、1.347倍、1.165倍、2.287倍和2.502倍(图7A′)。FGF10在第3天表达量达到最高,在第8天表达量降至最低,退化期开始表达量逐渐增高。第1、3、5、16、18、20和23天的表达量极显著高于第8 天(P<0.01),第16天显著高于第8天(P<0.05)。第1、3、5、16、18、20和23天分别是第8 天的2.640倍、4.686倍、2.095倍、1.135倍、1.327倍、1.532倍和2.278倍(图7B′)。FGF22在第16天的表达量达到最高,其后随着毛囊萎缩进入静止期表达量逐渐降低。第1、3、5、8、16、18和20天的表达量极显著高于第23天(P<0.01),且表达量分别是第23 天的2.037倍、14.530倍、21.523倍、31.649倍、40.176倍、31.741倍和26.153倍(图7C′)。
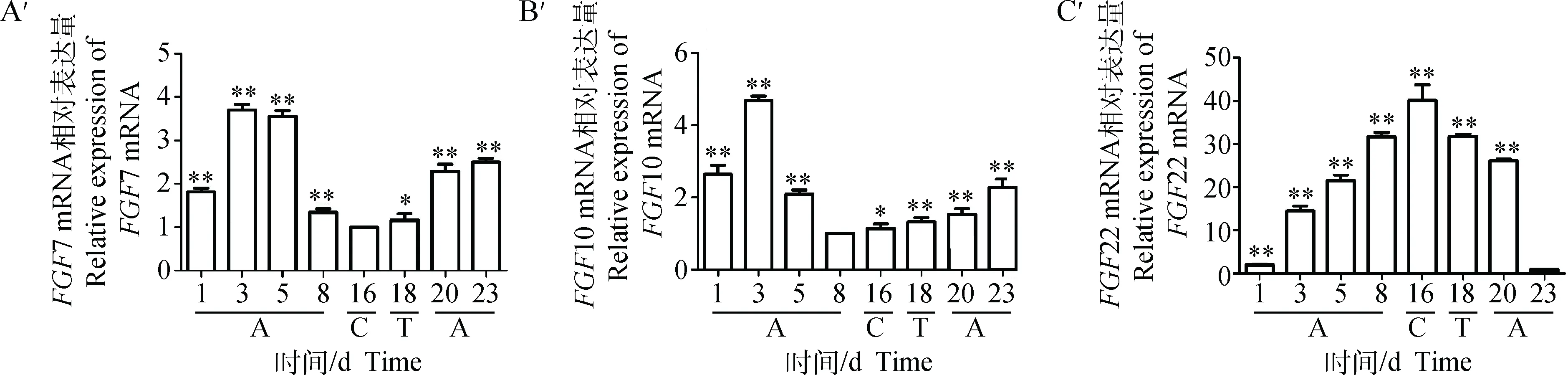
图7 FGF7(A′)、FGF10(B′)和FGF22(C′) mRNA在小鼠皮肤的相对表达量Fig.7 Relative expression of FGF7(A′),FGF10(B′) and FGF22(C′) mRNA in mice skin
3 讨 论
毛囊是一种通过组织生长和重塑循环产生毛发的动态结构。毛囊发育主要经历生长期(Anagen)、退行期(Catagen)和静止期(Telogen)3个时期[1-2]。在生长期,毛乳头从真皮生长到皮下组织,毛母质细胞末梢产生角质形成细胞分化层并形成毛囊内根鞘和毛干,毛囊长度逐渐达到最大,且毛囊各结构清晰可见易于识别。随着毛基质细胞的供给下降,毛囊进入退行期,毛囊及整体皮肤厚度均在缩减,当毛乳头逐渐变为紧凑的球形,毛囊进入静止期,此时毛囊不显示内根鞘结构并完全由毛囊间真皮成纤维细胞包围。毛囊的周期变化发育受到各种生长因子的影响。
FGF7是由上皮组织中的间充质细胞(例如成纤维细胞/纤维细胞)合成和分泌的,具有163个氨基酸编码的糖蛋白,同时FGF7作为上皮细胞增殖的旁分泌介质,并具有刺激上皮细胞的迁移、扩散和增殖的作用[10-12]。已有研究显示,FGF7是负责指导毛胚细胞增殖并诱导新毛发生长周期的毛乳头信号[6]。据程毅[13]研究可知,毛乳头启动新的毛囊周期。在真表皮相互作用中, 真皮成分起主导作用,但表皮成分可反作用于间质, 例如角质形成细胞可产生一种特异因子刺激体内的毛乳头细胞生长[14]。M.V.Plikus[15]发现诱导新毛发周期开始需要多种信号通路共同调节。在静止期前激活态的FGF7信号(由FGFR2 IIIb受体介导)表达量较低,在静止期时,开始激活更多的FGF7信号。本研究免疫组化结果表明,FGF7小鼠第一生长周期中主要在毛囊内根鞘及表皮表达。可能是因为FGF7对于角质形成细胞增殖、存活、分化有重要作用。本研究的免疫组化光密度值、实时荧光定量PCR及Western blot结果均显示FGF7在静止期和第二生长期的相对表达量显著高于生长期和退行期,结果与M.V.Plikus[15]一致。此研究结果提示,FGF7可能对小鼠毛囊生长早期发育与诱导毛囊进入新的循环周期有重要作用。
FGF10又可称为角质形成细胞生长因子-2(KGF-2),以旁分泌方式介导间充质与上皮信号传导,在多个器官中发挥重要的作用[16-17]。K.Suzuki等[18]研究发现,在缺乏FGF10的新生小鼠皮肤组织中基底层的增殖细胞数目在减少,颗粒层发育不全,缺乏独特的透明角质颗粒和张力原纤维,缺乏FGF10,表现为表皮形态异常。M.Igarashi等[19]研究表明,FGF10长期在人皮肤的真皮乳头细胞、外根鞘细胞和表皮角质形成细胞表达。J.H.Jang[20]研究发现,在大肠杆菌中表达的rhKGF-2具有促进人毛发生长的生物活性,提示rhKGF-2对毛发生长有刺激作用。本研究免疫组化结果显示,FGF10在小鼠皮肤中表达较为广泛,表皮、皮脂腺等均有阳性反应,与M.Igarashi等[19]结论一致。出生后1 d,只在表皮表达,可能是因为FGF10刺激上皮细胞增殖,从而为毛母质细胞的增殖分化提供基础。免疫组化光密度、实时荧光定量与Western blot结果均表现为毛囊生长期初中期与静止期~第二生长期初期的相对表达量高于生长末期和退化期。在生长期末期FGF10的表达减弱,可能由于内外根鞘的分化及真皮乳头逐渐减少消失,导致表达量降低,与前人研究结果一致。此研究结果提示,FGF10可能对于诱导毛囊进入新的循环周期同样起重要作用。
FGF22是与FGF7和FGF10密切相关的FGF7亚家族的另一成员,参与表皮内稳态。除了FGF7和FGF10,FGF22也可用作治疗受损伤口愈合的工具,且用于其他上皮中可能存在的损伤的治疗。C.L.Li等[21]研究FGF22在发育过程中的表达谱,表明FGF22在毛囊形态发生中具有潜在的作用。免疫组化结果显示,在小鼠皮肤中,FGF22在各天数毛囊中存在不同程度的广泛表达,外根鞘、表皮及皮脂腺等均有表达。免疫组化光密度值、实时荧光定量PCR及Western blot检测均显示,FGF22在毛囊生长期后期及退化期前期的相对表达量最高,其后随着毛囊萎缩进入静止期逐渐降低。提示FGF22对于诱导毛囊进入退化可能有重要影响。
T.A.Beyer等[22]研究表明,FGF22蛋白质与FGF7和FGF10相反,缺乏大多数分泌型FGF应有的特征,即N-糖基化的共有序列。同时Y.Katoh等[23]通过比对哺乳动物的FGF7启动子、FGF10启动子和FGF22启动子,发现具有bHLH结合位点和CCAAT盒的FGF7启动子与具有双bHLH结合位点的FGF10启动子较为保守,而FGF22启动子则不同,表明FGF22与FGF7、FGF10之间有较大差异。结合本研究结果可知,FGF7、FGF10在小鼠出生后毛囊生长期表达量大,在毛囊退化期表达量逐渐减少,在静止期~第二生长期表达量则逐渐增加,而FGF22则主要在毛囊生长期末期~退化期早期高表达,在静止期表达逐渐降低。提示FGF7、FGF10在毛囊发育过程中可能对小鼠毛囊生长早期发育与诱导毛囊进入新的循环周期有重要作用,而FGF22则可能对诱导毛囊进入退化期有重要影响。
4 结 论
本研究结果表明,在小鼠第一生长周期过程中,FGF7主要表达于毛囊内根鞘及表皮,FGF10和FGF22广泛表达于毛囊各部。RT-PCR、Western blot和免疫组化光密度统计结果表明,FGF7在毛囊退化期表达量最低,在静止期、生长期高表达;FGF10在毛囊生长期末期逐渐降低,退化期开始逐渐升高;FGF22在毛囊退化期表达量最高,在静止期、生长期低表达。提示FGF7、FGF10在毛囊第一生长周期可能对诱导毛囊进入新的循环周期有重要作用,而FGF22则可能对诱导毛囊进入退化期有重要影响。
参考文献(References):
[1]MÜLLER-RÖVER S, FOITZIK K, PAUS R,et al. A comprehensive guide for the accurateclassification of murine hair follicles in distinct hair cycle stages[J].JInvestDermatol, 2001, 117(1): 3-15.
[2]BERNARD B A. The hair follicle enigma[J].ExpDermatol, 2017, 26(6): 472-477.
[3]BEENKEN A, MOHAMMADI M. The FGF family: Biology, pathophysiology and therapy[J].NatRevDrugDiscov, 2009, 8(3): 235-253.
[4]ITOH N, ORNITZ D M. Functional evolutionary history of the mouseFGFgene family[J].DevDyn, 2008, 237(1): 18-27.
[5]程笳琪, 于秀菊, 高淑媛, 等. FGF家族对鼠类毛发生长作用的研究[J]. 黑龙江畜牧兽医, 2016(17): 215-217.
CHENG J Q, YU X J, GAO S Y, et al. Study on the effects of fibroblast growth factor(FGF)family on the hair growth in mice[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2016(17): 215-217. (in Chinese)
[6]SCHMID D, BELSER E, ZÜLLI F.Stimulation of hair growth by enhancing the expression of FGF7 and noggin genes[M]. Switzerland:Mibelle Group Biochemistry,2014.
[7]ITOH N. FGF10: A multifunctional mesenchymal―epithelial signaling growth factor in development, health, and disease[J].CytokineGrowthFactorRev, 2016, 28: 63-69.
[8]JAROSZ M, ROBBEZ-MASSON L, CHIONI A M, et al. Fibroblast growth factor 22 is not essential for skin development and repair but plays a role in tumorigenesis[J].PLoSOne, 2012, 7(6): e39436.
[9]NUNES Q M, LI Y, SUN C, et al. Fibroblast growth factors as tissue repair and regeneration therapeutics[J].PeerJ, 2016, 4: e1535.
[10]BASSUK J A, COCHRANE K, MITCHELL M E. Induction of urothelial cell proliferation by fibroblast growth factor-7 in RAG1-deficient mice[M]//ATALA A, SLADE D.Bladder Disease, Part A.Boston, MA:Springer, 2003: 623-633.
[11]WERNER S. Keratinocyte growth factor: A unique player in epithelial repair processes[J].CytokineGrowthFactorRev, 1998, 9(2): 153-165.
[12]SCHMID D, BELSER E, ZÜLLI F. The FGF7 and noggin genes are key targets to treat hair loss[J].SOFWJ, 2013, 139: 18-22.
[13]程毅. IGF-1、FGF7与毛乳头细胞生物学特性的相关性及复方甘草酸苷、地塞米松对毛乳头细胞活性影响的研究[D]. 石家庄: 河北医科大学, 2010.
CHENG Y. The correlation between IGF-l, FGF7 and biological characteristics of dermal papilla cells and the effects of SNMC and dexameth on the activity of dermal papilla cells[D]. Shijiazhuang: Hebei Medical University,2010. (in Chinese)
[14]张国强, 程毅, 李玲, 等. 胰岛素样生长因子1和成纤维细胞生长因子7与毛乳头细胞的生长[J]. 中国组织工程研究, 2010, 14(50): 9346-9349.
ZHANG G Q, CHENG Y, LI L, et al. Effects of insulin-like growth factor-1 and fibroblast growth factor-7 on growth of dermal papilla cells[J].JournalofClinicalRehabilitativeTissueEngineeringResearch, 2010, 14(50): 9346-9349. (in Chinese)
[15]PLIKUS M V. New activators and inhibitors in the hair cycle clock: Targeting stem cells’ state of competence[J].JInvestDermatol, 2012, 132(5): 1321-1324.
[16]YAMASAKI M, MIYAKE A, TAGASHIRA S,et al. Structure and expression of the rat mRNA encoding a novel member of the fibroblast growth factor family[J].JBiolChem, 1996, 271(27): 15918-15921.
[17]柳楠,刘鲁梅,程明, 等. 敖汉细毛羊毛囊FGF10、FGF18和FGFR3基因差异表达的研究[J].畜牧兽医学报, 2015, 46(3): 362-372.
LIU N, LIU L M, CHENG M, et al. Study onFGF10,FGF18 andFGFR3 differential expression in hair follicle of Aohan fine-wool sheep[J].ActaVeterinariaetZootechnicaSinica, 2015, 46(3): 362-372. (in Chinese)
[18]SUZUKI K, YAMANISHI K, MORI O, et al. Defective terminal differentiation and hypoplasia of the epidermis in mice lacking theFGF10 gene[J].FEBSLett, 2000, 481(1): 53-56.
[19]IGARASHI M, FINCH P W, AARONSON S A. Characterization of recombinant human fibroblast growth factor (FGF)-10 reveals functional similarities with keratinocyte growth factor (FGF-7)[J].JBiolChem, 1998, 273(21): 13230-13235.
[20]JANG J H. Stimulation of human hair growth by the recombinant human keratinocyte growth factor-2(KGF-2)[J].BiotechnolLett, 2005, 27(11): 749-752.
[21]LI C L, GUO H M, XU X L, et al. Fibroblast growth factor receptor 2 (Fgfr2) plays an important role in eyelid and skin formation and patterning[J].DevDyn, 2001, 222(3): 471-483.
[22]BEYER T A, WERNER S, DICKSON C, et al. Fibroblast growth factor 22 and its potential role during skin development and repair[J].ExpCellRes, 2003, 287(2): 228-236.
[23]KATOH Y, KATOH M.Comparative genomics on FGF7, FGF10, FGF22 orthologs, and identification of FGF25[J].IntJMolMed, 2005, 16(4): 767-770.
