氧化锆表面紫外线处理对成骨细胞生物学行为的影响
2018-04-02侯小青侯玉东孙鑫孙龙
侯小青 侯玉东 孙鑫 孙龙
随着种植体材料的创新与美观要求的提高,以及最常用钛及钛合金种植体存在的先天缺陷,如在前牙区唇侧骨量较少的患者会透出灰色的颜色影响美观,以及钛粒子释放、菌斑聚集较多等不足[1-2],并且在头颈部进行磁共振检查时,钛种植体可形成局部透射伪影造成局部影像不清晰[3];口腔全瓷种植体强度高、韧性高、具有牙齿颜色的氧化锆材料成为制作口腔种植体的备选材料[4]。紫外线表面处理技术不需要附加或增加化学的方法改变种植体的表面形貌,是一种相对简单干净的技术,具有良好运用前景; 研究表明[5],紫外线照射钛表面可使其产生超亲水性表面、使表面能增大、接触角变小、有利于骨结合、增加种植体成功率。喷砂技术是表面粗糙的常用方法之一,同样具有成本低、加工方法简单、不需高温条件等特点。本实验通过紫外线照射不同粗糙度的氧化锆表面,观察其对MC3T3-E1生物学行为的影响,为促进氧化锆种植体早期骨结合提供理论参考。
1 材料与方法
1.1 材料
1.1.1细胞小鼠胚胎成骨细胞前体细胞 MC3T3-E1(中科院上海细胞库)。
1.1.2主要试剂及仪器氧化锆片(直径12 mm,厚度3 mm,成都海利华生物科技有限公司); α-MEM培养基、 胎牛血清(Hyclone,美国); MTT(北京索莱宝科技有限公司); 碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(南京建成生物工程研究所);茜素红(上海源叶生物科技有限公司);酶标定量测试仪(Multiskan MS-352,雷勃, 芬兰);总RNA抽提试剂(Trizol)(Invitrogen,美国); 反转录反应试剂盒、 实时定量荧光PCR试剂盒(SYBR Primix Ex TaqTM,Takara,日本);荧光实时定量PCR仪(Rotor Gene 3000,Corbett,澳大利亚)。
1.2 实验方法
1.2.1细胞培养将MC3T3-E1培养于含10% FBS的α-MEM培养基中,放置于37 ℃含5%的CO2培养箱中培养,3 d/次换液,细胞长至80%左右时,用0.25%的胰蛋白酶消化传代种板。
1.2.2氧化锆试件处理将氧化锆片机械打磨后喷砂处理,各取一半用15 W UVC灭菌灯距离试件表面2 cm照射48 h,灭菌灯波长(250±20) nm。所有试件用75%酒精和蒸馏水清洗后,利用超声清洗30 min后自然烘干备用。
1.2.3实验分组实验分4 组(n=3),光滑对照组(S组)、光滑处理组(S-UV组)、粗糙对照组(R组)和粗糙处理组(R-UV组),将4 组氧化锆片置于含10%FBS的α-MEM培养基的24 孔板内,将MC3T3-E1接种于板内培养。
1.2.4MTT法检测成骨细胞在氧化锆表面的增殖取细胞计数约3×104个/ml细胞悬液接种至含4 组氧化锆片的24 孔板内,每组设3 个复孔, 3 d换液1 次,于37 ℃ 5% CO2细胞培养箱中培养3、 5 d取出,吸去培养液,PBS轻柔清洗3 次,每孔加200 μl 5 mg/ml的MTT、 800 μl α-MEM, 37 ℃孵育4 h后小心吸去上清液,每孔加入1 ml DMSO生成紫色结晶物,放置于摇床10 min,每孔分别取3 份200 μl溶解液至96 孔板,空白孔调零,测定490 nm波长各孔的吸光度值。
1.2.5ALP活性测定取细胞计数约3×104个/ml细胞悬液接种至含四组氧化锆片的24 孔板内,每组设3 个复孔,待细胞贴壁后换成骨诱导液,3 d换液1 次。 培养3、 7 d后,吸去培养液,PBS轻柔清洗3 次,每孔加入1 ml裂解液(0.5% Triton X-100)反复吹打,置37 ℃过液,按试剂盒上的说明操作,测定405 nm波长每孔的吸光度值。
1.2.6茜素红染色定量测定钙结节形成细胞按上述方法培养,培养21 d后吸去培养液,用PBS轻柔清洗3 次,每孔加95%的乙醇溶液固定10 min,去离子水漂洗2 次,接着用40 mmol/L茜素红溶液(用氨水调至pH4.2)在37 ℃下染色10 min,用去离子水漂洗3 次,晾干,在倒置相差显微镜下观察和摄片。加入10%氯化十六烷基吡啶,室温放置30 min,将AR析出,从每孔取出100 μl溶液加入96 孔板,测定562 nm波长每孔的吸光度值。
1.2.7RT-PCR检测成骨细胞成骨相关蛋白骨钙素(OCN)、护骨素(OPG)mRNA的表达细胞按上述方法处理,培养7、 14 d后吸去培养液,PBS清洗3 次,用Triton提取总RNA,按反转录试剂盒上的实验步骤合成cDNA。引物由上海生工生物工程公司合成。实时定量PCR反应体系采用Takara公司SYBR Premix Ex TaqTM20 μl体系。将各时间点光滑对照组的基因表达量定义为1,计算每组的相对表达量。
1.3 统计学分析
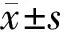
2 结 果
2.1 成骨细胞在氧化锆表面增殖情况
数据显示,实验组与对照组的MC3T3-E1细胞随时间变化,均呈上升趋势。 3 d时粗糙组细胞增殖高于光滑组,在5 d时粗糙处理组细胞的增殖数量明显大于其它各组(P<0.05, 图 1),光滑处理组与粗糙对照组无明显差异。
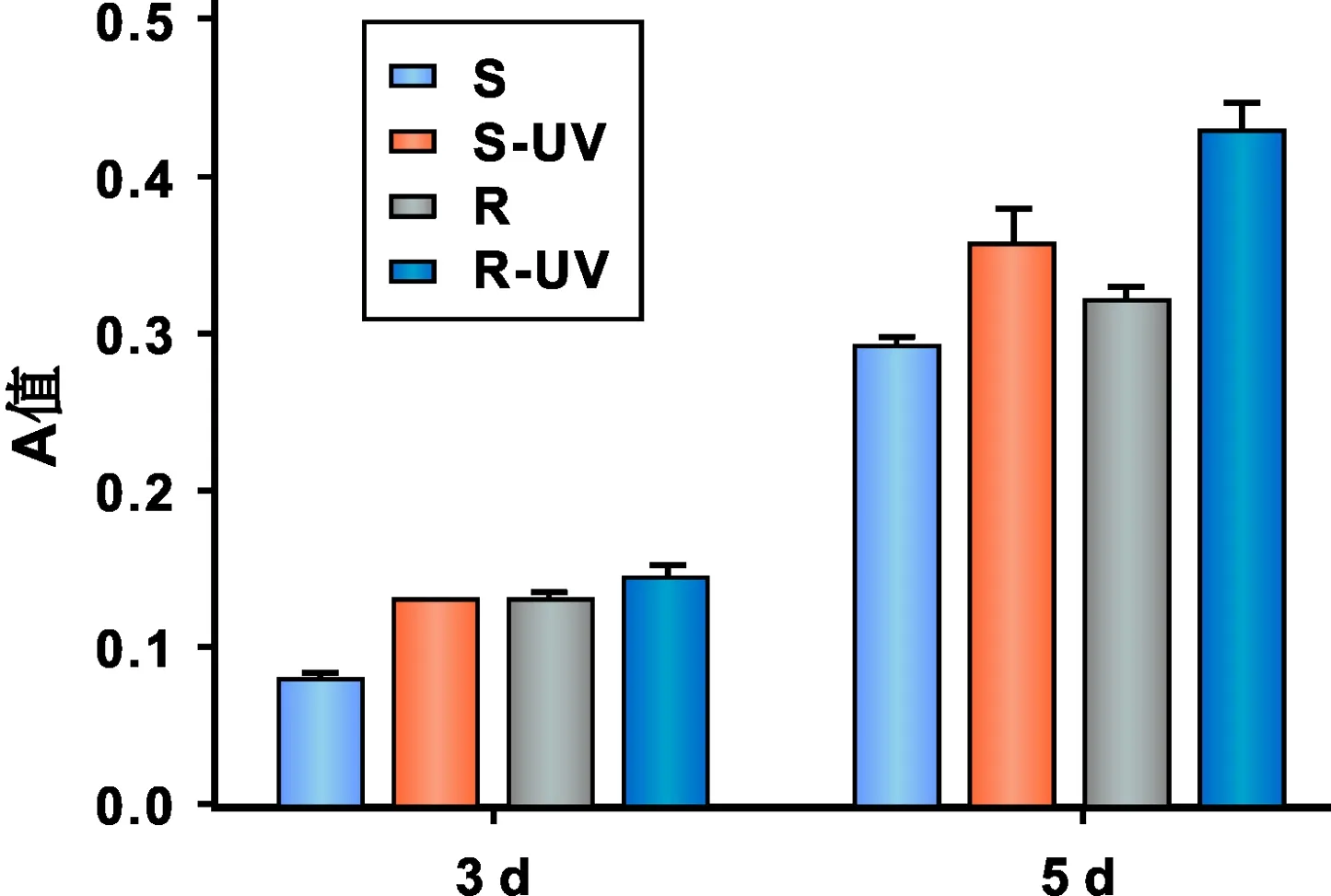
图 1MC3T3-E1细胞的增殖情况
Fig 1Proliferation of MC3T3-E1 cells
2.2 ALP活性测定情况
随着时间增长,对照组与处理组ALP活性均为升高趋势(图 2)。 在7 d时粗糙处理组ALP活性均高于光滑组(P<0.05),粗糙组间活性无明显差异。
2.3 茜素红染色测定钙结节形成情况
在21 d时处理组钙结节吸光度值高于对照组,粗糙组稍高于光滑组;粗糙处理组与对照组差异更为明显(P<0.05, 图 3)。
2.4 不同处理方法对成骨细胞OCN、OPG mRNA表达的影响
实验组OPG、OCN mRNA的表达均随时间上调明显(P<0.05)。 第7 天时, 处理组OPG、OCN mRNA的表达高于对照组,粗糙组表达高于光滑组; 第14 天, 2 组基因的表达差异更为明显,粗糙处理表达量明显高于其它各组(P<0.05), 光滑处理组与粗糙对照组无明显差异。
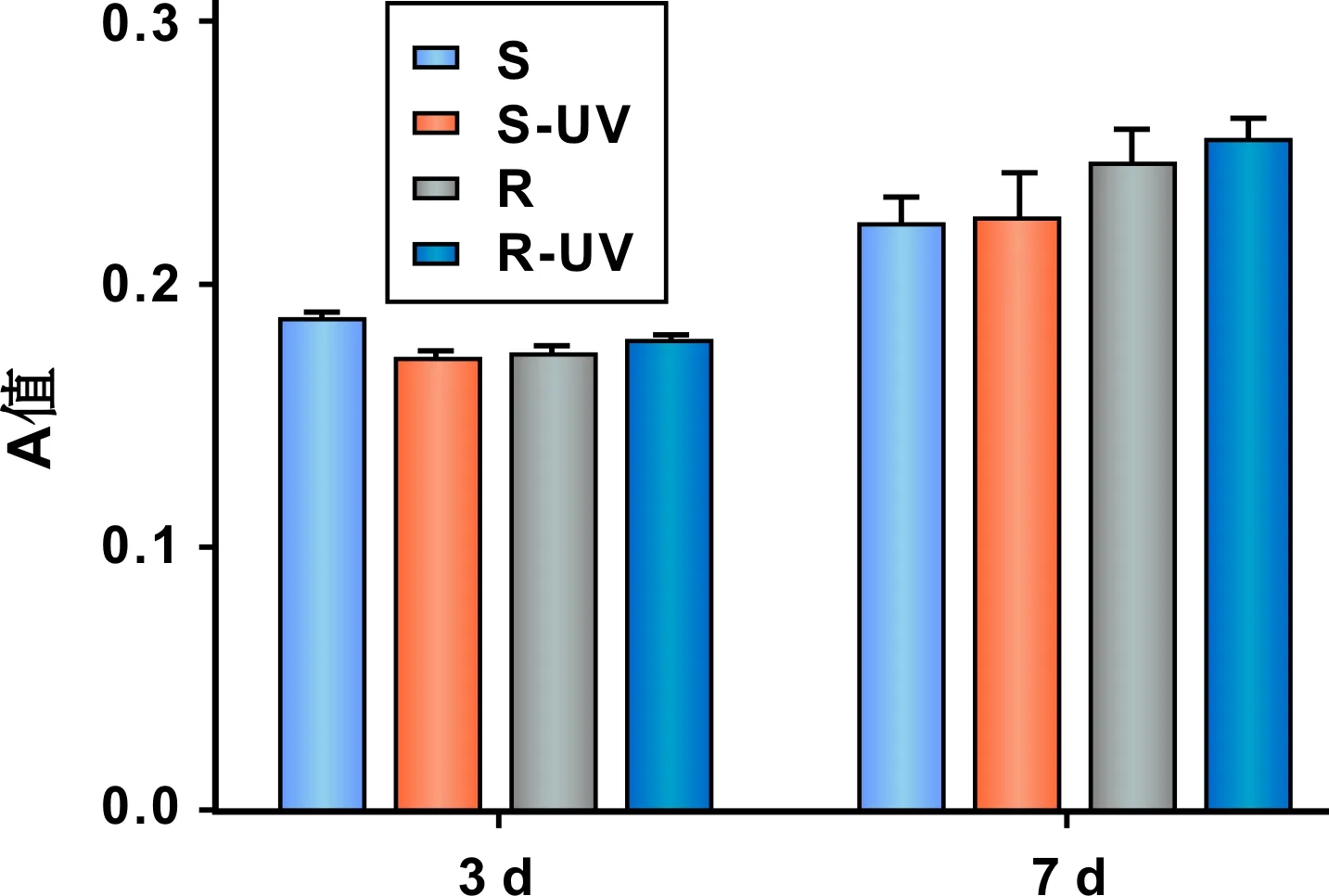
图 2MC3T3-E1细胞的碱性磷酸酶活性
Fig 2Alkaline phosphatase activity of MC3T3-E1 cells
图 3细胞钙结节染色吸光度值
Fig 3Absorbency of the stained calcium nodus
3 讨 论
评价骨内段种植体的早期稳定性往往采用骨结合率等指标。种植体周围成骨细胞活性及生物学性能对种植体骨周围界面的形成起到关键的作用,而对种植体骨结合及生物活性的影响主要在于材料表面形貌及其化学组成[6], 并且不同材料表面的不同改性方法可获得不同的表面形貌和粗糙度,这将导致成骨细胞在种植体材料的表面所表现出的反应不同。氧化锆拥有优秀的生物相容性和近乎完美的美学效果, 其弯曲强度为900~1 200 MPa, 压缩强度可高达2 000 MPa[5],完全可承受后牙的咀嚼力。在植入口内后不会受到唾液龈沟液的腐蚀,并可以减少菌斑的聚集从而减少种植体周围炎的发生[7]。Ko 等[8]研究,氧化锆与钛有相似的细胞附着形态。Depprich 等[9]研究显示氧化锆材料细胞附着和生长率高于钛。氧化锆种植体表面改性的方法为通过酸蚀喷砂等物理的方法获得最适合的微米级别的表面粗糙度,或者在种植体表面添加生物活性材料等[10]。粗糙的表面增大了种植体表面积,合适的粗糙度可促进细胞的早期附着,达到种植体早期稳定,提高种植体远期成功率[11]。紫外线照射钛种植体表面可增加其表面亲水性,当照射由于长时间储存而老化的种植体后,重新获得表面活性并获得亲水性,促进成骨细胞粘附、增殖、分化、矿化和蛋白表达以及骨结合[12-14]。本实验将喷砂及紫外线照射2 种表面改性技术相结合应用于氧化锆,以期提高氧化锆表面的生物活性,增加骨结合。
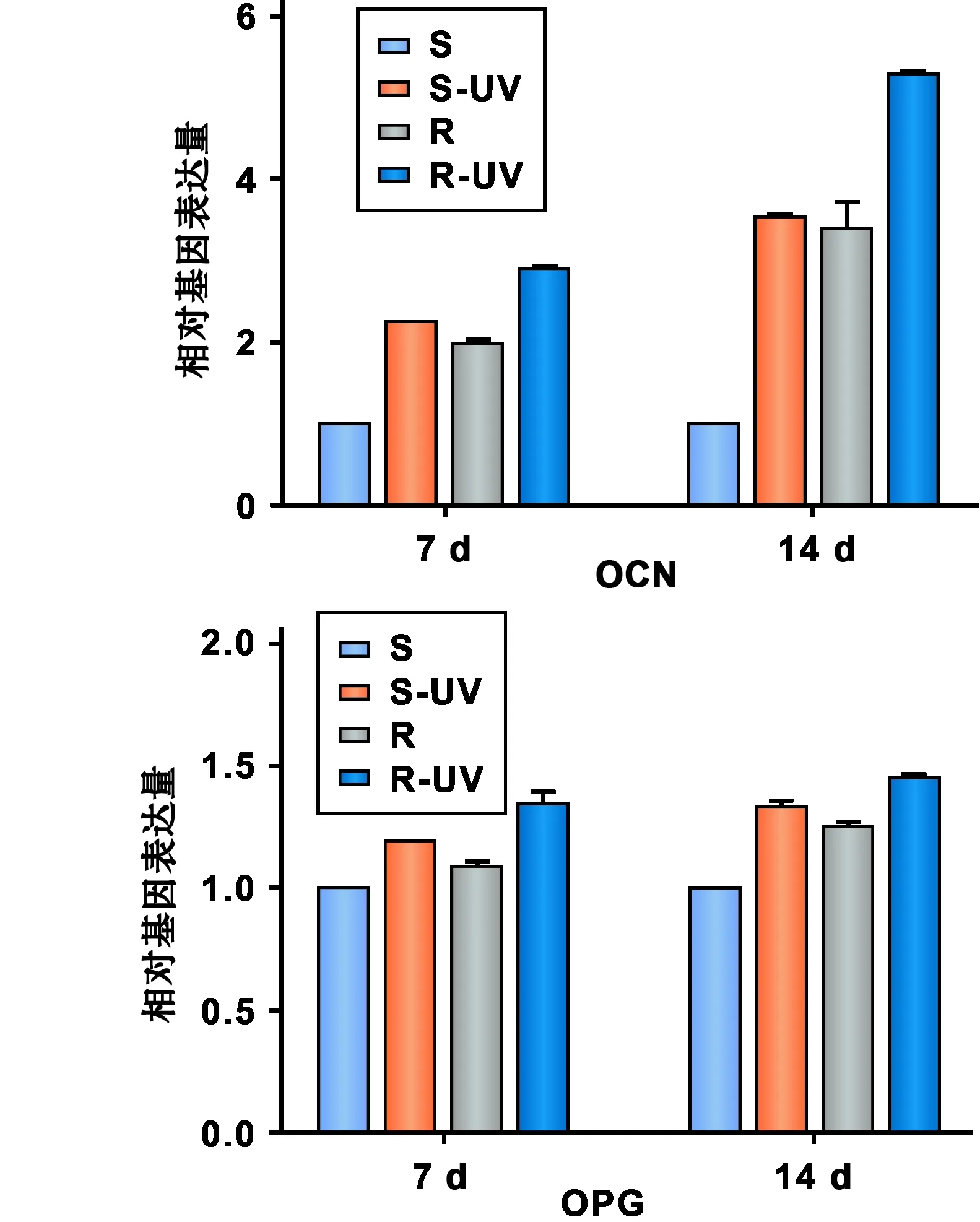
图 4MC3T3-E1细胞中OPG、 OCN的mRNA表达
Fig 4The mRNA expression of OPG and OCN in MC3T3-E1 cells
MTT结果显示,经紫外线照射的氧化锆试件比未经照射的试件更能有效的促进成骨细胞的增殖,且紫外线喷砂处理组的增殖效果更佳,明显优于其余各组。茜素红染色结果提示,紫外线处理组的矿化程度要优于未处理组,且紫外喷砂处理组的矿化程度相对较高。因此,经紫外线照射后的试件能增加MC3T3-E1细胞的增殖与矿化,且喷砂粗糙组的效果更为显著。ALP数据显示,粗糙各组的活性高于光滑各组,且R组与R-UV之间无明显差异,表明粗糙因素较紫外线因素对ALP活性的影响更为明显。骨钙素(OCN)是成骨细胞合成分泌的一种重要的非胶原蛋白,能够与钙结合,从而参与调节羟基磷灰石结晶生长,是反映成骨细胞分化成熟的指标[15-16]。护骨素(OPG)是TNF受体超家族成员,研究证实[17],OPG/RANKL/RANK系统是破骨细胞分化成熟的主要调节机制,抑制破骨细胞分化和骨吸收功能。RT-PCR数据显示,UV组OCN、OPG mRNA表达随时间变化均表现为上调,虽然单纯喷砂组(R组)的表达量较低于光滑紫外处理组(S-UV组),但喷砂紫外处理组(R-UV组)的表达量相较于其他组OCN、OPG mRNA表达上调更为显著。本实验结果表明,喷砂处理的氧化锆试件表面经紫外线照射可使MC3T3-E1细胞的增殖与矿化明显增加,且OCN、OPG mRNA表达明显上调,故粗糙紫外线处理氧化锆试件可促进成骨细胞生物学功能,提高种植体早期骨结合。
虽然目前氧化锆材料在口腔领域内的应用很广泛,但氧化锆材料转化为种植体还需进一步研究,应在材料的机械性能、加工制作、表面处理技术及设计、临床可靠性等做深入研究。
[1]Shon WJ, Chung SH, Kim HK, et al. Peri-implant bone formation of non-thermal atmospheric pressure plasma-treated zirconia implants with different surface roughness in rabbit tibiae[J]. Clin Oral Implants Res, 2014, 25(5): 573-579.
[2]程宁, 施斌. 氧化锆种植体的研究进展[J]. 口腔医学研究, 2011, 27(12):1115-1117.
[3]Smeets R, Schöllchen M, Gauer T, et al. Artefacts in multimodal imaging of titanium, zirconium and binary titanium-zirconium alloy dental implants: Aninvitrostudy[J]. Dentomaxillofac Radiol, 2017, 46(2): 20160267.
[4]韩建民, 工藤忠明, 林红, 等. 氧化锆种植体的体外细胞相容性研究[J]. 现代口腔医学杂志, 2015, 29(2):70-72.
[5]Piconi C, Maccauro G. Zirconia as a ceramic biomaterial[J]. Biomaterials, 1999, 20(1): 1-25.
[6]Sánchez MC, Fernández E, Llama-Palacios A, et al. Response to antiseptic agents of periodontal pathogens ininvitrobiofilms on titanium and zirconium surfaces[J]. Dent Mater, 2017, 33(4): 446-453.
[7]Gahlert M, Röhling S, Wieland M, et al. A comparison study of the osseointegration of zirconia and titanium dental implants. A biomechanical evaluation in the maxilla of pigs[J]. Clin Implant Dent Relat Res, 2010, 12(4): 297-305.
[8]Ko HC, Han JS, Bãchle M, et al. Initial osteoblast-like cell response to pure titanium and zirconia/alumina ceramics[J]. Dent Mater, 2007, 23(11): 1349-1355.
[9]Depprich R, Ommerborn M, Zipprich H, et al. Behavior of osteoblastic cells cultured on titanium and structured zirconia surfaces[J]. Head Face Med, 2008, 4:29.
[10]孙伟, 徐耀卿, 李晶, 等. Y-TZP氧化锆植入体的推出实验研究[J]. 口腔医学研究, 2014, 34(7):512-516.
[11]Le Guéhennec L, Soueidan A, Layrolle P, et al. Surface treatments of titanium dental implants for rapid osseointegration[J]. Dent Mater, 2007, 23(7): 844-854.
[12]Hori N, Ueno T, Suzuki T, et al. Ultraviolet light treatment for the restoration of age-related degradation of titanium bioactivity[J]. Int J Oral Maxillofac Implants, 2010, 25(1): 49-62.
[13]Att W, Hori N, Iwasa F, et al. The effect of UV-photofunctionalization on the time-related bioactivity of titanium and chromium-cobalt alloys[J]. Biomaterials, 2009, 30(26): 4268-4276.
[14]Ueno T, Yamada M, Hori N, et al. Effect of ultraviolet photoactivation of titanium on osseointegration in a rat model[J]. Int J Oral Maxillofac Implants, 2010, 25(2): 287-294.
[15]赵煜, 李冰雁, 杜莉, 等. 磁性附着体模拟磁场对成骨细胞分化功能的影响[J]. 中华口腔医学研究杂志, 2011, 5(2): 151-155.
[16]张小恒, 余占海, 张国英, 等. 转化生长因子β1对大鼠牙周组织中白介素-6、骨钙素水平的影响[J]. 口腔医学研究, 2010, 26(2): 171-174.
[17]张薷文, 周延民, 赵静辉. 种植体骨结合相关检测手段研究现状[J]. 实用口腔医学杂志, 2013, 29(5): 730-733.
