雌激素对大鼠下颌髁突软骨、软骨下骨退行性变影响的研究
2018-04-02叶涛孙东亮翁希里张勉杨鸿旭刘沂朝于世宾
叶涛 孙东亮 翁希里 张勉 杨鸿旭 刘沂朝 于世宾
颞下颌关节紊乱病(temporomandibular disorder, TMD)的具体病因及发病机制尚不明确[1]。其重症表现形式是颞下颌关节(temporomandibular, TMJ)骨关节炎(osteoarthritis, OA)[2],发病部位同时涉及下颌髁突软骨和软骨下骨,早期的主要病理学特征为下颌髁突软骨基质降解、软骨细胞凋亡及软骨下骨吸收等退行性变[3]。流行病学调查显示TMD的发病具有明显的女性倾向,前来就诊的TMD患者约80%为中青年女性[4]。研究表明部分TMD患者的血清和关节液中的雌激素水平明显高于对照组[5-6];不同剂量外源性雌激素对体外培养的髁突软骨细胞(MCC)增殖、代谢活动具有双向调节作用[7],提示雌激素与TMD的发生发展密切相关。然而,有关雌激素如何影响TMD发生过程中下颌髁突软骨、软骨下骨退行性变的转归至今鲜有报道。本研究拟依托本课题组独创的大鼠单侧前牙反致TMJOA样变模型[8~9],探讨外源性雌激素对下颌髁突软骨和软骨下骨退行性变转归的影响,以期为今后TMD的临床治疗提供理论依据。
1 材料与方法
1.1 实验动物及分组
6 周龄雌性SD大鼠(第四军医大学动物中心提供,体重160~180 g)18 只,随机分为对照组(C)、单侧前牙反模型组(UAC)、单侧前牙反+雌激素补充组(UAC+E),每组6 只。
1.2 动物模型的建立及取材
按照前期报道的方法[9],制备统一规格的金属不良修复体,实验动物1%戊巴比妥钠腹腔注射麻醉,UAC和UAC+E组大鼠隔湿条件下分别在左侧上、下前牙粘接套筒冠,人为造成左侧前牙反, 每天检查以确保其不脱落,直至实验结束。
17β-雌二醇(17β-E2)晶体(Abcam,ab120657)按说明书配制成溶液(现配现用)。每日清晨,每只UAC+E组大鼠腹腔注射80 μg E2(雌性大鼠血液雌激素的平均生理水平约为45~250 pg/ml[10],而怀孕期间可以达到5 000 pg/ml甚至更高[11]。注射80 μg E2可以使大鼠血液雌激素水平达到400 pg左右[12],既高于生理水平,又不会对机体产生病理影响),C组、UAC组注射同等剂量的生理盐水,直至实验结束。
动物模型建立4 周后,深度麻醉下脱颈处死法处死大鼠,整体取出双侧颞下颌关节,4%多聚甲醛固定过夜,左侧TMJ用于micro-CT扫描检测下颌髁突软骨下骨相关指标,右侧TMJ 10%EDTA中脱钙4 周,脱水、 包埋、 切片(厚度约5 μm),以备后续检测。取各组大鼠子宫,隔湿后称重,以评估雌二醇补充的效果。
1.3 Micro-CT扫描
利用Micro-CT扫描仪(Inveon,西门子,德国),参考以往报道的方法和条件[8]进行扫描、重建,分析软骨下骨骨质变化。分析参数主要包括骨体积分数(BV/TV,the ratio of bone volume to tissue volume)、骨表面积比骨体积(BS/BV,the ratio of bone surface area to bone volume)、骨小梁厚度(Tb.Th,trabecular thickness)、骨小梁间隙(Tb.Sp,trabecular separation)和骨小梁数目(Tb.N,trabecular number)、骨矿物密度(BMD,bone mineral density)。
1.4 苏木素-伊红(Hematoxylin & eosin staining,HE)染色及软骨厚度测量
常规HE染色,采集图像。将髁突等分为前、中、后三部分,应用Leica Q-win软件测量中、后部全层软骨厚度(图 2A),求各部分厚度平均值用于统计分析。
1.5 番红-O-固绿染色
常规方法进行番红-O-固绿染色,采集图像。每个样本随机选取5 个高倍视野(×100),计算番红-O着色面积百分比,取平均值用于统计分析。
1.6 免疫组化染色
参考免疫组化试剂盒说明(中衫金桥,PV-9003)进行常规免疫组化染色,COL2A1多克隆抗体(Santa Cruz,sc-7763)以1∶100稀释, 4 ℃孵育过夜。Leica DM2500 显微镜下采集图像。每个样本随机选取5 个高倍(×100)视野,计算Ⅱ型胶原染色阳性面积百分比,取平均值用于统计分析。
1.7 TUNEL染色
按照产品说明书进行TUNEL染色(Roche,11684795910,USA),DAPI染色(Bioworld Technology,BD5010,USA)。荧光共聚焦显微镜(BX-60, Olympus,Tokyo, Japan)×400视野下成像,TUNEL为绿色荧光(激发波长范围为450~500 nm,发射波长范围为515~565 nm),DAPI为蓝色荧光(激发波长范围为340~364 nm,发射波长范围为454~488 nm)。随机选取5 个高倍(×400)视野,计算TUNEL染色阳性的细胞数,取平均值用于统计分析。
1.8 TRAP染色
按照产品说明书行TRAP染色(Sigma,387-A,USA)。 Leica DM2500 显微镜下采集图像。随机选取5 个高倍(×400)视野,计算TRAP染色阳性且细胞核≥3 个的细胞总数。
1.9 统计学分析

2 结 果
2.1 体重及子宫质量变化
C组大鼠体重与UAC组和UAC+E组差异无显著性(图 1A,P>0.05)。 UAC+E组大鼠子宫重量显著高于C组与UAC组(图 1B,P<0.01), C组与UAC组大鼠子宫重量差异无显著性(图 1B,P>0.05)。

图 1各组大鼠的体重及子宫质量
Fig 1Body and uterus weight of the rats
2.2 髁突软骨组织形态学及软骨厚度的变化
C组软骨表面完整平滑,可清晰的分为纤维层(F)、增殖层(Pro)、前肥大层(Pre)、肥大层(Hyp)四部分,各层细胞分布整齐、均匀(图 2A-b,2 B-a)。UAC组和UAC+E组髁突软骨则表现出软骨各层细胞层次紊乱,分布不均,增殖层细胞分散排列,且与前肥大层界限消失,前肥大层与肥大层部分出现细胞稀疏区域甚至无细胞区域(图 2B-b、 2B-c)。软骨前、中、后带的划分以及软骨厚度的测量点如图(图 2A-a)所示。UAC组和UAC+E组髁突软骨中、后部厚度均显著低于对照组,但UAC组和UAC+E组的髁突软骨中、后部厚度未见明显差异(图 2C,P>0.05)。

图 2SD大鼠TMJ组织形态学改变
Fig 2Histomorphological changes of rat TMJ
2.3 软骨细胞外基质的变化以及软骨细胞的凋亡
如图 3A-a所示,C组髁突软骨番红-O着色的蛋白聚糖均匀、规则地分布于前肥大层与肥大层中,与固绿着色的纤维层、 增殖层及软骨下骨界限清晰。而UAC组和UAC+E组的番红-O着色区域面积明显减少,基本局限于肥大层范围内,且着色、分布不均匀,还可见既无细胞又无蛋白聚糖的区域(图3A-b、3A-c)。且与UAC组相比,UAC+E组蛋白聚糖分布更加局限,仅限于肥大层深部,且更不均匀,在全层软骨中所占面积比例更小(图3A-b; 3B,P<0.05)。
Ⅱ型胶原是软骨细胞外基质的另一种主要成分,Ⅱ型胶原免疫组化染色同样可见,C组软骨中Ⅱ型胶原均匀、规则地分布于前肥大层与肥大层中(图 3A-d)。而UAC和UAC+E组髁突软骨中Ⅱ型胶原的分布区域不均匀、不连续,且分布面积明显少于对照组,且与UAC组相比,UAC+E组髁突软骨中Ⅱ型胶原分布区域面积占全层软骨面积比例更小(图 3A-e、 3A-f; 图B,P<0.01)。
TUNEL及DAPI染色结果显示,软骨细胞的凋亡大部分发生在软骨肥大层。与C组相比,UAC和UAC+E组中的凋亡数目显著增多(图 4A、 4B,P<0.05),且UAC+E组中的软骨细胞凋亡数量显著多于UAC组(图 4A、 4B,P<0.01)。
2.4 软骨下骨的变化
Micro-CT结果显示,UAC组大鼠髁突软骨下骨骨小梁密度明显低于C组和UAC+E组(图 5A)。骨超微结构参数统计分析结果显示,UAC组大鼠髁突软骨下骨的骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)及骨矿物密度(BMD)显著低于C组和UAC+E组(图 5B,P<0.01),骨表面积和骨体积比(BS/BV)、骨小梁数量(Tb.N)和骨小梁分离度(Tb.Sp)显著高于C组和UAC+E组(图 5B,P<0.01)。UAC组和UAC+E组的各项指标之间无显著差异(P>0.05)(图 5B)。
2.5 软骨下骨中破骨细胞的数量变化
TRAP染色结果如图 5A所示,破骨细胞计数结果显示,与C组相比,UAC组大鼠髁突软骨下骨中的破骨细胞数量明显增加(图 6B,P<0.01),而UAC+E组软骨下骨中破骨细胞数量相比于UAC组明显减少(图 6B,P<0.01), 恢复到C组水平(图 6B,P>0.05)。
3 讨 论
TMD是指累及TMJ和/或咀嚼肌的一类口腔常见疾病,发病率高达20%~40%[13],主要临床表现为颌面部疼痛、关节杂音和下颌运动受限,该病的发生将严重影响人们的生活质量[1]。下颌髁突软骨和软骨下骨是TMD累及的主要部位,二者虽然形态结构、血供、神经支配迥异,但二者在潮标线两侧相依而居,更重要的是软骨下骨的形成源于软骨的不断终末分化、降解,在承载生物力学方面二者更是相互支撑、互为表里。近年来,有学者提出应该将软骨和软骨下骨视为一个复合体来看待[14]。然而,以往的研究中,很少有学者同时关注下颌髁突软骨和软骨下骨的生物学反应。
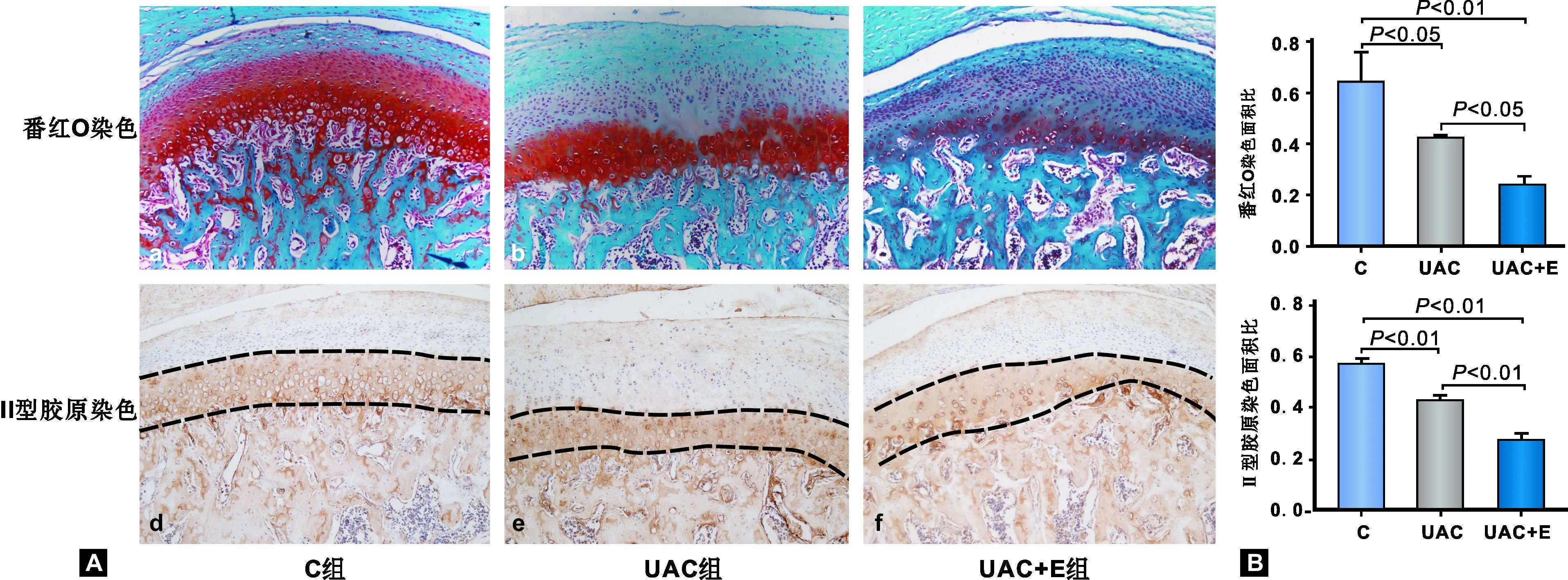
图 3番红-O-固绿、免疫组化染色(×100)
Fig 3Safranin O and immunohistochemical staining(×100)

图 4TUNEL染色(×400)
Fig 4TNUEL staining(×400)
大量流行病学调查显示TMD女性高发,且高发于中青年女性[14],这一发病特点与全身大关节的OA高发于绝经后女性不同[15],因此雌激素在TMJOA发生发展中的作用可能与大关节OA不同。近年来尽管不少学者围绕不同来源(血液来源、外源性、软骨自身合成)雌激素水平对TMD发生发展的影响等方面展开了大量研究,但极少有研究关注雌激素对TMD转归的影响[4,16-18]。本课题组前期发表在国内外研究中的咬合紊乱致大鼠、小鼠TMJOA样变的动物模型,与其他的外科手术、注射化学药物或基因敲出等模型相比,该动物模型具有创伤小、临床仿真度高等优点[8]。本研究结果表明大鼠单侧前牙反模型建立4 周后,大鼠的髁突软骨和软骨下骨都出现了明显的TMJOA样退行性变,这些结果与我们以往报道的结果一致,也进一步证明了该模型的可靠性。研究表明卵巢切除(血液来源雌激素显著减少)后,大鼠TMJ可以出现髁突软骨基质降解减少(软骨层显著增厚)、软骨细胞层次紊乱等变化,雌激素替代治疗可以恢复TMJ的大部分组织形态参数[17]。Ng MC利用体外器官培养技术培养成年大鼠髁突软骨发现,加入高水平(10-8mol/L~10-6mol/L)雌激素刺激后,相比于对照组,髁突软骨厚度会明显下降,细胞外基质蛋白多糖含量也会明显下降,而软骨细胞肥大化标志物X型胶原的表达会明显增多,提示软骨发生了退行性改变。邵乐南 等[7]在体外髁突软骨细胞的研究中发现,一定浓度(10-11~10-8mol/L)的雌激素可以促进软骨细胞的生长以及蛋白多糖的合成,但进一步增加雌激素浓度这种促进作用会逐渐减弱,而且过量的雌激素(10-6mol/L)具有明显的抑制作用。可见,雌激素浓度过高或过低都不利于髁突软骨稳态的维持。本研究结果表明,尽管实验4 周时,UAC和UAC+E组的髁突软骨中后部厚度差异不显著,但相比于UAC组,注射高水平雌激素的UAC+E组髁突软骨中的细胞外基质(蛋白聚糖和Ⅱ型胶原)含量更少,且软骨细胞凋亡数量明显增多,这都提示高水平的雌激素补充加重了髁突软骨的退行性变程度。该结果与Wang 等[12]的研究结果相似,他们依托关节腔注射碘乙酸钠致TMJOA的大鼠模型,通过卵巢切除之后再补充外源性雌激素(0~80 μg/d)的方法改变雌激素水平,结果发现雌激素可以剂量依赖性加重大鼠髁突软骨的退行性变(软骨细胞外基质丢失,软骨细胞凋亡相关基因Fas、FasL表达的上调,软骨厚度下降)。
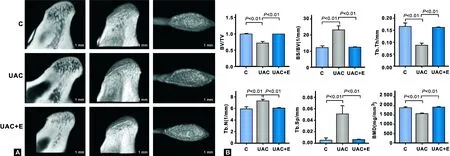
图 5SD大鼠髁突软骨下骨micro-CT结果
Fig 5Results of micro-CT scanning of subchondral bone
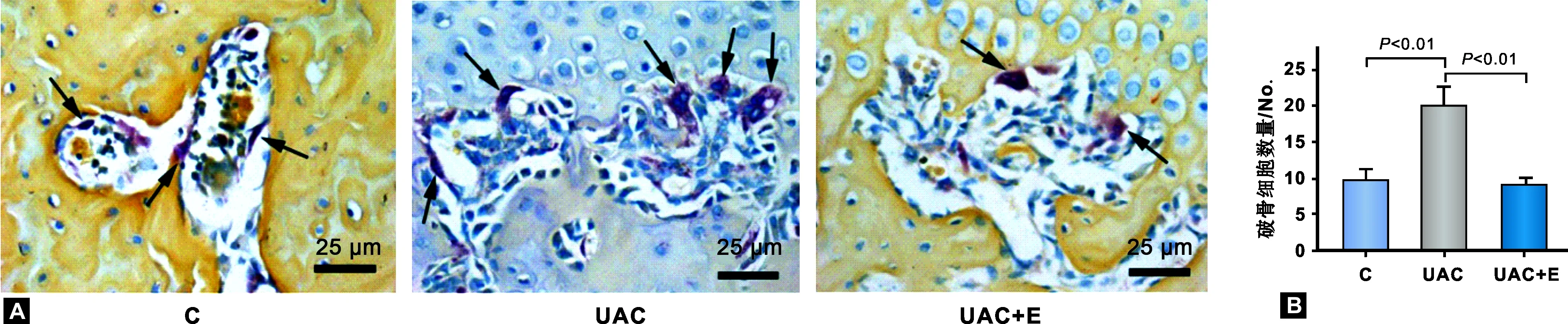
图 6软骨下骨TRAP染色
Fig 6TRAP staining of subchondral bone
髁突软骨下骨作为TMJ另一个重要的组成部分,大量研究证明,在OA的发展过程中,雌激素可以调节软骨下骨的生长和改建,促进基质的生成和钙化,影响成骨、破骨之间的平衡[19]。卵巢切除后大鼠TMJ髁突软骨下骨中的骨量和骨小梁厚度均会显著下降[17]。外源性补充雌激素可以恢复小鼠膝关节OA模型导致的胫骨软骨下骨骨量破坏和骨皮质变薄[20],抑制大鼠骨质疏松模型中股骨的吸收[21]。另外,当给予软骨细胞ATDC5细胞系雌激素干预后(10-11mol/L),软骨细胞分泌的骨保护素(OPG)水平会明显上升,而破骨细胞标志物RANKL的表达量会发生明显的下降[22]。本研究结果表明,建模4 周后,与C组相比,UAC组髁突软骨下骨中的破骨细胞数量明显增多,骨量明显减少,这都提示髁突软骨下骨发生了退行性变,与我们以往报道的结果一致[8]。而高水平雌激素的补充后破骨细胞数量及骨超微参数恢复到了与C组相当的水平,这提示高水平雌激素可以逆转单侧前牙反所致导致的髁突软骨下骨退行性变。这一结果与Wang 等[12]所报道的高水平雌激素会剂量依赖性加重TMJOA(碘乙酸钠关节腔注射)进程中髁突软骨下骨的破坏不一致,这种结果的不一致可能与TMJOA的造模方法不同、大鼠的卵巢切除手术等因素有关,相比较而言,本研究的操作与疾病天然的发病模式更相近。当然,今后还需更进一步深入的研究来确定雌激素对于髁突软骨下骨的作用机制。
[2]Israel HA, Diamond B, Saed-Nejad F, et al. Osteoarthritis and synovitis as major pathoses of the temporomandibular joint: Comparison of clinical diagnosis with arthroscopic morphology[J]. J Oral Maxillofac Surg, 1998, 56(9): 1023-1027.
[3]Stegenga B. Osteoarthritis of the temporomandibular joint organ and its relationship to disc displacement[J]. J Orofac Pain, 2001, 15(3): 193-205.
[4]Warren MP, Fried JL. Temporomandibular disorders and hormones in women[J]. Cells Tissues Organs, 2001, 169(3): 187-192.
[5]Landi N, Lombardi I, Manfredini D, et al. Sexual hormone serum levels and temporomandibular disorders. A preliminary study[J]. Gynecol Endocrinol, 2005, 20(2): 99-103.
[6]程鹏, 马绪臣, 李盛琳, 等. 颞下颌关节紊乱病关节液雌二醇及骨钙素的检测及其临床意义[J].现代口腔医学杂志, 2001, 15(3): 187-190.
[7]邵乐南, 程鹏, 马绪臣, 等. 雌二醇对兔髁突软骨细胞增殖与分化的影响[J]. 同济医科大学学报, 2000, 29(6): 588-591.
[8]Zhang J, Jiao K, Zhang M, et al. Occlusal effects on longitudinal bone alterations of the temporomandibular joint[J]. J Dent Res, 2013, 92(3): 253-259.
[9]Wang YL, Zhang J, Zhang M, et al. Cartilage degradation in temporomandibular joint induced by unilateral anterior crossbite prosthesis[J]. Oral Dis, 2014, 20(3): 301-306.
[10]Södersten P, Eneroth P. Serum levels of oestradiol-17 beta and progesterone in relation to sexual receptivity in intact and ovariectomized rats[J]. J Endocrinol, 1981, 89(1): 45-54.
[11]Offner H, Adlard K, Zamora A, et al. Estrogen potentiates treatment with T-cell receptor protein of female mice with experimental encephalomyelitis[J]. J Clin Invest, 2000, 105(10): 1465-1472.
[12]Wang XD, Kou XX, Meng Z, et al. Estrogen aggravates iodoacetate-induced temporomandibular joint osteoarthritis[J]. J Dent Res, 2013, 92(10): 918-924.
[13]Schiffman EL, Fricton JR, Haley DP, et al. The prevalence and treatment needs of subjects with temporomandibular disorders[J]. J Am Dent Assoc, 1990, 120(3): 295-303.
[14]Lories RJ, Luyten FP. The bone-cartilage unit in osteoarthritis[J]. Nat Rev Rheumatol, 2011, 7(1): 43-49.
[15]Roman-Blas JA, Castaeda S, Largo R, et al. Osteoarthritis associated with estrogen deficiency[J]. Arthritis Res Ther, 2009, 11(5): 241.
[16]Ng MC, Harper RP, Le CT, et al. Effects of estrogen on the condylar cartilage of the rat mandible in organ culture[J]. J Oral Maxillofac Surg, 1999, 57(7): 818-823.
[17]Yasuoka T, Nakashima M, Okuda T, et al. Effect of estrogen replacement on temporomandibular joint remodeling in ovariectomized rats[J]. J Oral Maxillofac Surg, 2000, 58(2): 189-196.
[18]Yu S, Xing X, Liang S, et al. Locally synthesized estrogen plays an important role in the development of TMD[J]. Med Hypotheses, 2009, 72(6): 720-722.
[19]Xiao YP, Tian FM, Dai MW, et al. Are estrogen-related drugs new alternatives for the management of osteoarthritis?[J]. Arthritis Res Ther, 2016, 18:151.
[20]Sniekers YH, Weinans H, van Osch GJ, et al. Oestrogen is important for maintenance of cartilage and subchondral bone in a murine model of knee osteoarthritis[J]. Arthritis Res Ther, 2010, 12(5): R182.
[21]李晓红, 赵献银, 朱晓姝, 等. 雌激素对去势大鼠颌骨和股骨结构影响的实验研究[J].实用口腔医学杂志, 2009, 19(4): 333-335.
[22]Galal N, El Beialy W, Deyama Y, et al. Effect of estrogen on bone resorption and inflammation in the temporomandibular joint cellular elements[J]. Int J Mol Med, 2008, 21(6): 785-790.
