25羟基维生素D3对糖尿病大鼠骨髓间充质干细胞NLRP3炎症小体激活及炎症反应的影响
2018-04-02李昊周海伦郭峰王琪李伟
李昊 周海伦 郭峰 王琪 李伟
糖尿病患者长期的高血糖状态可导致包括牙槽骨在内的组织损伤愈合障碍,严重影响多种口腔疾病治疗的实施。研究表明,糖尿病高血糖状态引起损伤局部组织炎症反应过度,是这类疾病产生的重要原因[1]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)存在于包括牙槽骨在内的多个部位的骨组织中,近年来,因能在多种疾病状态下调节炎症反应而备受关注[2-3]。BMSCs可表达在机体免疫炎症中发挥重要作用的核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体及其下游炎症相关蛋白,如白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)等多种炎症因子,并在糖尿病高糖状态下,在局部组织的炎症反应中有重要调节作用[4-5]。调节糖尿病状态下BMSCs的炎症反应,可能影响损伤部位的炎症状态,改善组织愈合进程。
25羟基维生素D3[25(OH)D3, D3] 是一种具有促进新骨形成作用的活性药物,来源广泛,使用安全,目前有越来越多的研究显示,该药物还具有调节炎症反应的作用[6-7]。D3可通过作用于靶细胞上的维生素D受体(vitamin D receptor,VDR),影响下游炎症反应信号通路,抑制过度的炎症反应,而VDR存在于包括BMSCs在内的多种细胞中[7-8],提示D3可能调节糖尿病状态BMSCs的炎症反应,改善骨组织损伤局部的炎症状态,利于组织愈合。然而,该药物对糖尿病状态BMSCs炎症反应的影响及机制如何,目前尚未明确。
本研究用高糖培养基培养糖尿病大鼠BMSCs在体外模拟糖尿病状态,并加入不同浓度的D3后,检测细胞VDR、NLRP3、IL-1β等炎症相关蛋白的表达,观察用药后BMSCs中NLRP3炎症小体的激活及炎症反应的变化,为改善糖尿病状态骨组织损伤局部的炎症反应及损伤愈合提供新思路。
1 材料与方法
1.1 试剂与仪器
D3、链脲佐菌(Sigma, 美国); NLRP3兔抗鼠多克隆抗体(Cell Signaling Technology, 美国); 维生素D受体(vitamin D receptor,VDR)、核因子κB(nuclear factor-κB,NF-κB)、含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)、IL-1β、IL-6、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)小鼠抗大鼠单克隆抗体、含CARD结构域的凋亡相关颗粒样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)兔抗鼠多克隆抗体(Santa Cruz, 美国); 白介素18(interleukin-18,IL-18)兔抗鼠多克隆抗体(Abcam, 英国); CD11b、CD44、CD45、CD90小鼠抗大鼠单克隆抗体、SP染色试剂盒(北京中杉金桥生物技术有限公司); Nikon 80i型显微镜(Nikon, 日本); BIO-RAD Gel Doc XR+凝胶成像系统(BIO-RAD, 美国)。
1.2 实验动物与糖尿病动物模型构建
SPF级SD雄性大鼠20 只(广西医科大学实验动物中心提供),4 周龄, 体质量60~80 g,将所有动物随机分为正常组和糖尿病组,每组10 只。糖尿病组以高糖食物喂养4 周,空腹12 h后腹腔注射链脲佐菌素(35 mg/kg), 1 周后取尾静脉血检测空腹血糖值,超过11.1 mmol/L者视为糖尿病模型构建成功[9]。建模成功后,以常规鼠饲料喂养4 周,测定空腹血糖值后处死。正常组大鼠于相同周龄处死,处死前以常规鼠饲料喂食,未注射链脲佐菌素,处死前测定空腹血糖值确定未患糖尿病。
1.3 BMSCs的分离培养
处死所有大鼠后分离四肢长骨,在含10%青霉素/链霉素的α最低必需培养基(α minimum essential medium,αMEM)中去除表面软组织,更换培养基后切断干骺端冲出骨髓,经过滤、离心后将所得细胞重悬于含10%胎牛血清、10%青霉素/链霉素的αMEM培养基中贴壁培养,获得细胞[10]。
1.4 BMSCs的免疫细胞化学染色鉴定
将第3 代细胞制备细胞爬片,4%多聚甲醛固定,0.5%Triton X-100孵育后,用3% H2O2、封闭血清孵育,CD11b、CD44、CD45、CD90抗体(1∶200)作为一抗孵育,二抗工作液孵育后DAB显色,显微镜下观察。
1.5 25羟基维生素D3处理BMSCs
取第3 代细胞接种至24 孔板,每孔接种3×105个细胞。正常大鼠细胞在含5.5 mmol/L葡萄糖、10%胎牛血清的αMEM培养基中培养,作为正常对照组。糖尿病大鼠细胞在含24 mmol/L葡萄糖、10%胎牛血清的αMEM培养基中培养,模拟体外糖尿病状态[11],并分为糖尿病对照组、糖尿病低浓度组、糖尿病中浓度组和糖尿病高浓度组。正常对照组、糖尿病对照组:不加D3处理;糖尿病低浓度组、糖尿病中浓度组和糖尿病高浓度组每日分别加入1×10-5、 1×10-4、 1×10-3mmol/L的D3。加药培养3 d后,收集各组细胞。
1.6 免疫印迹实验检测BMSCs炎症反应相关蛋白的表达
收集细胞抽提蛋白后,以BCA法定量,常规SDS-PAGE凝胶电泳,湿转后5%脱脂牛奶封闭l h,VDR、NF-κB、NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6(1∶500)、GAPDH(1∶600)抗体作为一抗孵育2 h,羊抗小鼠或羊抗兔IgG抗体作为二抗(1∶3 000)孵育2 h,化学发光显影,凝胶成像系统分析目的蛋白与内参GAPDH条带的相对灰度值。每组细胞蛋白免疫印迹实验重复6 次。
1.7 统计学分析
2 结 果
2.1 大鼠空腹血糖值
注射链脲佐菌素1 周后,糖尿病组大鼠均形成糖尿病,空腹血糖值为(14.82±1.27) mmol/L,正常组大鼠空腹血糖值为(5.32±0.79) mmol/L(P<0.01);处死当日,糖尿病组大鼠空腹血糖值为(18.19±2.14) mmol/L,正常组大鼠空腹血糖值为(4.77±0.81) mmol/L(P<0.01)。
2.2 免疫细胞化学染色
染色结果显示,分离培养的细胞CD11b、CD45的表达呈阴性,CD44、CD90的表达呈阳性,符合BMSCs表面标记物特征(图 1)。
2.3 免疫印迹实验检测各组BMSCs炎症反应相关蛋白的表达
加D3培养3 d后,正常对照组、糖尿病对照组与糖尿病低浓度组细胞VDR的表达量未见统计学差异(P>0.05),且均低于糖尿病中浓度组和糖尿病高浓度组(P<0.05);与糖尿病各组相比,正常对照组细胞低表达NF-κB、NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6(P<0.05),糖尿病对照组与糖尿病低浓度组NF-κB、NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6的表达量高于糖尿病中浓度组与糖尿病高浓度组(P<0.05),但在糖尿病对照组与糖尿病低浓度组之间,在糖尿病中浓度组与糖尿病高浓度组之间,NF-κB、NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6的表达未见统计学差异(P>0.05)(图 2, 表 1)。
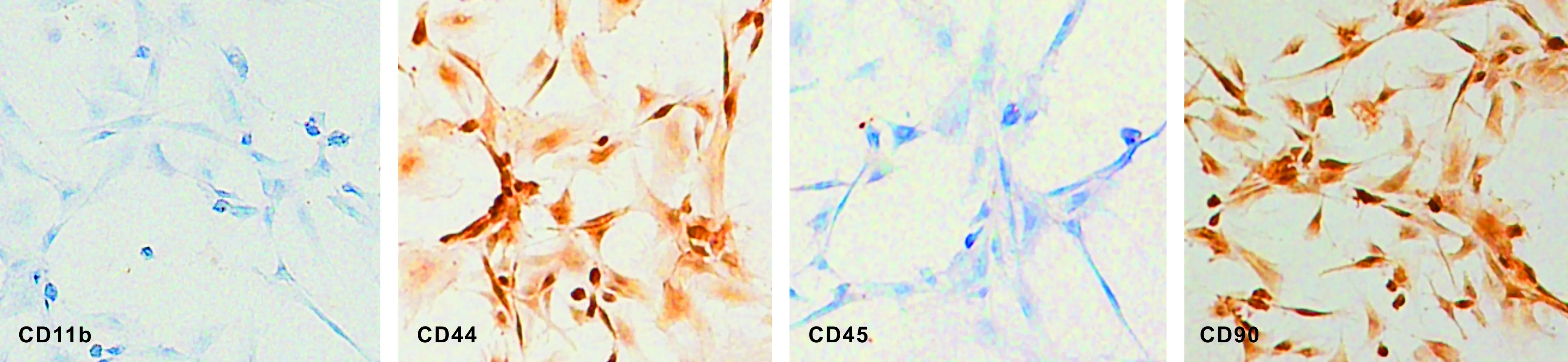
图 1分离培养的骨髓间充质干细胞CD11b、CD44、CD45、CD90的表达(SP法, ×400)
Fig 1Expressions of CD11b, CD44, CD45 and CD90 in the cultured BMSCs(SP staining, ×400)

图 2各组BMSCs炎症相关蛋白表达(Western blot)
Fig 2Inflammation-related protein expression in BMSCs(Western blot)
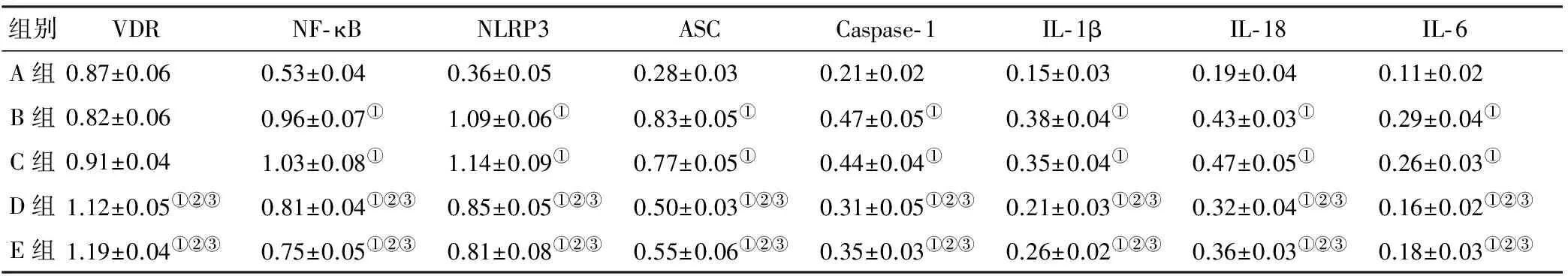
注: A组, 正常对照组; B组, 糖尿病对照组; C组, 糖尿病低浓度组; D组, 糖尿病中浓度组; E组, 糖尿病高浓度组; ①: 与A组相比P<0.01; ②: 与B组相比P<0.01; ③: 与C组相比P<0.01
3 讨 论
本实验结果显示,与正常对照组相比,在体外模拟的糖尿病状态下,糖尿病各组BMSCs的炎症反应相关蛋白NF-κB、NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6表达水平显著升高。既往研究表明,BMSCs在骨关节炎等多种疾病状态下能参与免疫炎症反应,并发挥重要的调节作用;在糖尿病状态易出现的高糖、活性氧簇等刺激因素作用下, BMSCs能过表达NLRP3及IL-1β、IL-6等炎症反应相关蛋白,这些蛋白的高表达,可对局部微环境中巨噬细胞等细胞的炎症反应有促进作用[4-5,12-13]。而在糖尿病状态下, 创伤局部的巨噬细胞等炎细胞产生过度的炎症反应,持续表达肿瘤坏死因子等促炎因子,抑制组织细胞再生,是包括骨组织在内的糖尿病组织损伤愈合障碍发生的主要机制之一[13-14]。这些研究结果提示,调节BMSCs的炎症反应,可能成为治疗该疾病的新策略。
NLRP3炎症小体是近年发现的重要炎症复合体之一,主要由NLRP3、ASC及Caspase-1组成。该炎症小体在动脉粥样硬化、糖尿病等非感染性炎性疾病中发挥重要促炎作用,与糖尿病创伤部位的持续性炎症密切相关[13]。有研究表明,高糖刺激活性氧及硫氧还蛋白相互作用蛋白产生增多后,可激活NLRP3炎症小体,表现为NLRP3的表达上调,促进ASC诱导Caspase-1的前体自我剪切,产生具有活性的Caspase-1,进而降解IL-1β、IL-18的前体,诱导IL-1β及IL-18形成[13,15]。而在这一过程中,需要NF-κB的激活提供必要的信号[4]。NLRP3下游效应分子IL-1β、IL-18的高表达,有利于诱导巨噬细胞、T细胞等向促炎表型转化,并诱导IL-6、肿瘤坏死因子等其他促炎蛋白表达,扩大炎症反应[13,16]。在糖尿病心肌病、糖尿病难愈性创伤等炎症性疾病中,病损部位NLRP3、IL-1β、IL-18等表达水平升高[17-18]。当细胞NLRP3表达减少时,产生IL-1β及IL-18的水平降低,IL-6等其他效应分子的表达也下调[4,19]。这些研究提示,抑制BMSCs中NLRP3炎症小体的激活,可能改善糖尿病高糖状态下创伤局部组织过度的炎症反应,利于组织愈合。
有越来越多的研究表明, D3可在牙周炎、气道变应性炎症等多种炎性疾病中发挥炎症调节作用[6-7]。D3能激活靶细胞上的VDR,抑制下游炎症反应相关信号通路,改善过度的炎症反应[6-7]。在本实验中,糖尿病中浓度组和糖尿病高浓度组的VDR表达量高于正常对照组、糖尿病对照组与糖尿病低浓度组,而后3 组的VDR表达量未见统计学差异,提示D3可能需达到一定的浓度,才能产生激活VDR的作用。既往实验显示,VDR可影响NF-κB DNA结合基序的功能,对NF-κB产生抑制作用,进而抑制NF-κB下游信号通路的激活[20]。本研究显示,应用D3后,糖尿病中浓度组、糖尿病高浓度组的NF-κB及其下游蛋白NLRP3、ASC、Caspase-1、IL-1β、IL-18、IL-6的表达量明显低于糖尿病对照组、糖尿病低浓度组,但在糖尿病对照组与糖尿病低浓度组之间的表达量未见统计学差异,提示在高糖状态下,D3达到有效浓度后,可能通过激活VDR抑制NF-κB,进而抑制BMSCs中NLRP3炎症小体的激活及下游促炎因子的产生,从而抑制炎症反应。
综上所述,本研究结果证实,在高糖培养基体外模拟糖尿病状态下,应用D3能抑制BMSCs中NLRP3炎症小体的激活及促炎因子IL-1β、IL-18、IL-6的表达,该抑制作用可能与激活VDR、抑制NF-κB有关。这些结果提示,D3可能抑制BMSCs的炎症反应,改善糖尿病局部组织的炎症状态,可能为治疗糖尿病状态下包括牙槽骨在内的多种骨创伤愈合障碍提供新思路。
(致谢: 本研究在广西重点实验室口腔颌面修复与重建研究实验室中完成,感谢杨亦萍、卿海云、曹阳老师的实验指导!)
[1]Mirza RE, Fang MM, Ennis WJ, et al. Blocking interleukin-1β induces a healing-associated wound macrophage phenotype and improves healing in type 2 diabetes[J]. Diabetes, 2013, 62(7): 2579-2587.
[2]袁林, 曹依娜, 杨征毅, 等. 人颌骨间充质干细胞的外泌体在巨噬细胞调控中的作用[J]. 实用口腔医学杂志, 2017, 33(3): 344-348.
[3]Bernardo ME, Fibbe WE. Mesenchymal stromal cells: sensors and switchers of inflammation[J]. Cell Stem Cell, 2013, 13(4): 392-402.
[4]Fu Y, Wang Y, Du L, et al. Resveratrol inhibits ionising irradiation-induced inflammation in MSCs by activating SIRT1 and limiting NLRP-3 inflammasome activation[J]. Int J Mol Sci, 2013, 14(7): 14105-14118.
[5]Chang TC, Hsu MF, Wu KK. High glucose induces bone marrow-derived mesenchymal stem cell senescence by upregulating autophagy[J]. PLoS One, 2015, 10(5): e0126537.
[6]Baeke F, Takiishi T, Korf H, et al. Vitamin D: modulator of the immune system[J]. Curr Opin Pharmacol, 2010, 10(4): 482-496.
[7]Li H, Xie H, Fu M, et al. 25-hydroxyvitamin D3 ameliorates periodontitis by modulating the expression of inflammation-associated factors in diabetic mice[J]. Steroids, 2013, 78(2): 115-120.
[8]Zhou S, LeBoff MS, Glowacki J. Vitamin D metabolism and action in human bone marrow stromal cells[J]. Endocrinology, 2010, 151(1): 14-22.
[9]Lambertucci AC, Lambertucci RH, Hirabara SM, et al. Glutamine supplementation stimulates protein-synthetic and inhibits protein-degradative signaling pathways in skeletal muscle of diabetic rats[J]. PLoS One, 2012, 7(12): e50390.
[10]范敬静, 李东良, 何秀华, 等. 骨髓间充质干细胞向肝样细胞的诱导及分化[J]. 中国组织工程研究与临床康复, 2011, 15(14): 2491-2494.
[11]García-Hernández A, Arzate H, Gil-Chavarría I, et al. High glucose concentrations alter the biomineralization process in human osteoblastic cells[J]. Bone, 2012, 50(1): 276-288.
[12]De Miguel MP, Fuentes-Julián S, Blázquez-Martínez A, et al. Immunosuppressive properties of mesenchymal stem cells: Advances and applications[J]. Curr Mol Med, 2012, 12(5): 574-591.
[13]郜敏, 刘琰, 章雄. NLRP3炎症复合体与糖尿病慢性难愈性创面关系的研究进展[J]. 中华损伤与修复杂志(电子版), 2015, 10(5): 55-59.
[14]Mirza R, Koh TJ. Dysregulation of monocyte/macrophage phenotype in wounds of diabetic mice[J]. Cytokine, 2011, 56(2): 256-264.
[15]Qiao J, Huang Y, Xia Y, et al. Busulfan and cyclosphamide induce liver inflammation through NLRP3 activation in mice after hematopoietic stem cell transplantation[J]. Sci Rep, 2015, 5:17828.
[16]吴莹莹, 刘洪臣. TNF-α、IL-1β及IL-6与糖尿病及牙周炎之间的关系[J]. 中华老年口腔医学杂志, 2011, 9(2): 117-121.
[17]Luo B, Li B, Wang W, et al. Rosuvastatin alleviates diabetic cardiomyopathy by inhibiting NLRP3 inflammasome and MAPK pathways in a type 2 diabetes rat model[J]. Cardiovasc Drugs Ther, 2014, 28(1): 33-43.
[18]Mirza RE, Fang MM, Weinheimer-Haus EM, et al. Sustained inflammasome activity in macrophages impairs wound healing in type 2 diabetic humans and mice[J]. Diabetes, 2014, 63(3): 1103-1114.
[19]Dong Y, Fan C, Hu W, et al. Melatonin attenuated early brain injury induced by subarachnoid hemorrhage via regulating NLRP3 inflammasome and apoptosis signaling[J]. J Pineal Res, 2016, 60(3): 253-262.
[20]Li H, Li B, Wang Q, et al. Attenuation of inflammatory response by 25- hydroxyvitamin D3-loaded polylactic acid microspheres in treatment of periodontitis in diabetic rats[J]. Chin Chin J Dent Res, 2014, 17(2): 91-98.
