MUC2在结肠炎小鼠中的保护作用和血清抗CBir1抗体的表达*
2018-04-02张目涵楼江明赵美华冯百岁
贺 欣,张目涵,路 瑶,楼江明,赵美华,马 娜,冯百岁
(郑州大学第二附属医院消化内科,郑州大学第二附属医院炎症性肠病中心,吴阶平医学基金会中国炎症性肠病联盟河南省炎症性肠病中心,河南 郑州 450014)
炎症性肠病(inflammatory bowel disease,IBD)是一种病因尚不是十分清楚的累及肠道各个部位的特发性炎症性疾病,其具体发病机制可能是遗传基因易感性、肠黏膜免疫平衡紊乱和肠道内微生物菌群失调等多种因素共同导致了肠黏膜屏障的损伤,并进一步加剧了IBD疾病发病的过程[1-2]。由2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的小鼠结肠炎模型是模拟IBD发病机制的传统疾病模型,其中TNBS与50 %乙醇溶液混合后共同对小鼠的结肠炎模型进行诱导[3]。黏蛋白2(mucin 2,MUC2)是一种主要附着在肠道黏液层表面上的高度糖基化修饰的大分子黏液状糖蛋白物质。MUC2的蛋白主体不仅可以润滑和保护肠黏膜上皮,并且附着在黏蛋白表面上的糖链还可以参与细胞间的信号转导和肠黏膜相关免疫因子的调控[4]。而细菌鞭毛蛋白作为存在于肠道微生物表面鞭毛上的主要组成成分,同样也成为IBD疾病发生过程中的重要毒性成分和抗原成分[5]。近年来已经有研究发现血清内的细菌免疫标志物抗CBir1鞭毛蛋白抗体可以作为代表肠道内细菌鞭毛蛋白的主要血清标志物[6]。因此,本实验在TNBS诱导的经典结肠炎小鼠模型的基础上进一步使用脂多糖(lipopolysaccharide,LPS)和卵清蛋白(ovalbumin,OVA)作为TNBS模型的激活剂,并以酮替芬(ketotifen)作为TNBS模型的抑制剂,通过使用PAS染色法和免疫组织化学法对各模型组小鼠肠组织MUC2的表达进行测定,并用ELISA方法进一步测量各组小鼠血清中细菌免疫标志物抗CBir1抗体的水平,对MUC2在各种结肠炎小鼠模型中的保护作用进行探究,并对肠道内MUC2与细菌鞭毛蛋白之间表达量的相关性进行进一步的了解。
材 料 和 方 法
1 实验动物和试剂
6~8周龄SPF级健康雄性BALB/c小鼠共60只,购于河南省实验动物中心。TNBS、LPS、OVA和富马酸酮替芬购于Sigma;小鼠抗CBir1抗体ELISA试剂盒购于R&D;山羊抗小鼠MUC2抗体购于UCL;过碘酸溶液、Schiff试剂、苏木素染色液和4%多聚甲醛溶液购于鼎国生物有限公司;阿利新蓝溶液购于博奥森生物技术公司。
2 方法
2.1实验分组60只小鼠随机分为正常对照(normal control)组、TNBS组、LPS+OVA+TNBS组和酮替芬+TNBS组,共4组,每组15只。各组小鼠均为雄性,且各组小鼠体重等一般情况情况没有差别。其中正常对照组在第1天、第8天和第15天分别用100 μL生理盐水进行灌肠;TNBS组在第1天用2.0 mg TNBS和50%乙醇混合成100 μL溶液灌肠,第8天用2.5 mg TNBS和50%乙醇混合成100 μL溶液灌肠,第15天用3.0 mg TNBS和50%乙醇混合成100 μL溶液灌肠;LPS+OVA+TNBS组在TNBS组灌肠基础上将10 μg LPS和20 μg OVA共同溶于100 μL生理盐水中,并分别于第7天、第9天、第12天和第15天时对小鼠进行腹腔注射,之后再将50 μg OVA溶于100 μL生理盐水后于第18~21天期间每日继续对小鼠进行腹腔注射;酮替芬+TNBS组在TNBS组灌肠基础上将0.5 mg酮替芬溶于100 μL生理盐水中,并在每次灌肠前30 min对小鼠进行腹腔注射。
2.2小鼠疾病活动情况的评估每日测定小鼠的体重变化并进行比较,同时观察各组小鼠的大便性状以及大便潜血的情况。根据McCarthy等[7]在文献中制定的疾病活动度指数(disease activity index,DAI)评分标准得出每组小鼠的平均 DAI评分,以评估各组小鼠的疾病活动情况。根据DAI 评分的标准,动物无体重下降,大便性状正常,无大便潜血/肉眼血便者为0分;动物体重下降达1%~5%,大便松散,潜血阳性者为1分;动物体重下降达6%~10%,大便松散,潜血阳性者为2分;动物体重下降达11%~15%,稀便,肉眼血便者为3分;动物体重下降>15%,稀便,肉眼血便者为4分。
2.3标本的采集和处理第22天时用摘除眼球的方式处死小鼠。收集各组小鼠血液并行2 000~2 500 r/min 离心20 min,之后收集上清液保存在-20 ℃冰箱中以备检测。同时取小鼠中段结肠组织,4%多聚甲醛固定,常规石蜡包埋,并制成石蜡切片后放置在4 ℃冰箱保存。将HE染色后的切片放置在光学显微镜下观察各组切片的组织病理学改变,并根据Dieleman等[8]制定的组织学指数(histological index,HI)评分标准进行评分:无炎症、无病变、无隐窝破坏者计0分;轻度炎症、病变深度达黏膜下层、基底 1/3 隐窝被破坏、病变范围达1%~25%者计1分;重度炎症、病变深度达肌层、基底 2/3 隐窝被破坏、病变范围达26%~50%者计2分;重度炎症、病变深度达浆膜层、仅有完整表面上皮、病变范围达51%~75%者计3分;全部隐窝和上皮被破坏、病变范围达76%~100%者计4分。
2.4PAS染色法检测结肠组织MUC2的表达取小鼠结肠组织石蜡切片,脱蜡后加入1%阿利新蓝染液进行30 min染色。蒸馏水洗净后加入过碘酸液静置10 min,充分水洗后再加入Schiff试剂继续染色15 min。吸干Schiff试剂后水洗,之后用苏木素染液对细胞核进行染色。脱水,透明,并用中性树胶封片进行封固。每组于光学显微镜下随机选取3个PAS染色的组织隐窝区域进行观察,其中满杯状细胞的镜下充满了PAS染色的颗粒和黏液,空杯状细胞在PAS染色后颗粒和黏液缺失,并且细胞的顶端表面出现深凹变化。
2.5免疫组化方法检测结肠组织MUC2的表达取小鼠结肠组织石蜡切片,脱蜡和水化后于37 ℃条件下滴加山羊抗小鼠MUC2抗体,4 ℃冰箱过夜并于第2天加入生物素标记的 Ⅱ 抗孵育。PBS冲洗后用DAB显色液进行显色。之后用苏木素对细胞核进行染色1 min,脱水,封片。在显微镜下随机选择5个视野观察,以胞浆内发现棕褐色颗粒的细胞作为阳性细胞,其中阳性细胞在视野中的百分比0~25%为0分,26%~50%为1分,50%~75%为2分,>75%为3分。染色强度轻度着色记为1分,中度着色记为2分,重度着色记为3分。以上两项判定标准中得分之和大于等于3分为阳性,小于3分为阴性。
2.6血清抗CBir1抗体的ELISA检测设置空白孔和待测样品孔,并分别在孔内进行加样,加样后进行封板并在37 ℃环境中孵育30 min。之后用洗涤液洗板5次,并在各个孔中均加入显色剂A和显色剂B各50 μl,于37 ℃阴暗处显色15 min,最后加入终止液终止。用酶标仪中的450 mm波长分别测量各个孔的吸光度(A),并最终得出样品的实际浓度。
3 统计学处理
所有实验数据均用SPSS 21.0统计软件进行处理,定量资料采用平均数±标准差(mean±SD)表示,方差齐性用Levene方法检验,多组数据采用单因素方差分析,有意义的数据采用LSD-t法进一步两两比较。率的比较采用卡方检验,以P<0.05表示差异有统计学意义。
结 果
1 各组小鼠一般状况及DAI评分比较
正常对照组的15只小鼠食量正常,反应灵活,体重有所增加;TNBS组的15只小鼠在灌肠后均出现不同程度的身体蜷缩、食量减少,软便或稀便增多和体重下降等症状,并于灌肠后出现2只小鼠死亡的现象;LPS+OVA+TNBS组的15只小鼠较TNBS组体重下降更明显,消瘦和血便更加明显,有5只小鼠先后在造模过程中死亡,将死亡小鼠进行肠道解剖后肉眼观察小鼠全部结肠段均出现血红色;而酮替芬+TNBS组小鼠与TNBS组相比症状减轻,食量和体重有所恢复,并且大便性状好转。对各组进行DAI评分见表 1。
2 各组小鼠结肠黏膜组织学改变
光学显微镜下观察各组小鼠结肠组织切片可见,正常对照组结肠黏膜完整,结构清晰,腺体排列规则并且仅见很少量炎性细胞浸润;TNBS组结肠可见黏膜上皮小片状坏死,黏膜层内大量淋巴细胞浸润并且杯状细胞数量减少。LPS+OVA+TNBS组小鼠组结肠组织学损伤程度比TNBS组更加严重,结肠黏膜正常腺体结构消失,黏膜下层和肌层均可见淋巴细胞等炎性渗出物,并且炎症波及肠壁全层;酮替芬+TNBS组与TNBS组相比黏膜层炎症程度较轻,但仍有少量淋巴细胞浸润,并且杯状细胞仍有所减少,见图1。各组小鼠结肠黏膜的HI评分见表1。

表1 各组小鼠一般状况、DAI评分和结肠黏膜HI评分的比较Table 1.General status,DAI score and HI score of colonic mucosa in each group
*P<0.05vsnormal control group;△P<0.05vsTNBS group.
Figure 1.HE staining of colonic mucosa in each group (×200).
图1各组小鼠结肠黏膜HE染色
3 各组小鼠肠组织PAS染色和MUC2含量的比较
各组的PAS染色结果可见,正常对照组的结肠隐窝内均可发现大量杯状细胞中的MUC2被染成橘红色;TNBS组中可见杯状细胞有所减少,基底隐窝处可发现细长中断的MUC2;LPS+OVA+TNBS组中已经出现黏膜破裂的表现,并且尚未发现有明显的杯状细胞和MUC2的染色;酮替芬+TNBS组与TNBS组相比MUC2的含量有所增高,但与正常对照组相比黏蛋白的含量和杯状细胞数量仍有所减少,见图2。
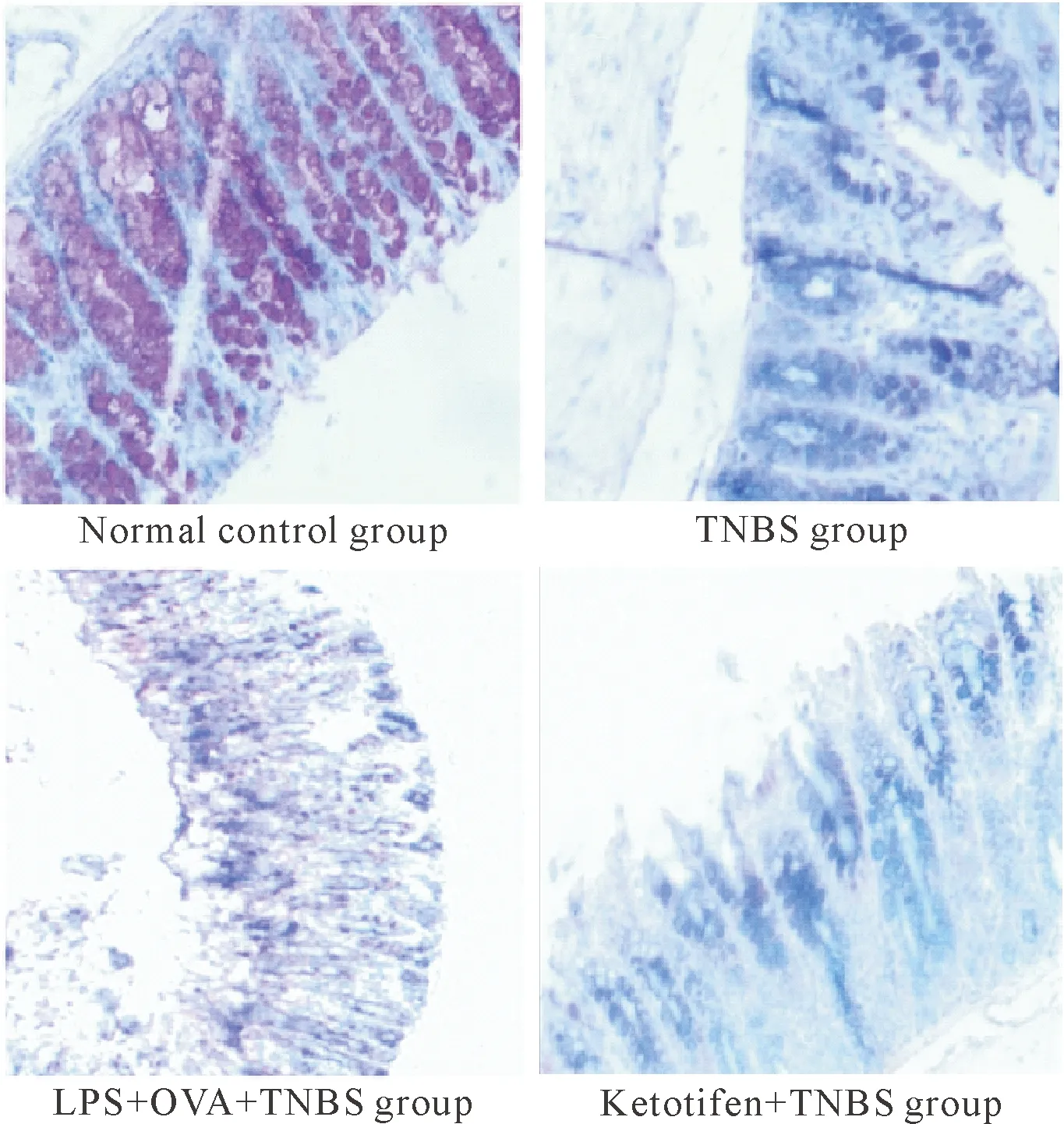
Figure 2.PAS staining for observing the content of MUC2 in the intestinal tissues of the mice with different treatments (×100).
图2PAS染色中各组小鼠肠道组织MUC2含量的比较
4 小鼠肠组织免疫组化染色中MUC2的表达
免疫组化结果可见,正常对照组的MUC2表达于大量结肠黏膜隐窝的杯状细胞内和少量上皮细胞内,并且染色阳性结果位于细胞质内;而与正常对照组相比,TNBS组、LPS+OVA+TNBS组和酮替芬+TNBS组染色强度均有不同程度减弱并且MUC2的含量均有降低。运用上述的半定量评分标准对观察结果进行分析显示,与正常对照组相比,TNBS组、LPS+OVA+TNBS组、酮替芬+TNBS组结肠黏膜MUC2表达阳性率均明显降低;与TNBS组相比,LPS+OVA+TNBS组结肠黏膜MUC2表达阳性率进一步降低,而酮替芬+TNBS组结肠黏膜MUC2表达阳性率则有所回升(P<0.05),见图3、表2。
Figure 3.The content of MUC2 in the colon tissues of each group in the mice (immunohistochemical staining,×400).
图3各组小鼠结肠组织中MUC2含量的比较
5 各组小鼠血清抗CBir1抗体的浓度结果
与正常对照组相比,TNBS组、LPS+OVA+TNBS组和酮替芬+TNBS组的血清抗CBir1抗体浓度明显增高;并且与TNBS组相比,LPS+OVA+TNBS组的血清抗CBir1抗体浓度更加增高,酮替芬+TNBS组血清抗CBir1抗体浓度则有所降低(P<0.05),见表2。
讨 论
IBD是一类发病原因不清,发病机制复杂,并且目前没有很好的治愈性措施的疾病,近年来其在我国的发病率有着明显增高的趋势[9]。由TNBS溶液诱导的小鼠结肠炎模型是可以模拟IBD发病过程的经典模型之一,其在肠道内主要通过诱发Th1型免疫反应从而在肠道免疫调节紊乱方面促进了小鼠结肠炎的发展[10]。LPS又被称为细菌内毒素,是构成革兰阴性厌氧菌细胞壁的主要成分[11]。LPS主要通过作用于细胞膜上的Toll样受体家族和后续的骨髓样分化因子88等胞内信号转导途径,从而进一步诱导了淋巴细胞和肥大细胞等各种免疫细胞合成和释放细胞因子,介导肠道内的炎症反应过程[12]。而OVA是一种通常被用来与半抗原相偶联从而合成完全抗原的载体蛋白,当LPS与这类载体蛋白结合之后便可以加强对后续免疫应答的修饰[13]。已经有哮喘等呼吸系统疾病的动物模型中使用了LPS和OVA共同诱导气道表面微生物菌群的失调,并最终诱发了呼吸道炎症反应的发生[14]。本实验的结果也可以发现,LPS+OVA+TNBS模型组小鼠的DAI评分和HI评分与TNBS组相比均有所上升,说明了在TNBS传统模型的基础上加用LPS和OVA,可以对TNBS模型小鼠在肠道微生物失调方面进一步对肠黏膜进行破坏。酮替芬是一种可以作用于肥大细胞细胞膜上的炎症反应保护剂,其主要通过减少肥大细胞细胞膜的变构从而阻止其释放炎症反应相关的过敏性介质[15-16]。已经有研究发现在IBD的小鼠模型中肥大细胞的数量可以增加到10倍以上[17]。而本实验的结果也发现,酮替芬+TNBS组的DAI评分和HI评分虽然与正常对照组相比依然有所增高,但是与TNBS组模型组相比则明显降低,说明了酮替芬可以通过抑制TNBS模型小鼠肠黏膜内肥大细胞激活的方式从而缓解肠道炎症反应的发生。
表2各组小鼠MUC2在结肠组织中的免疫组化定量和血清抗CBir1抗体浓度的比较
Table 2.The expression level of MUC2 in colonic tissue of mice determined by immunohistochemical method and serum anti-CBir1 antibody concentration measured by ELISA (Mean±SD.n=15)

GroupMUC2positiveAnti⁃CBir1antibody(ng/L)Normalcontrol13(86.7%)26.34±2.41TNBS6(40.0%)∗45.99±3.92∗LPS+OVA+TNBS4(26.7%)∗△51.83±3.62∗△Ketotifen+TNBS11(73.3%)∗△32.45±2.66∗△
*P<0.05vsnormal control group;△P<0.05vsTNBS group.
黏蛋白是一类广泛存在于各个组织和器官中的高相对分子质量并且高度糖基化修饰的蛋白家族。正常情况下的黏蛋白不仅其蛋白主体可以对上皮细胞和组织进行润滑和保护,并且附着在蛋白主体上的众多糖链还可以在细胞信号转导、淋巴循环、抗原提呈甚至是活化免疫细胞等各方面均发挥重要作用[18]。目前已经发现的黏蛋白共有20多种,其中来自于肠道内的MUC2是参与构成肠黏膜屏障最重要的糖蛋白。MUC2主要在肠道杯状细胞中产生并在其内部进行糖基装配和分泌,因此附着在MUC2主体上的糖链也为肠道内正常菌群和一些免疫球蛋白的黏附提供了位点[4,19]。已经有研究发现肠黏膜MUC2的缺失可以引发结肠癌和细菌性腹泻等肠道内相关疾病的发生[20-21],从而推测MUC2在IBD的发生发展中也可以起到重要的肠道保护作用。本实验的PAS染色结果中,可见TNBS组与正常对照组相比出现了细长中断的基底隐窝黏蛋白并且杯状细胞数量也相对有所减少;更加严重的LPS+OVA+TNBS组已经出现黏膜破裂现象,并且没有发现明显的杯状细胞和黏蛋白的染色;而酮替芬+TNBS组黏蛋白的含量要比TNBS组高。之后进一步用免疫组化方法再次对肠道组织MUC2的表达进行观察后发现,TNBS组、LPS+OVA+TNBS组和酮替芬+TNBS组与正常对照组相比MUC2的表达均有所减少;LPS+OVA+TNBS组与TNBS组相比,结肠黏膜MUC2的表达量更加减少;而酮替芬+TNBS组与TNBS组相比结肠黏膜MUC2的表达量则有所回升,并且半定量分析差别均具有统计学意义。
除肠黏膜免疫反应失衡以外,肠道微生物菌群的失调在IBD发病机制中也具有非常关机键的地位。细菌鞭毛蛋白是存在于细菌表面络合物的重要物质,其最先在自发性结肠炎的小鼠模型中发现,并代表着细菌的活力和黏附方面的能力。已经有研究表明细菌鞭毛蛋白可以在组织内激活TLR5受体,从而促发后续炎症反应[22-23]。而最近也有研究发现其在IBD的发病过程中也具有重要意义[24]。在肠道细菌介导下的炎症反应过程中会出现很多具有代表性的血清免疫标志物,其中最典型的标志物抗CBir1抗体既是对特定细菌产生免疫反应之后在血清中表达的产物,也是反映人体肠道和微生物菌群之间发生相互作用的一种标志性物质[25]。本实验用ELISA的方法对血清抗CBir1抗体的浓度进行了检测,结果发现LPS+OVA+TNBS模型组中抗CBir1抗体的表达明显高于正常对照组和TNBS组,而酮替芬+TNBS组与TNBS组相比抗CBir1的表达量则有所降低。同时在上述免疫组化染色的实验结果中还可以发现MUC2在肠道的溃疡部位及其附近水肿区,或是隐窝脓肿的隐窝上皮增生处等表达均有减低,因此更加说明了细菌鞭毛蛋白可以破坏各组小鼠肠黏膜内以MUC2为主的黏液状保护层并趁机从破溃的肠道中进入血液,使得后续微生物和免疫反应可以更加直接地对肠道进行损害。而肠道内完整的MUC2则可以阻挡细菌鞭毛蛋白等有害物质的入侵从而对肠道进行保护。
综上所述,本实验在小鼠结肠炎TNBS模型的基础上用LPS和OVA作为激活剂并用酮替芬作为抑制剂进一步进行干预,从而说明了MUC2不仅可以在各种结肠炎模型中起到附着于肠道黏液层的物理保护作用,还可以在IBD的免疫失衡和微生物菌群失调等因素中发挥着抗炎反应的调控。并且肠黏膜MUC2的分泌与肠道内破坏性物质细菌鞭毛蛋白的表达也存在着一定负相关。有关MUC2与肠黏膜屏障和细菌鞭毛蛋白等物质的具体关系和作用机制仍不是十分清楚,因此有待于更多的后续实验对此进行更加深入的研究。
[参考文献]
[1]Mao R,Hu PJ.The future of IBD therapy:where are we and where should we go next?[J].Dig Dis,2016,34(1-2):175-179.
[2]Loddo I,Romano C.Inflammatory bowel disease:gene-tics,epigenetics,and pathogenesis[J].Front Immunol,2015,6:551.
[3]Tomasello G,Sinagra E,Raimondo D,et al.Validation of a modified model of TNBS-induced colitis in rats.How to induce a chemical colitis in rats[J].Acta Biomed,2015,86(1):92-96.
[4]Shan M,Gentile M,Yeiser JR,et al.Mucus enhances gut homeostasis and oral tolerance by delivering immunoregulatory signals[J].Science,2013,342(6157):447-453.
[5]Peloquin JM,Nguyen DD.The microbiota and inflammatory bowel disease:insights from animal models[J].Anaerobe,2013,24:102-106.
[6]Choung RS,Princen F,Stockfisch TP,et al.Serologic microbial associated markers can predict Crohn’s disease behaviour years before disease diagnosis[J].Aliment Pharmacol Ther,2016,43(12):1300-1310.
[7]McCarthy J,O’Mahony L,O’Callaghan L,et al.Double blind,placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance[J].Gut,2003,52(7):975-980.
[8]Dieleman LA,Palmen MJ,Akol H,et al.Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J].Clin Exp lmmunol,1998,114(3):385-391.
[9]Gearry RB.IBD and environment:are there differences between east and west[J].Dig Dis,2016,34(1-2):84-89.
[10] Kiesler P,Fuss IJ,Strober W.Experimental models of inflammatory bowel diseases[J].Cell Mol Gastroenterol Hepatol,2015,1(2):154-170.
[11] Han C,Ding Z,Shi H,et al.The role of probiotics in lipopolysaccharide induced autophagy in intestinal epithelial cells[J].Cell Physiol Biochem,2016,38(6):2464-2478.
[12] Guo S,Nighot M,Al-Sadi R,et al.Lipopolysaccharide regulation of intestinal tight junction permeability is mediated by TLR4 signal transduction pathway activation of FAK and MyD88[J].J Immunol,2015,195(10):4999-5010.
[13] Jardi F,Aguilera M,Vergara P,et al.Lipopolysaccha-rides facilitate colonic motor alterations associated to the sensitization to a luminal antigen in rats[J].J Neurogastroenterol Motil,2015,21(2):222-235.
[14] Katsura Y,Harada N,Harada S,et al.Characteristics of alveolar macrophages from murine models of OVA-induced allergic airway inflammation and LPS-induced acute airway inflammation[J].Exp Lung Res,2015,41(7):370-382.
[15] Baba A,Tachi M,Ejima Y,et al.Anti-allergic drugs tranilast and ketotifen dose-dependently exert mast cell-stabilizing properties[J].Cell Physiol Biochem,2016,38(1):15-27.
[16] Hung CH,Suen JL,Hua YM,et al.Suppressive effects of ketotifen on Th1-and Th2-related chemokines of monocytes[J].Pediatr Allergy Immunol,2007,18(5):378-384.
[17] Boeckxstaens G.Mast cells and inflammatory bowel disease[J].Curr Opin Pharmacol,2015,25:45-49.
[18] Corfield AP.Mucins:a biologically relevant glycan barrier in mucosal protection[J].Biochim Biophys Acta,2015,1850(1):236-252.
[19] Gouyer V,Dubuquoy L,Robbe-Masselot C,et al.Delivery of a mucin domain enriched in cysteine residues strengthens the intestinal mucous barrier[J].Sci Rep,2015,5:9577.
[20] Krishn SR,Kaur S,Smith LM,et al.Mucins and associated glycan signatures in colon adenoma-carcinoma sequence:prospective pathological implication(s) for early diagnosis of colon cancer[J].Cancer Lett,2016,374(2):304-314.
[21] Engevik MA,Yacyshyn MB,Engevik KA,et al.HumanClostridiumdifficileinfection:altered mucus production and composition[J].Am J Physiol Gastrointest Liver Physiol,2015,308(6):G510-G524.
[22] Peloquin JM,Nguyen DD.The microbiota and inflammatory bowel disease:insights from animal models[J].Anaerobe,2013,24:102-106.
[23] Chaichana P,Chantratita N,Brod F,et al.A nonsense mutation in TLR5 is associated with survival and reduced IL-10 and TNF-α levels in human melioidosis[J].PLoS Negl Trop Dis,2017,11(5):e0005587.
[24] Alexander KL,Targan SR,Elson CO 3rd.Microbiota activation and regulation of innate and adaptive immunity[J].Immunol Rev,2014,260(1):206-220.
[25] Wallis D,Asaduzzaman A,Weisman M,et al.Elevated serum anti-flagellin antibodies implicate subclinical bowel inflammation in ankylosing spondylitis:an observational study[J].Arthritis Res Ther,2013,15(5):R166.
