miR-195对肺癌A549细胞生物学行为的调控作用
2018-04-02高建生张冬英
王 依,詹 蓉,高建生,张冬英,刘 华
(广东药科大学附属第一医院干保科,广东 广州 510080)
肺癌是一种常见的恶性肿瘤,具有较高的发病率和死亡率,不仅病理过程复杂,且目前传统的放化疗及手术治疗效果并不理想[1]。因此探讨其发生发展的相关机制及作用靶点对于控制病情以及个性化诊疗具有非常重要的意义。随着对肺癌基因组学研究的不断深入,微小RNA(microRNA,miRNA,miR)在其中的作用越来越受到研究者的重视。在肺癌的发生发展进程中,众多miRNAs发挥着类似抑癌或原癌基因样的作用,调控肺癌细胞的多种生物学行为[2-3]。miR-195属于miRNA-15/16/195家族,定位于人染色体17p13.1,在多种肿瘤中可通过靶向不同的基因发挥抑癌作用[4-5]。Shuang等[6]在喉癌组织及细胞中检测到miR-195低表达,此外miR-195还可靶向bcl-2基因抑制喉癌细胞Hep-2的增殖并促进其凋亡。在宫颈癌中miR-195可通过调控HDGF基因抑制肿瘤的生长[7]。Su等[8]通过对100例非小细胞肺癌患者和100健康志愿者的对比分析发现,miR-195在肺癌中低表达,却与肺癌的淋巴转移及临床分级密切相关。此外,Gao等[9]在肺癌中研究HMGA2基因的功能时,发现miR-195可直接调控HMGA2基因的表达,进而影响H1299细胞的增殖及迁移。考虑到miRNAs作用的复杂性及靶基因的多样性,本研究通过转染miR-195 mimics,检测miR-195对肺腺癌A549细胞恶性生物学行为的影响,并预测其可能的靶基因。
材 料 和 方 法
1 材料与试剂
人肺癌细胞系A549为本实验室自行冻存。胎牛血清(fetal bovine serum,FBS)、RPMI-1640和Opti-MEM培养基购于Gibco;配套转染试剂购自Invitrogen; 抗cyclin D1、CDK2、Bcl-2、p-Rb/Rb及β-actin抗体购于Cell Signaling Technology;CCK-8细胞活力分析试剂盒购于广州奕源生物公司;细胞周期检测试剂盒、细胞凋亡检测试剂盒、BCA试剂盒和Western blot套装试剂盒均购于南京凯基公司;miR-195 mimics及阴性对照miRNA(miR-negative control)、MYB基因过表达载体pcDNA3-MYB及其对照质粒pcDNA3、野生型及突变型MYB基因3’UTR-萤光素酶表达载体(WT-3’UTR和MUT-3’UTR)的构建和测序由Promega完成;其余试剂均为国产分析纯。
2 实验方法
2.1细胞常规培养及转染实验用A549细胞用含10% FBS的RPMI-1640培养基常规培养于37 ℃、5% CO2条件下,每天换液1次,3~5 d消化传代。消化后的细胞接种于6孔板中,至细胞生长80%融合时,更换无血清培养基饥饿处理6 h。分别设置空白对照组(control组)、阴性对照(miR-negative control)组(NC组)和转染miR-195 mimics组(miR-195组)。依据转染说明书,将miR-195 mimics和miR-negative control转染到相应组别的细胞中,继续培养48 h。检验转染效率后,进行后续的实验分析。
2.2CCK-8法测定细胞活力按照说明书,使用CCK-8细胞活力分析试剂盒鉴定各组细胞的细胞活力。经酶标仪测定450 nm波长处各孔的吸光度(A)值。
2.3流式细胞术测定细胞周期收集各组细胞,4 ℃、70%无水乙醇避光固定细胞24 h,重悬细胞。依据细胞周期试剂盒说明书要求,加入碘化丙啶(propidium iodide,PI)染色液孵育30 min,用流式细胞仪检测激发光Ex=488 nm处的荧光强度。
2.4Annexin V /PI 双染色法测定细胞凋亡收集各组细胞,依据Annexin V /PI 双染凋亡试剂盒说明书,加入Annexin V-FITC和PI染色液避光孵育30 min。经流式细胞仪检测激发光Ex=488 nm和发射光Em=530 nm处的荧光强度。
2.5Transwell实验测定细胞迁移采用Transwell小室(24孔板,Transwell小室孔径8 μm)进行检查细胞迁移。收集处理后的细胞,无血清培养基同步化12 h,调整细胞密度为2×108/L。Transwell小室上槽腔接种 2×104个细胞(每个小室100 μL),小室下槽腔内加入600 μL含10% FBS的培养基,继续培养24 h。用棉签擦除小室上槽腔细胞,0.1%结晶紫染色5 min,用PBS漂洗3次。正置显微镜下随机拍照。
2.6Western blot测定蛋白的表达裂解细胞,萃取细胞蛋白,经 BCA试剂盒对所提蛋白定量后,使用Western blot套装试剂盒进行SDS-PAGE。PVDF膜经5%的脱脂牛奶封闭后,依据抗体说明书要求加入相应比例的 I 抗室温孵育2 h,再加入对应的 II 抗室温孵育1 h,暗室显影。
2.7Real-time PCR依据Trizol说明书的要求提取细胞中的总RNA,纯化并定量后取2 μg总RNA催化合成cDNA,而后依据说明书要求进行PCR扩增。扩增条件为95 ℃ 15 s、60 ℃ 10 s、72 ℃ 20 s,共40个循环。miR-195的表达以U6为内参照,MYB的mRNA表达以β-actin为内参照。基因的相对表达量采用2-ΔΔCt法进行分析。miR-195 的正向引物序列为5’-ACACTCCAGCTGGGTAGCAGCACAGAAAT-3’,反向引物序列为5’-TGGTGTCGTGGAGTCG-3’; U6的正向引物序列为5’-CTCGCTTCGGCAGCACA-3’,反向引物序列为5’-AACGCTTCACGAATTTGCGT-3’; MYB的正向引物序列为5’-GAAGGTCGAACAGGAAGGTTATCT-3’,反向引物序列为5’-GTAACGCTACAGGGTATGGAACA-3’;β-actin的正向引物序列为5’-ACAGAGCCTCGCCTTTGCCGATC-3’,反向引物序列为5’-ATCCTTCTGACCCATGCCCACCA-3’。
2.8萤光素酶报告基因检测本实验采用双萤光素酶报告基因分析检测及验证miR-195的靶基因。首先用靶基因预测数据库TargetScan、PicTar、miRDB和miRanda对miR-195的靶基因进行预测,挑选预测值较高的靶点MYB基因,并进行验证。然后构建野生型和突变型MYB基因3’UTR-萤光素酶表达质粒(WT-3’UTR和MUT-3’UTR),将质粒和/或miR-195 mimics 转入细胞中(转染方法见2.1),使用萤光素酶报告基因检测仪进行Dual-Luciferase Reporter Assay,通过检测萤光素酶的活性来验证MYB是否是miR-195的作用靶点。实验设置空载体(psiCHECK-2)组、野生型MYB基因(WT-3’UTR)和突变型MYB基因(MUT-3’UTR)组。实验结果以萤火虫萤光素酶与海肾萤光素酶活性的比值来进行统计学分析。
3 统计学处理
所得数据均录入SPSS 17.0软件中进行统计学分析。计量资料的结果以均数±标准差(mean±SD)表示。单因素方差分析用于多组计量资料之间的统计学分析。以P<0.05为差异有统计学意义。
结 果
1 miR-195 mimics转染效率检测
Real-time RCR结果显示,相较于对照组,转染miR-195 mimics之后,A549细胞miR-195的表达水平明显升高(P<0.05),可用于后续实验分析,见图1A。
2 过表达 miR-195对A549细胞活力、凋亡及迁移能力的影响
CCK-8实验结果显示,转染miR-195 mimics后,A549细胞的细胞活力显著低于对照组(P<0.05),见图1B。
流式细胞术的结果显示,与对照组比较,A549细胞转染miR-195 mimics后,G0/G1期细胞所占的百分比增加(P<0.05),S期细胞所占百分比减少(P<0.05),说明过表达miR-195可抑制A549细胞周期的G1/S转换,见图1C。
与对照组比较,转染miR-195 mimics后,A549细胞的早期凋亡率增加(P<0.05),表明过表达miR-195可明显促进肺癌A549细胞的凋亡,见图1D。
Transwell实验结果显示,与对照组比较,转染miR-195 mimics后A549细胞的迁移率减少(P<0.05),表明过表达miR-195可明显抑制肺癌A549细胞的迁移能力,见图1E。
3 过表达 miR-195降低细胞周期与凋亡相关蛋白的水平
Western blot结果显示,相较于对照组,转染miR-195 mimics后A549细胞中cyclin D1、CDK2、p-Rb及 Bcl-2的蛋白水平显著降低(P<0.05),见图2。
4 miR-195靶基因的预测及验证
首先通过生物信息学的方法预测miR-195的可能靶基因,对常用且权威的靶基因预测数据库TargetScan、PicTar、miRDB和miRanda进行检索后结合已报道的文献,得到了预测值较高的靶点MYB。MYB与miR-195的结合位点如图3A所示。
图3B显示A549细胞中转入miR-195 mimics之后,MYB的mRNA和蛋白表达均显著降低(P<0.05)。图3C显示,与对照组相比,在WT-3’UTR组转入miR-195 mimics后萤光素酶的活性降低(P<0.05);而MUT-3’UTR组转入miR-195 mimics并不会抑制萤光素酶的活性,表明miR-195可直接作用于MYB基因的3’UTR区域来抑制其表达。
5 过表达MYB部分逆转miR-195的作用
同时将miR-195 mimic和pcDNA3-MYB转入A549细胞之后,MYB的表达明显高于对照组(P<0.05),见图4A。生物学行为检测结果显示,转染pcDNA3-MYB后,细胞活力明显升高(P<0.05,图4B);早期凋亡率较对照组降低(P<0.05,图4C);迁移率较对照组升高(P<0.05,图4D)。以上结果表明,MYB过表达可部分逆转miR-195对A549细胞生物学行为的调控作用。
讨 论
miR-195对不同肿瘤所发挥的作用亦不尽相同,早期的研究表明,在肺癌中miR-195呈低表达状态,可能发挥抑癌基因样作用。本研究探讨了miR-195对肺腺癌A549细胞生物学行为的调控作用。CCK-8细胞活力检测和流式细胞术周期检测的结果显示,转染miR-195 mimic后,A549细胞的活力降低,且细胞的周期进程出现明显的G1/S阻滞;表明miR-195可抑制A549细胞生长。进一步的细胞凋亡分析发现,转染miR-195 mimic可促进A549细胞凋亡。此外,Transwell的结果显示,miR-195可抑制A549细胞的迁移能力,提示miR-195可能通过抑制肺癌A549细胞活力及迁移能力并促进细胞凋亡,抑制肺癌的进一步发展,进而发挥抑癌作用。
关于miR-195调控A549细胞生物学行为的相关机制目前并没有系统的研究。多数miRNA在调控肿瘤细胞增殖及周期时,均涉及到周期相关蛋白表达的变化;Luo等[10]在结肠癌细胞SW480中发现过表达miR-195可抑制CDK8的表达;此外,在宫颈癌细胞HeLa和C33A中miR-195可调控cyclinD1a进而影响细胞的周期进程[11]。本实验中,我们发现转染miR-195 mimic后,A549细胞中周期相关蛋白cyclin D1、CDK2和p-Rb的蛋白水平均显著降低。Bcl-2则是一种公认的抗凋亡因子[12],我们的研究发现,过表达miR-195可抑制A549细胞中Bcl-2的表达,说明miR-195的促凋亡作用可能与调控Bcl-2的表达相关。由此推测,对周期及凋亡相关因子的影响可能是miR-195调控A549细胞生物学行为的路径之一。
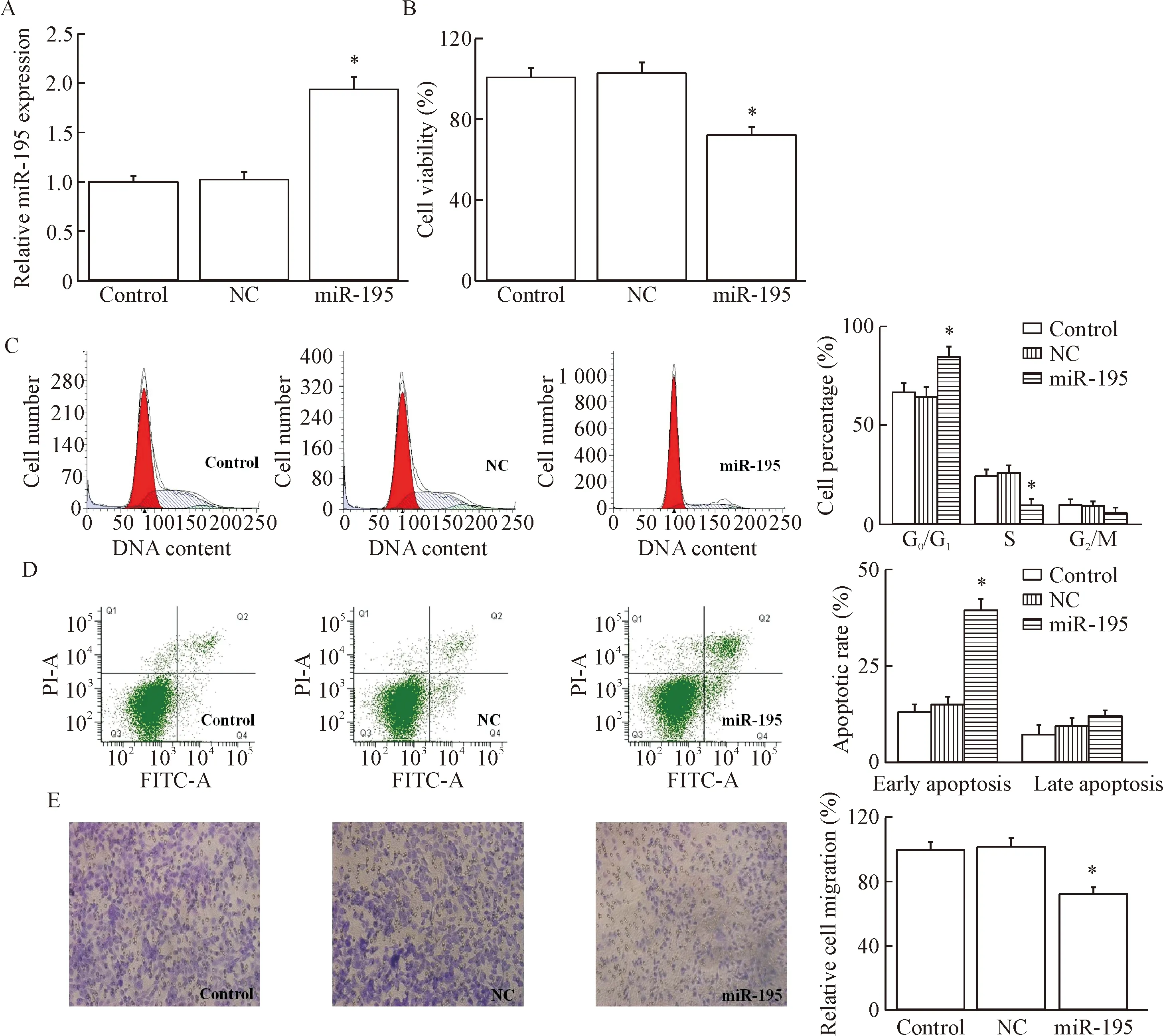
Figure 1.The effects of miR-195 on the biological behaviors in the A549 cells.A:detection of the transfection efficiency; B:the effect of miR-195 on the viability in the A549 cells; C:the effect of miR-195 on the cell cycle distribution of A549 cells; D:the effect of miR-195 on the apoptosis of A549 cells; E:the effect of miR-195 on migration ability in the A549 cells (×200).Mean±SD.n=6.*P<0.05vscontrol group.
图1miR-195对A549细胞生物学行为的影响
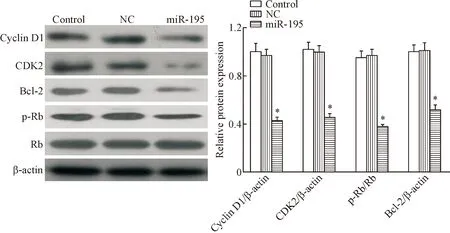
Figure 2.The effect of miR-195 over-expression on the expression levels of the cell cycle-and apoptosis-related proteins in the A549 cells.Mean±SD.n=6.*P<0.05vscontrol group.
图2过表达miR-195对A549细胞周期及凋亡相关蛋白表达的影响

Figure 3.Validation ofMYBas a target gene for miR-195.A:miR-195 seed sequence and its complementary binding site in MYB 3’UTR; B:the effect of miR-195 over-expression on the mRNA and protein expression of MYB in the A549 cells; C:the relative luciferase activity in transfected A549 cells.Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vspsiCHECK-2 group.
图3MYB可能是miR-195靶基因的验证实验结果

Figure 4.MYBover-expression partially reversed the effects of miR-195.A:the over-expression efficiency of pcDNA3-MYB; B:the effect ofMYBover-expression on the cell viability; C:the effect of MYB over-expression on the apoptosis; D:the effect ofMYBover-expression on the cell migration ability (×200).Mean±SD.n=6.#P<0.05vsmiR-195 mimics+control group.
图4MYB过表达部分逆转miR-195的作用
众所周知,miRNAs一般是通过调控靶基因来实现其功能的[13],为进一步分析miR-195影响A549细胞生物学行为的分子机制,本实验对其靶基因进行了预测及验证。生物信息学分析显示MYB可能是miR-195的靶基因,且MYB可能与miR-195结合(结合位点如图3A所示)。对MYB基因进行文献检索发现其是一种直接转录因子,在多种肿瘤中高表达,发挥原癌基因样作用,并可通过激活Bcl-2和c-Myc等一系列复杂的信号通路网络调控细胞的增殖、周期、迁移及凋亡等生物学行为[14-16]。本实验在A549细胞中同时转入miR-195 mimic和MYB过表达质粒对MYB的功能进行了进一步的验证,结果显示共转染可部分逆转miR-195对细胞增殖、迁移的抑制作用和其凋亡促进作用,表明MYB是miR-195的靶基因。但是中间涉及的具体机制及信号通路还需进一步深入的研究。
[参考文献]
[1]Albaba H,Lim C,Leighl NB.Economic considerations in the use of novel targeted therapies for lung cancer:review of current literature[J].Pharmacoeconomics,2017,35(12):1195-1209.
[2]Yu N,Zhang Q,Liu Q,et al.A meta-analysis:micro-RNAs’ prognostic function in patients with nonsmall cell lung cancer[J].Cancer Med,2017,6(9):2098-2105.
[3]Du X,Zhang J,Wang J,et al.Role of miRNA in lung cancer-potential biomarkers and therapies[J].Curr Pharm Des,2018,23(39):5997-6010.
[4]He JF,Luo YM,Wan XH,et al.Biogenesis of miRNA-195 and its role in biogenesis,the cell cycle,and apoptosis[J].J Biochem Mol Toxicol,2011,25(6):404-408.
[5]Li Y,Di C,Li W,et al.Oncomirs miRNA-221/222 and tumor suppressors miRNA-199a/195 are crucial miRNAs in liver cancer:a systematic analysis[J].Dig Dis Sci,2016,61(8):2315-2327.
[6]Shuang Y,Li C,Zhou X,et al.Expression of miR-195 in laryngeal squamous cell carcinoma and its effect on proli-feration and apoptosis of Hep-2[J].Eur Rev Med Pharmacol Sci,2017,21(14):3232-3238.
[7]Song R,Cong L,Ni G,et al.MicroRNA-195 inhibits the behavior of cervical cancer tumors by directly targeting HDGF[J].Oncol Lett,2017,14(1):767-775.
[8]Su K,Zhang T,Wang Y,et al.Diagnostic and prognostic value of plasma microRNA-195 in patients with non-small cell lung cancer[J].World J Surg Oncol,2016,14(1):224.
[9]Gao X,Dai M,Li Q,et al.HMGA2 regulates lung can-cer proliferation and metastasis[J].Thorac Cancer,2017,8(5):501-510.
[10] Luo Q,Zhang Z,Dai Z,et al.Tumor-suppressive microRNA-195-5p regulates cell growth and inhibits cell cycle by targeting cyclin dependent kinase 8 in colon cancer[J].Am J Transl Res,2016,8(5):2088-2096.
[11] Wang N,Wei H,Yin D,et al.MicroRNA-195 inhibits proliferation of cervical cancer cells by targeting cyclin D1a[J].Tumour Biol,2016,37(4):4711-4720.
[12] Zhu J,Ye Q,Chang L,et al.Upregulation of miR-195 enhances the radiosensitivity of breast cancer cells through the inhibition of Bcl-2[J].Int J Clin Exp Med,2015,8(6):9142-9148.
[13] Liu B,Li J,Cairns MJ.Identifying miRNAs,targets and functions[J].Brief Bioinform,2014,15(1):1-19.
[14] Zhou C,Chen Y,Wu Z,et al.Genome-wide analysis of theMYBgene family in physic nut (JatrophacurcasL.) [J].Gene,2015,572(1):63-71.
[15] Uttarkar S,Frampton J,Klempnauer KH.Targeting the transcription factor Myb by small-molecule inhibitors[J].Exp Hematol,2017,47:31-35.
[16] Musa J,Aynaud MM,Mirabeau O,et al.MYBL2 (B-Myb):a central regulator of cell proliferation,cell survi-val and differentiation involved in tumorigenesis[J].Cell Death Dis,2017,8(6):e2895.
