青羊参凝乳剂提取及其对乳饼制作工艺的影响
2018-04-02杨子彪
穆 硕 罗 洁 杨子彪 肖 晨 桑 跃
(1.中国农业大学北京食品营养与人类健康高精尖创新中心, 北京 100083;2.大理农林职业技术学院食品工程与经管系, 大理 671003;3.中国农业大学教育部北京市共建功能乳品重点实验室, 北京 100083; 4.河北省畜产食品工程技术中心, 三河 065200)
0 引言
乳饼是云南少数民族地区的一种传统奶酪制品,具有鲜美的味道和独特的口感,被称为“中国奶酪”[1-2],深受消费者喜爱。目前乳饼的生产大多为手工作坊式生产,工艺落后,没有现代奶酪加工的凝乳酶,只是采用当地的鲜青羊参叶作为凝乳剂,制作的乳饼得率低,产品品质不稳定。
青羊参(CynanchumotophyllumSchneid.)是萝藦科鹅绒藤属多年生草质藤本植物,分布于云南、四川和西藏、贵州、广西、湖南等省区[3]。目前关于青羊参的研究大多集中在其药理作用和提取物成分分析[4-5],青羊参已分离鉴定出来的成分多为青羊参皂苷及其皂苷元素,具有抗癫痫作用。云南少数民族在长期的生产实践中发现了其具有较好的凝乳作用,因此,将其作为制作乳饼的原料。但是凝乳机理尚未阐明,其有效凝乳成分的提取及应用条件也未见报道。
作为一种即食型的新鲜奶酪,凝乳的好坏直接影响乳饼的得率、质构及感官品质。传统乳饼是一种典型的酸热辅助酶凝奶酪,即将鲜乳(羊乳或牛乳)加热煮沸后添加前次乳饼制作时排出的酸乳清或食用酸,并辅助添加凝乳剂凝结成块,压榨成型[6]。凝乳时使用的酸乳清多凭经验自然调制而成,其中微生物、酶系组成复杂,存在安全隐患,并极易导致污染和产品质量不稳定等问题。除了酸凝乳外,在云南省剑川、鹤庆等县市,当地人民将当地特色植物青羊参和贯筋藤浸泡液代替部分酸乳清,利用其中的植物凝乳酶凝乳制作乳饼[7]。由于青羊参和贯筋藤等浸泡液的配制工艺不规范,凝乳活力差异较大,其添加量也靠经验判断,没有统一的标准,难以达到工业化生产的要求。因此,制备符合标准化生产的乳饼凝乳剂具有重要的应用前景。
本文从青羊参提取温度、液料比及提取液种类入手,优化青羊参凝乳剂的提取条件,并将优化后提取的凝乳剂进行乳饼的制作,比较该方法与云南传统加工方法(酸凝和利用青羊参叶浸泡液凝乳)制得的乳饼组分、得率、质构特性和微观结构,以期为青羊参凝乳剂的开发及其在乳饼标准化生产中的应用提供参考。
1 材料与方法
1.1 材料与试剂
鲜牛乳:取自北京市沙河春山奶牛厂,蛋白质质量分数3.30%,脂肪质量分数3.75%。
青羊参叶:采自云南省大理市剑川县,由云南大理农林职业学院提供。自然晾干,放于-20℃冷冻保存。
1.2 主要仪器与设备
UV-2102 PC型紫外可见分光光度计,上海UNICO公司;Thermo Sorvall LYNX4000型低温高速离心机,美国Thermo Fisher Scientific公司;UF/UVPL 5124型超纯水仪,美国Pall公司;KDY-9830型凯氏定氮仪,北京思贝得机电技术研究所;TMS Pro型质构仪,美国Food Technology Corporation公司;A1Rsi型激光共聚焦显微镜,日本尼康公司。
1.3 方法
青羊参蛋白酶的提取条件参照王红燕等[7]的方法并做部分修改,具体如下。
1.3.1青羊参叶子提取温度
选用4℃、55℃和25℃(室温)3种温度研究不同温度处理对青羊参叶子凝乳效果的影响,实验方案如下:称取3份相同质量的青羊参叶子,分别于4、25、55℃静置40 min平衡温度,后将青羊参干叶子剪碎,以液料比20 mL/g加入pH值6.5的10 mmol/L柠檬酸-磷酸缓冲液,混匀后分别于4、25、55℃浸提2 h(每20 min振荡1 min),然后用4层纱布过滤去除叶子,滤液于4℃、8 000g离心40 min除杂,上清液用0.22 μm滤膜过滤,微滤液通过10.0 kD超滤管浓缩分离(前期预实验结果得知10.0 kD超滤管效果最好),取上层截留液获得青羊参蛋白酶浓缩液,随后以体积比1∶20分别加入12 g/mL脱脂还原乳(含10 mmol/L CaCl2)混匀后放置于30℃水浴锅,观察并记录形成凝块所需要的时间即为凝乳时间。
1.3.2青羊参叶子提取液料比
选取10、20、30 mL/g 3种液料比探究其对青羊参叶子蛋白酶提取效果的影响。实验方案如下:将青羊参干叶子剪碎,分别以液料比10、20、30 mL/g加入pH值6.5的10 mmol/L柠檬酸-磷酸缓冲液,混匀于4℃浸提2 h(每20 min振荡1 min),然后用4层纱布过滤去除叶子。滤液于4℃、8 000g离心40 min除杂,上清液用0.22 μm滤膜过滤,微滤液通过10.0 kD超滤管浓缩分离。采用考马斯亮蓝法[8]测定浓缩液蛋白含量,并用12 g/mL脱脂还原乳观察凝乳时间。
1.3.3青羊参叶子提取溶液
选用柠檬酸-磷酸缓冲液和超纯水研究不同提取溶液对提取效果的影响。实验方案如下:将叶子剪碎后,以液料比20 mL/g加入超纯水、pH值6.5的10 mmol/L 柠檬酸-磷酸缓冲液(含150 mmol/L NaCl、1 mmol/L Cys和EDTA),混匀,于4℃浸提2 h(每20 min振荡1 min),然后用4层纱布过滤,滤液于4℃、8 000g离心40 min除杂,上清液用0.22 μm滤膜过滤,微滤液通过10.0 kD超滤管浓缩分离,取上层截留液获得青羊参蛋白酶浓缩液。采用考马斯亮蓝法[8]测定浓缩液蛋白含量,并用12 g/mL脱脂还原乳观察凝乳时间。
1.3.4凝乳活性测定
凝乳活性鉴定参照BRUTTI等[9]的方法并略做修改。12 g/mL脱脂还原乳(含10 mmol/L CaCl2)1 mL加入0.1 mL酶液混匀后置于37℃条件下,观察并记录凝乳时间。一个凝乳活力单位定义为在特定温度下40 min凝结1 mL中乳所需酶的量,用索氏单位(U)表示。计算公式为
N=2 400V0/(Vt)
(1)
式中N——凝乳活力
V0——加入底物的体积,mL
V——加入蛋白酶溶液的体积,mL
t——凝乳时间,s
1.3.5青羊参凝乳剂制备
确定以上最优提取条件后,在最适温度下,用选定的提取液以最佳液料比浸提2 h(每20 min振荡1 min),然后用4层纱布过滤,滤液于4℃、8 000g离心40 min除杂,上清液用0.22 μm滤膜过滤,微滤液通过10.0 kD超滤管浓缩分离,取上层截留液获得青羊参凝乳剂,测定其凝乳活力。
1.3.6传统叶子浸泡液制备
将传统酸凝制作乳饼时排出的乳清,经3 000g离心20 min后,按液料比20 g/mL浸泡青羊参叶子12 h,备用。
1.3.7乳饼制作
3L原料奶经过滤杂后于63℃加热30 min进行巴氏杀菌,升温至80℃,分别加入50%乳酸、1.5%浸泡液和1.5%青羊参凝乳剂,调节pH值至开始凝乳。加入乳酸时要缓慢并保持搅拌,防止局部pH值较高提前出现凝块。3组凝乳20 min后用8层纱布过滤,并用纱布将凝块包住,600 kPa挤压6 h压制成型。
1.3.8乳饼理化指标测定
采用干燥法(GB 5009.3—2016)测定含水率;采用凯氏定氮法(GB 5009.5—2016)测定蛋白质含量;采用罗兹-哥特里法(GB 5009.6—2016)测定脂肪含量。
1.3.9乳饼得率、蛋白质回收率和脂肪回收率测定
乳饼得率、蛋白质回收率和脂肪回收率计算公式为
Y=Mc/Mr×100%
(2)
Rp=McCp/(MrCrp)×100%
(3)
Rf=McCf/(MrCfr)×100%
(4)
式中Y——乳饼得率,%
Mc——乳饼质量,g
Mr——原料乳质量
Rp——蛋白质回收率,%
Cp——乳饼蛋白质质量分数,%
Crp——原料乳蛋白质质量分数,%
Rf——脂肪回收率,%
Cf——乳饼脂肪质量分数,%
Cfr——原料乳脂肪质量分数,%
1.3.10乳饼质构特性测定
乳饼质构测定参照WANG等[10]的TPA质构分析法,将乳饼样品切割成1 cm×1 cm×1 cm的小方块,采用二次下压法进行测定,具体参数如下:探头类型为P/25,测试速度为0.4 mm/s,样品变形量为30%,触发力为0.2 N,2次压缩间隔时间5 s。
1.3.11乳饼微观结构测定
参照LOPEZ等[11]的方法:从乳饼样品切下5 mm×5 mm×2 mm的薄片置于载玻片上。用胶头滴管吸取1.0 g/L的快绿超纯水溶液滴至样品上,在暗盒中充分染色5 min后用滴管吸取0.1 g/L的尼罗红乙醇溶液滴至样品上,在暗盒中继续染色5 min。染色完成后用纯水从样品一角缓缓冲洗3遍以洗净染料,清洗结束后覆盖盖玻片,倒置于显微镜下用60倍油镜观察。尼罗红与快绿的激发波长分别为488 nm与633 nm。调整至视野清晰后采集图片。
1.3.12数据分析
每组实验均重复3次并取平均值。实验数据采用Excel整理和制图,SPSS 17.0统计软件进行单因子方差分析,各表中数值以平均值±标准差表示,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 青羊参蛋白酶提取方法评价
2.1.1温度处理对提取效果的影响
青羊参叶子在55℃处理40 min后,其所需要的凝乳时间是(110.37±3.48) min,是4℃处理下凝乳时间((15.93±0.67) min)的7倍,结果表明55℃处理40 min会使青羊参叶子凝乳作用显著减弱;25℃处理组的凝乳时间是(40.58±1.39) min,是4℃组的3倍。陶亮等[12]在开发贯筋藤植物凝乳剂时发现其最佳提取温度为55℃;但多数研究表明,较高温度处理可导致蛋白酶活性降低甚至丧失[13]。AHMED等[14]提取茄属橙色虎眼新鲜种子中的凝乳酶时发现最佳提取温度是4℃。本研究结果表明,青羊参叶的最佳提取温度为4℃,为维持青羊参蛋白酶的活性,青羊参在采摘后应保存在4℃条件下,且提取过程中需要严格控制低温。
2.1.2液料比对提取效果的影响
液料比是蛋白酶提取条件中的重要因素,一方面液料比升高会增加蛋白酶的溶出效率,另一方面随着液料比的升高,蛋白酶的浓度会降低,从而影响酶的稳定性和活性[15]。GUIAMA等[16]提取茄属果实中蛋白酶的最佳液料比为10 mL/g;王红燕等[7]研究贯筋藤茎中凝乳酶的提取工艺发现其最佳提取的液料比为20 mL/g。在本研究中,液料比10、20、30 mL/g组的凝乳活力分别为(147.7±1.98)U/mg、(213.6±3.42)U/mg、(204.2±2.87)U/mg,20 mL/g组的青羊参蛋白酶浓缩液的凝乳活力最大。
2.1.3提取溶液对提取效果的影响
MAZORRA-MANZANO等[17]从酸橙柑橘的花中提取植物凝乳酶时确定的最佳提取液为pH值6.5的10 mmol/L 柠檬酸-磷酸缓冲液(含150 mmol/L NaCl、1 mmol/L Cys和EDTA);而在云南传统乳饼加工中通常使用超纯水进行青羊参中酶的提取[6-7]。本研究结果如表1所示,相比于超纯水浸提提取,pH值6.5的10 mmol/L柠檬酸-磷酸缓冲液提取得到的蛋白酶溶液凝乳活力较高((213.6±3.42) U/mg),且蛋白含量高出一倍,这是由于蛋白酶在低盐溶液中的溶解度高于超纯水[18],用柠檬酸-磷酸缓冲液可以提取更多蛋白酶。因此确定青羊参蛋白酶的提取溶液为柠檬酸-磷酸缓冲液。
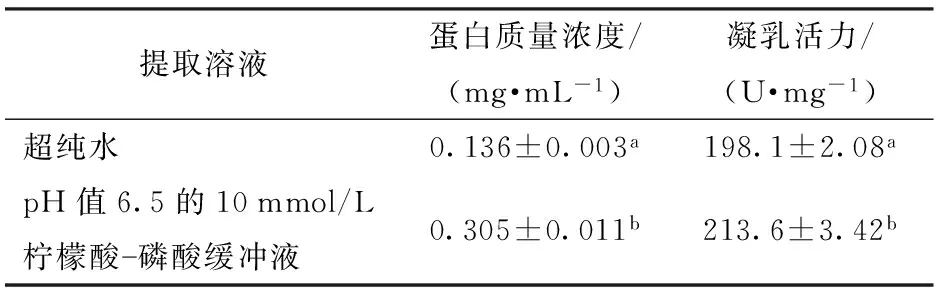
表1 不同提取溶液对提取效果的影响Tab.1 Effect of different extraction solutions on Cynanchum otophyllum leaves
注:同列不同字母表示数据差异显著(P<0.05)。
综合考虑温度、液料比和提取溶液对提取效果的影响,最终确定蛋白酶提取工艺为:液料比20 mL/g,提取液为pH值6.5的10 mmol/L柠檬酸-磷酸缓冲液,浸提温度为4℃。制备的青羊参蛋白酶凝乳剂凝乳活力为(213.6±3.42) U/mg,显著高于文献中报道的植物凝乳酶木瓜蛋白酶的凝乳活力((100.2±1.67) U/mg),与菠萝蛋白酶的凝乳活力((222.2±3.21) U/mg)相近[19]。因此,青羊参蛋白酶具备广阔的开发和应用前景,可用于乳饼的工业化生产。
2.2 乳饼的理化指标、回收率及得率
凝乳是乳饼制作中最关键的工艺,显著影响乳饼的组分和质构。根据酪蛋白胶束稳定性破坏的原理,凝乳可分为酸凝、酶凝和酸酶共促3种。酸凝是指酪蛋白胶束随着体系pH值的下降而解离,解离后酪蛋白相互聚合重新形成酸凝胶[20]。酶凝是指表面的κ-酪蛋白在蛋白酶的作用下水解释放酪蛋白巨肽,酪蛋白胶束空间位阻减小,在钙桥的作用下酪蛋白聚集从而形成酶凝胶[21]。在酸酶共促的凝乳过程中,酸化与凝乳酶共同作用诱导凝乳的形成。酸酶共促形成的凝胶中存在钙桥,可以增强凝胶结构的强度,酸酶共促的方法也因此有更加广泛的应用[22]。乳饼凝乳结构的强弱对乳饼的理化组成影响显著[23]。
乳饼中主要固形物是蛋白质和脂肪,研究其含量、回收率及乳饼得率对于乳饼的工业化生产有重要意义[24]。3组凝乳方法制作出乳饼的理化性质如表2所示,传统酸凝组和青羊参凝乳剂组制得乳饼的含水率和蛋白质质量分数没有显著差异(P>0.05),但青羊参凝乳剂组的脂肪质量分数更高;传统浸泡组的蛋白质质量分数和脂肪质量分数最低但含水率最高。对于回收率而言,青羊参凝乳剂组有最高的蛋白质回收率((83.84±2.32)%)和脂肪回收率((78.31±1.98)%),较传统浸泡组分别提高了20.26和33.04个百分点。该结果与青羊参凝乳剂组有较高的蛋白质和脂肪质量分数一致,且说明使用青羊参凝乳剂可以有效减少乳饼制作过程中蛋白质和脂肪的损失;传统酸凝组与传统浸泡组的得率没有显著差异(P>0.05),而青羊参凝乳剂组得率较其他两组显著提升,提高了3个百分点左右。

表2 不同凝乳方法制得乳饼的组分含量、回收率及得率Tab.2 Compositions, yield and recovery rate of milk cake made by different coagulants %
注:不同字母表示同一行数据之间差异显著(P<0.05)。
2.3 乳饼质构特性
质构是影响消费者购买乳饼的关键品质之一。其中,硬度是奶饼质构特性的重要指标,乳饼属于新鲜干酪,硬度不能过软也不能过硬[25]。3组乳饼的硬度如表3所示:传统酸凝组的硬度最高;使用蛋白酶凝乳剂制作乳饼可减小乳饼的硬度,使其质地更加柔软;传统浸泡组的硬度最低。含水率和脂肪含量以及乳饼凝乳方式影响乳饼结构,进而影响乳饼的硬度[26]。
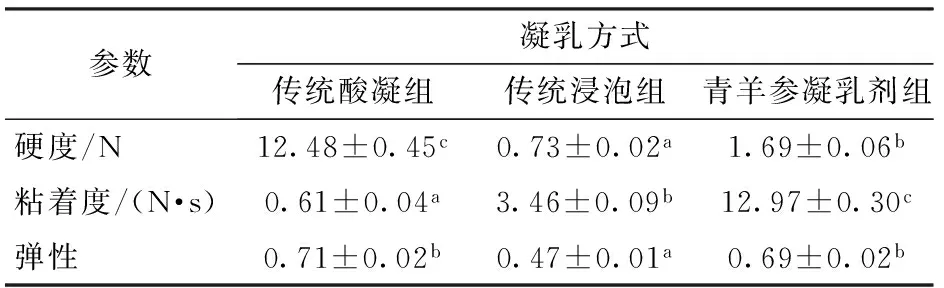
表3 不同凝乳方法制得乳饼的质构特性Tab.3 Texture properties of milk cake made by different coagulants
注:不同字母表示同一行数据之间差异显著(P<0.05)。
传统酸凝组和青羊参凝乳剂组的弹性没有显著差异(P>0.05);传统浸泡液组的弹性最小(0.47±0.01),其原因是传统浸泡液组的乳饼含水率很高,体系中很多蛋白质之间的键可以松弛和重组,导致了酪蛋白网状结构的更快重组[27],在下压后酪蛋白网络结构快速重组,回弹程度低,弹性小。
粘着度是乳饼的重要感官评价指标之一,由表3可以看出传统酸凝组的粘着度最低。乳饼的粘着度受其凝胶结构强度的影响[28],在酸凝工艺的pH值条件下,酪蛋白胶束中以磷酸钙形式存在的钙离子完全释放[27],在酸酶共促的pH值条件下,酪蛋白胶束中还存磷酸钙[29],在凝胶过程中还可形成钙桥。相较氢键和疏水作用力形成的凝胶结构,拥有钙桥的凝胶结构拥有更高的强度,因而具有较大的粘着度[30]。传统浸泡组的乳饼粘着度比青羊参凝乳剂组的小,这是因为传统浸泡组乳饼中含有大量水分且乳饼的结构不固定,挤压时会有大量的水渗出,降低了乳饼的粘着度。
2.4 乳饼微观结构
利用激光共聚焦荧光显微镜,对用不同加工工艺制得乳饼的微观结构进行观测,结果如图1所示,其中红色荧光表示脂肪球,绿色荧光代表蛋白质。传统酸凝组制作的乳饼酪蛋白网络分布不均,酪蛋白胶束结构致密,酪蛋白基质强度较大,而脂肪形成大块游离油脂浮于酪蛋白胶束网络之外(图1a),从而导致乳饼硬度较大[31],这也与质构特性的结果一致(表3)。

图1 不同加工方法制得乳饼的微观结构Fig.1 Microstructures of milk cake made by different coagulants
传统浸泡组制得的乳饼酪蛋白结构松散,未形成较强的交联结构,大量脂肪在凝乳过程中随乳清排出,剩余的脂肪不均匀地分布在角落的酪蛋白网络中(图1b)。这种松散的凝胶结构也导致了传统浸泡组乳饼硬度小、弹性小等质量缺陷。这是由于浸泡无法高效提取青羊参中的凝乳成分,且浸泡液中杂质较多,制得的乳饼无法固定成型,酪蛋白形成的网络结构松散且易被破坏,不能对脂肪球起到有效的锁定作用,脂肪多以游离脂肪的形式存在,游离在乳清通道,并在乳饼挤压成型时随水分流出较多,损失较大,这与传统浸泡组脂肪含量低、脂肪回收率低等结果一致(表2)。
青羊参凝乳剂组的乳饼酪蛋白网络结构均一,粒径一致的脂肪球均匀地镶嵌在酪蛋白网络中(图1c),这种结构可以赋予乳饼更加柔软的质地和细腻的口感[25]。与传统酸凝组、传统浸泡组相比,添加青羊参凝乳剂可以形成孔隙更加均一的酪蛋白网络结构,增强对脂肪球的锁定效果,从而提高脂肪回收率,降低乳饼的硬度,使乳饼质地更加柔软。
3 结束语
从云南特色植物青羊参中提取有效凝乳成分制备新型凝乳剂,并将其应用于云南传统乳饼的制作。青羊参蛋白酶最佳提取工艺为:青羊参叶子以液料比20 mL/g浸泡在柠檬酸-磷酸缓冲液中于4℃浸提2 h。与传统乳饼制作方法相比,使用青羊参凝乳剂可以显著提高乳饼的蛋白、脂肪回收率及得率;所制得的乳饼有更均匀、细致的凝乳结构,更适宜的硬度和较高的粘着度。研究结果为青羊参凝乳剂的应用及云南传统乳饼工业化生产提供了理论依据。
1艾磊.马可波罗的遗憾——记中国少数民族的奶酪[J].今日民族, 2002(12):35-37.
2刘红霞. 云南省剑川县乳饼的化学和微生物组成分析及乳酸菌的分离鉴定[D]. 呼和浩特:内蒙古农业大学,2007.
LIU Hongxia. Chemical and microbiological compositions and identification of lactic acid bacteria from milk cake of Jianchuan in Yunnan[D].Huhhot: Inner Mongolia Agricultural University, 2007. (in Chinese)
3中国科学院中国植物志编辑委员会. 中国植物志: 第63卷[M].北京: 科学出版社,1977: 377.
4裴印权, 曹龙光, 谢淑娟, 等. 青羊参的中枢药理作用[J]. 北京医学院学报, 1981, 22(3): 213-218.
5姜海鸥, 黄雪霜,王斌, 等. 青羊参多糖硫酸酯体外抗单纯疱疹病毒Ⅱ型活性研究[J]. 时珍国医国药, 2008, 19(3): 674-675.
JIANG Haiou, HUANG Xueshuang, WANG Bin, et al. Anti-HSV-Ⅱactivity of sulfated polysaccharide fromCynanchumotophyllumSchneid. in vitro[J]. Lishizhen Medicine and Materia Medica Research, 2008, 19(3): 674-675. (in Chinese)
6吴少雄, 王保兴, 郭祀远, 等. 云南撒尼族乳饼的研制[J]. 中国乳品工业, 2005(7):18-19.
WU Shaoxiong, WANG Baoxing,GUO Siyuan, et al. Research on the dairy cake in Yunnan[J]. China Dairy Industry, 2005(7): 18-19. (in Chinese)
7王红燕, 陶亮, 陈森, 等. 贯筋藤鲜茎中凝乳酶的提取工艺研究[J]. 中国酿造, 2015, 34(3): 34-37.
WANG Hongyan, TAO Liang, CHEN Sen, et al. Extraction process of rennet from fresh stalk ofDregeasinensisHemsl[J]. China Brewing, 2015, 34(3): 34-37. (in Chinese)
8BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254.
9BRUTTI C B, PARDO M F, CAFFINI N O, et al.OnopordumacanthiumL. (Asteraceae) flowers as coagulating agent for cheesemaking[J]. LWT—Food Science and Technology, 2012, 45(2): 172-179.
10WANG F, ZHANG X, LUO J, et al. Effect of proteolysis and calcium equilibrium on functional properties of natural cheddar cheese during ripening and the resultant processed cheese[J]. Journal of Food Science, 2011, 76(3): E248-E253.
11LOPEZ C, CAMIER B, GASSI J Y. Development of the milk fat microstructure during the manufacture and ripening of emmental cheese observed by confocal laser scanning microscopy[J]. International Dairy Journal, 2007, 17(3): 235-247.
12陶亮, 王红燕, 聂燕粉, 等. 贯筋藤新型凝乳剂的研究[J]. 食品工业, 2015, 36(11): 88-92.
TAO Liang, WANG Hongyan, NIE Yanfen, et al. Study on the new resource of milk coagulant fromDregeasinensis(Hemsl.)[J]. The Food Industry, 2015, 36(11): 88-92. (in Chinese)
13LO PIERO A R, PUGLISI I, PETRONE G. Characterization of “lettucine”, a serine-like protease fromLactucasativaleaves, as a novel enzyme for milk clotting [J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2439-2443.
14AHMED I M, MORISHIMA I, BABIKER E E, et al. Characterisation of partially purified milk-clotting enzyme fromSolanumdubiumFresen seeds[J]. Food Chemistry, 2009, 116(2): 395-400.
15EL-BELTAGY A E, EL-ADAWY T A, RAHMA E H, et al. Purifucation and characyerization of an alkaline protease from the viscera of bolti fish (Tilapianilotica)[J]. Journal of Food Biochemistry, 2005, 29(5): 554-558.
16GUIAMA V D, BEKA R G, NGAH E, et al.Milk-coagulating extract produced from solanum aethiopicum shum fruits: multivariate techniques of preparation, thermal stability and effect on milk solids recovery in curd[J]. International Journal of Food Engineering, 2014, 10(2): 211-222.
17MAZORRA-MANZANO M A, MORENO-HERNNDEZ J M, RAMREZ-SUAREZ J C, et al. Sour orangeCitrusaurantiumL. flowers: a new vegetable source of milk-clotting proteases[J]. LWT—Food Science and Technology, 2013, 54(2): 325-330.
18HASHIM M M, MINGSHENG D, IQBAL M F, et al. Ginger rhizome as a potential source of milk coagulating cysteine protease [J]. Phytochemistry, 2010, 72(6): 458-464.
19肖晨. 青羊参蛋白酶分离纯化及凝乳机理研究[D]. 北京: 中国农业大学, 2017.
XIAO Chen. Purification and milk-clotting mechanism ofCynanchumotophyllumSchneid. protease[D]. Beijing: China Agricultural University, 2017. (in Chinese)
20CHOI J,HORNE D S,LUCEY J A. Effect of insoluble calcium concentration on rennet coagulation properties of milk[J]. Journal of Dairy Science,2007,90(6): 2612-2623.
21罗洁, 任发政, 王紫薇, 等. 干酪质构与风味控制技术研究进展[J/OL]. 农业机械学报, 2016, 47(1): 190-201, 208.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20160125&flag=1.DOI:10.6041/j.issn.1000-1298.2016.01.025.
LUO Jie, REN Fazheng, WANG Ziwei, et al. Advances in control technology of cheese quality and texture[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(1): 190-201, 208. (in Chinese)
22JELEN P, RENZ-SCHAUEN A. Quarg manufacturing innovations and their effects on quality, nutritive value, and consumer acceptance[J]. Food Technology, 1989, 43(3): 74-81.
23PANDEY S, SENTHILGURU K, UVANESH K, et al. Natural gum modified emulsion gels as single carrier for the oral delivery of probiotic-drug combination[J]. International Journal of Biological Macromolecules, 2016, 92: 504-514.
24LIU X, ZHANG H, WANG F, et al. Rheological and structural properties of differently acidified and renneted milk gels [J]. Journal of Dairy Science, 2014, 97(6): 3292-3299.
25LUCEY J, JOHNSON M, HORNE D. Invited review: perspectives on the basis of the rheology and texture properties of cheese[J]. Journal of Dairy Science, 2003, 86(9): 2725-2743.
26陈娜, 刘显庭, 丁庆波, 等. 凝乳方式对奶油干酪品质的影响 [J]. 农业工程学报, 2013,29(2):287-291.
CHEN Na, LIU Xianting, DING Qingbo, et al. Effects of coagulation methods on quality of cream cheese[J]. Transactions of the CSAE, 2013, 29(2): 287-291.(in Chinese)
27ROMEIH E A, MICHAELIDOU A, BILIADERIS C G, et al. Low-fat white-brined cheese made from bovine milk and two commercial fat mimetics: chemical, physical and sensory attributes[J]. International Dairy Journal, 2002, 12(6): 525-540.
28OLSON N, JOHNSON M.Light cheese products: characteristics and economics[J]. Food Technology, 1990, 40(10): 93-96.
29BOUCHOUX A, DEBBOU B, GESAN-GUIZIOU G, et al. Rheology and phase behavior of dense casein micelle dispersions[J].The Journal of Chemical Physics, 2009, 131(16): 165106.
30DIMITRELI G, THOMAREIS A S. Texture evaluation of block-type processed cheese as a function of chemical composition and in relation to its apparent viscosity[J]. Journal of Food Engineering, 2007, 79(4):1364-1373.
31KATSIARI M C, VOUTSINAS L P. Manufacture of low-fat feta cheese[J]. Food Chemistry, 1994, 49(1): 53-60.
