iPSC-NSCs脑立体定向注射对脑出血大鼠脑血肿周围组织中IL-6、TGF-β1表达及神经功能的影响
2018-04-02孙石磊史长河许予明
秦 洁,马 丹,李 珠,孙石磊,杨 靖,史长河,宋 波,许予明
郑州大学第一附属医院神经内科 郑州 450052
脑卒中严重威胁人类健康, 是全球范围内导致人类死亡的第二大因素[1-2]。脑出血(intracerebral hemorrhage,ICH)是脑卒中患者发病和死亡的主要原因之一,病死率为30%~50%,并且近75%的幸存者1 a后不能独立生活[3]。针对ICH,现有的临床治疗手段主要是对症支持治疗(如降低血压、颅内压力或外科手术治疗等),治疗效果有限[4]。同时,ICH的病理生理机制非常复杂,目前仍不非常明确[5]。越来越多的证据[6-7]表明ICH急性期免疫炎症反应在继发性脑损伤中起重要作用,但临床上尚缺乏针对ICH继发性脑损伤的免疫调节干预方法。研究[8-9]表明诱导多能干细胞来源的神经干细胞(induced pluripotent stem cells derived neural stem cells, iPSC-NSCs)具有免疫调节和抗炎作用,能全面改善ICH预后。已有研究[10]证实IL-6可促进炎症反应和加重脑水肿,而TGF-β1则具有强大的免疫抑制作用。目前关于IL-6和TGF-β1在ICH后血肿组织周围表达水平的研究很少。本研究旨在探讨脑立体定向注射iPSC-NSCs对早期ICH模型大鼠神经功能及脑血肿周围组织中IL-6和TGF-β1表达的影响,为ICH的治疗提供实验依据。
1 材料与方法
1.1动物和细胞动物:选取清洁级雄性SD大鼠84只(250~300 g),均购自河南省实验动物中心(批号:41003100004315),大鼠的饲养及相关实验程序均经过郑州大学伦理委员会批准;细胞:大鼠iPSC由上海生命科学研究院肖磊研究员建立并提供,经郑州大学第一附属医院重点实验室诱导分化为iPSC-NSCs。
1.2主要试剂和仪器DMEM、DMEM/F12、胰蛋白酶、胎牛血清、青霉素-链霉素溶液(HyClone公司),氯胺酮、基质胶、Ⅶ型胶原酶(Sigma公司),大鼠脑立体定位仪(Narishige SN-3公司),倒置显微镜(LEICA公司),IL-6、TGF-β1 ELISA检测试剂盒(武汉谷歌生物科技有限公司),酶标检测仪(BioTeK公司),电子天平(上海梅特勒-托利多仪器有限公司)。
1.3动物分组及模型制作选取84只SD雄性大鼠,采用随机数字表法分为假手术组28只(采用立体定位仪仅定位穿刺,不注射Ⅶ型胶原酶和PBS溶液)、对照组28只(采用立体定位仪定位穿刺并注射Ⅶ型胶原酶,ICH后4~6 h在鉴定造模成功后注射PBS溶液)、实验组28只(采用立体定位仪定位穿刺注射Ⅶ型胶原酶,ICH后4~6 h在鉴定造模成功后,经脑立体定位注射含iPSC-NSCs的PBS溶液)。模型制作方法[7]:腹腔注射30 mg/kg氯胺酮麻醉SD大鼠,麻醉满意后将大鼠俯卧位固定在大鼠脑立体定位仪上,取大鼠左侧纹状体为定位点,选取前囟后0.5 mm,左侧旁开3.5 mm,垂直进针5.5 mm。以10 μL微量进样器缓慢注入0.5 U Ⅶ型胶原酶溶液,留针10 min,之后缓慢退针。针退出后,清洁创面,缝合头皮。模型成功的判定:术后大鼠完全苏醒后,采用mNSS评分对ICH模型大鼠进行神经功能缺损评估,mNSS评分>6分,且灌注区脑组织可见血肿形成,即为造模成功,选取mNSS 8~12分的ICH模型大鼠。神经功能缺损症状过轻无明显症状或过重出现意识障碍、移动困难或死亡的弃去,重新造模补入。
1.4iPSC-NSCs的培养在预铺C57/BL6小鼠胚胎成纤维细胞条件下传代培养iPSC,经差速贴壁法去除滋养层细胞,用拟胚体培养基继续培养iPSC形成拟胚体,经全反式维甲酸诱导分化为iPSC-NSCs, 用NSC培养基悬浮培养iPSC-NSCs, 经3~5 d连续传代培养2次后得到第3代iPSC-NSCs。将生长良好的第3代iPSC-NSCs 培养直至达到所需移植细胞数(105μL-1),在ICH后4~6 h将iPSC-NSCs立体定向注入ICH模型大鼠脑内。
1.5ICH模型大鼠的神经功能评分各组选10只ICH模型大鼠分别在术后第1、3、7、14和28天进行mNSS评分。
1.6脑血肿周围组织中IL-6、TGF-β1水平的测定
造模后分别在第1、3、7天,每个时间点取6只大鼠,麻醉满意后断头取脑组织标本,全部标本均以冰箱冻存。用ELISA法检测各组大鼠脑血肿周围组织中IL-6及TGF-β1。首先准确称取脑组织,加入生理盐水,在冰水浴条件下机械匀浆,制备成匀浆液,2 500~3 000 r/min离心10 min,取上清液,然后采用ELISA试剂盒进行检测,分别设空白孔、标准孔和样品孔,各孔中分别加入标准品或样品100 μL,封板膜封板,37 ℃孵育90 min,甩去孔内液体。每孔加入生物素化抗体工作液100 μL,封板膜封板,37 ℃孵育60 min,甩板并洗板3次;每孔加酶结合物工作液100 μL,封板膜封板,37 ℃孵育30 min,甩板并洗板3次;每孔加底物溶液(TMB)90 μL,封板膜封板,37 ℃避光孵育15 min左右。当标准孔出现明显梯度时,每孔加入终止液50 μL终止反应,立即用酶标仪在450 nm波长处检测OD值。最后以标准品孔OD值绘制标准曲线,根据标准曲线计算样品浓度。
1.7统计学处理采用SPSS 21.0进行数据分析。3组间IL-6和TGF-β1表达量的比较采用重复测量数据的方差分析。检验水准α=0.05。
2 结果
2.1iPSC-NSCs脑立体定向注射对ICH模型大鼠神经功能的影响假手术组大鼠在各时间点均未出现神经功能缺损症状;对照组及实验组大鼠在造模4~6 h苏醒后即出现对侧肢体瘫痪等神经功能缺损的表现,其症状、体征于术后第1天达到高峰,持续至第3天左右,而后随时间推移神经功能逐渐恢复。与对照组大鼠相比,实验组大鼠在造模术后第14天起评分较低,这一效果持续至第28天(图1)。
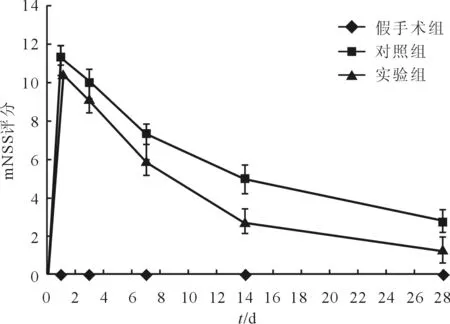
图1 3组大鼠mNSS评分比较
2.2iPSC-NSCs脑立体定向注射对ICH模型大鼠脑血肿周围组织中IL-6表达水平的影响见表1。
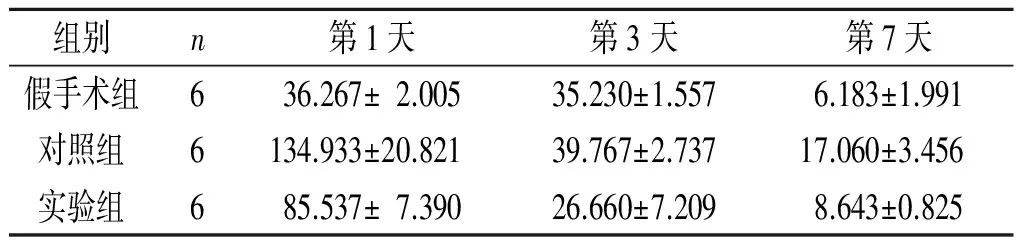
表1 3组大鼠脑血肿周围组织中IL-6的表达 ng/L
F组间=133.290,F时间=524.720,F交互=82.142,P均<0.001
2.3iPSC-NSCs脑立体定向注射对ICH模型大鼠脑血肿周围组织中TGF-β1表达水平的影响见表2。
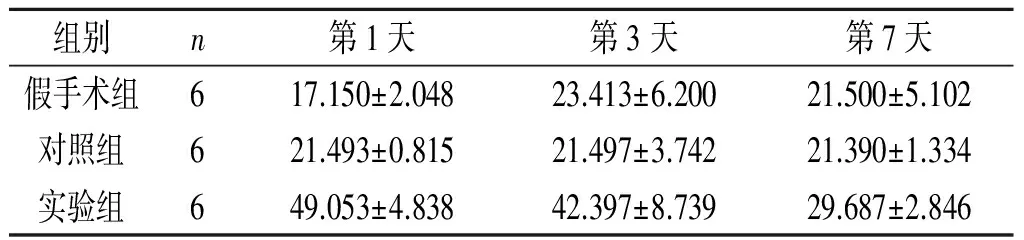
表2 3组大鼠脑血肿周围组织中TGF-β1的表达 ng/L
F组间=43.121,P<0.001;F时间=8.532,P=0.001;F交互=57.957,P<0.001
3 讨论
ICH是严重的脑卒中亚型,具有发病率、病死率、复发率和致残率“四高”的特点[3,5]。研究[11]表明急性ICH可激活免疫系统释放大量的炎症介质,引起脑内炎症反应,在ICH后的继发性脑损伤中起着重要的作用。急性脑血管病患者病情严重程度与其免疫功能存在一定联系,随着病情加重,机体免疫功能处于低下或抑制状态[12]。研究[13]显示,干细胞移植可减轻炎症反应、减少神经元的死亡、减轻瘢痕形成和促进脑白质的功能再塑,成为ICH模型治疗中有应用前景的选择之一。本研究中实验组脑立体定向注射iPSC-NSCs后第14和28天神经功能评分均优于对照组,从行为学上表明iPSC-NSCs移植在ICH大鼠中可产生脑保护作用,促进神经功能恢复,但其作用机制尚不明确。
ICH急性期血肿周围组织迅速发生炎症反应并表达多种细胞因子,其中比较重要的炎症介质有IL-6和TGF-β1。有学者[14]已证实这些炎性因子的浓度与ICH的严重程度及预后有密切关系。
IL-6 是一种多功能细胞因子,具有多种生物效应。目前关于IL-6与缺血性脑损伤的研究较多,但有关IL-6与ICH的研究较少。本实验结果显示,ICH后大鼠脑血肿周围组织中IL-6的表达大量增加,与对照组相比,实验组在脑立体定向注射iPSC-NSCs后,IL-6的表达下降,同时大鼠神经功能也得到改善,表明IL-6 参与ICH的炎症反应过程,脑组织中IL-6 浓度升高可能与ICH预后不良有关。
TGF-β1可以促进小胶质细胞的发育和稳态,调节小胶质细胞表型,延缓神经元死亡,诱导巨噬细胞通过SMAD2和SMAD3信号通路促进伤口愈合,维持免疫耐受,是最有可能的免疫“调解员”[11]。研究[15]表明,在小鼠脑缺血模型中,TGF-β1能够抑制神经细胞死亡,从而发挥神经保护作用,可显著增强脑梗死后小鼠神经功能的恢复,但TGF-β1在ICH中的作用尚不明确。本研究结果表明,与对照组大鼠相比,实验组大鼠在iPSC-NSCs脑立体定向注射后脑组织中TGF-β1的表达显著上升,且大鼠神经功能得到改善,表明TGF-β1可以抑制ICH后的炎症反应进而保护神经元。研究[11]表明急性ICH患者血清中 TGF-β1水平明显降低,但未明确原因。本研究结果表明有大量的TGF-β1在脑血肿周围组织中富集, 可能是血清中水平降低的原因之一。
综上所述,脑立体定向注射iPSC-NSCs可明显改善ICH模型大鼠的神经功能,其机制可能为iPSC-NSCs可调节大鼠脑内主要促炎因子IL-6及抑炎因子TGF-β1的表达,继而下调炎症反应诱发的急性ICH后继发性脑损伤。
[1] KIM JY,BAE HJ.Spontaneous intracerebral hemorrhage: management[J].J Stroke,2017,19(1):28
[2] 孟凡祥.某医院脑卒中患者发病影响因素调查[J].解放军预防医学杂志,2016,34(2):272
[3] KLEBE D,MCBRIDE D,FLORES JJ,et al.Modulating the immune response towards a neuroregenerative peri-injury milieu after cerebral hemorrhage[J].J Neuroimmune Pharmacol,2015,10(4):576
[4] GUAN J,HAWRYLUK GW.Targeting secondary hematoma expansion in spontaneous intracerebral hemorrhage:state of the art[J].Front Neurol,2016,7:187
[5] CORDEIRO MF,HORN AP.Stem cell therapy in intracerebral hemorrhage rat model[J].World J Stem Cells,2015,7(3):618
[6] ZHOU Y,WANG Y,WANG J,et al.Inflammation in intracerebral hemorrhage: from mechanisms to clinical translation[J].Prog Neurobiol,2014,115:25
[7] QIN J,MA X,QI HY,et al.Transplantation of induced pluripotent stem cells alleviates cerebral inflammation and neural damage in hemorrhagic stroke[J].PLoS One,2015,10(6):e129881
[8] MA X,QIN J,SONG B,et al.Stem cell-based therapies for intracerebral hemorrhage in animal model: a meta-analysis[J].Neurol Sci,2015,36(8):1311
[9] GAO L,LU Q,HUANG LJ,et al.Transplanted neural stem cells modulate regulatory T, gamma delta T cells and corresponding cytokines after intracerebral hemorrhage in rats[J].Int J Mol Sci,2014,15(3):4431
[10]MARTINEZ FO,GORDON S.The M1 and M2 paradigm of macrophage activation: time for reassessment[J].F1000Prime Rep,2014,6:13
[11]TAYLOR RA,CHANG CF,GOODS BA,et al.TGF-β1 modulates microglial phenotype and promotes recovery after intracerebral hemorrhage[J].J Clin Invest,2017,127(1):280
[12]WANG H,YAN FL,CUNNINGHAM M,et al.Potential specific immunological indicators for stroke associated infection are partly modulated by sympathetic pathway activation[J].Oncotarget,2016,7(32):52404
[13]OTTOBONI L,MERLINI A,MARTINO G.Neural stem cell plasticity:advantages in therapy for the injured central nervous system[J].Front Cell Dev Biol,2017,5:52
[14]张弢.血清炎性因子水平在急性脑出血恶化的预测价值[J].中国实验诊断学,2014,18(7):1077
[15]CEKANAVICIUTE E,FATHALI N,DOYLE KP,et al.Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice[J].Glia,2014,62(8):1227