慢性阻塞性肺疾病急性加重期和稳定期患者血清IL-8、TNF-α及免疫因子的检测
2018-04-02王林梅齐景宪冯青青
王林梅,齐景宪,冯青青
郑州大学第二附属医院呼吸内科 郑州 450014
慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)的发生,主要与慢性COPD基础上合并呼吸道病毒感染、细菌感染、自身免疫力下降等有关,近年来流行病学研究[1-2]显示,AECOPD的发病率可达345/10万~453/10万。在探讨AECOPD的发病机制的过程中发现,细胞炎症因子等的改变,可以通过诱导气道高反应性、促进呼吸道平滑肌细胞的持续性痉挛等,促进AECOPD患者的肺功能的障碍,加剧病情的进展。特别是白细胞介素-8(IL-8)、肿瘤坏死因子α(TNF-α)、淀粉样蛋白A(SAA)和干扰素G诱导蛋白10(IP-10)等的异常表达,可以加剧下游炎症信号通路ROCH等的激活,促进病情进展[3-5]。为了进一步探讨IL-8、IL-6、TNF-α和C反应蛋白(CRP)等生物学因子在AECOPD患者病情进展中的作用,本研究分析了相关指标的异常表达及其与患者肺功能的关系,现将结果报道如下。
1 对象与方法
1.1研究对象选取2015年2月至2016年12月郑州大学第二附属医院收治的AECOPD患者72例(AECOPD组)和COPD稳定期患者66例(COPD稳定期组)。纳入标准:①符合中华医学会呼吸分会制定的COPD及急性加重期、稳定期的诊断标准[3]。②患者及家属知情同意并签署同意书。排除标准:①合并支气管哮喘、支气管扩张、肺结核等肺部其他疾病。②合并有心脑血管疾病、糖尿病、恶性肿瘤等疾病。③近2周口服或吸入糖皮质激素。同时选取健康志愿者70例作为对照组。
1.2血清IL-8、IL-6及CRP、TNF-α、SAA、IP-10检测方法所有患者均于入院24 h内采集空腹静脉血约5 mL并分为2份。一份自然抗凝后以3 000 r/min离心10 min,取上清液采用酶联免疫吸附法测定血清中IL-8、IL-6水平,检测试剂盒购自北京中杉金桥生物技术有限公司,具体步骤严格按照试剂盒说明书进行操作;另一份分别加入CRP及TNF-α、SAA、IP-10检测试剂后,利用胶体金法检测血清中CRP及TNF-α、SAA、IP-10水平,试剂盒购自上海奥普生物医药有限公司,具体步骤严格按照试剂盒说明书进行。
1.3COPD评估测试(CAT)评分对AECOPD患者采用CAT问卷进行生活质量评分,CAT问卷包括咳嗽、咳痰、胸闷、爬坡或上一层楼梯的感觉、家务活动、离家外出信心程度、睡眠和精力等8个问题,对每项做出相应评分,每个问题根据其病情从轻到重依次为0~5分,计算总分,CAT分值范围为0~40分,分值越高,表明患者生活质量越差。
1.4肺功能检测采用德国柯斯达肺功能全自动测定仪检测,所有受试者检测时取坐位,上鼻夹,每位受试者均测试3次,结果取最佳曲线,每次测试间隔 3 min。检测项目包括: 用力肺活量(FVC)、第 1 秒用力呼气容积占预计值百分比(FEV1)、FEV1/FVC。为了减少不同操作者带来的误差,所有检测均由同一专业人员完成,在每次检测之前均根据当时的温度、湿度、气压对肺功能仪进行校正。
1.5统计学处理采用SPSS 19.0进行统计学处理。3组受试者年龄、体质指数、IL-8、IL-6、TNF-α、CRP、SAA、IP-10、FEV1和FEV1/FVC的比较均采用单因素方差分析,组间两两比较采用LSD-t检验;3组受试者性别构成的比较采用χ2检验;AECOPD患者FEV1、FEV1/FVC、CAT评分与IL-8、IL-6、TNF-α、CRP、SAA、IP-10的关系采用Pearson相关进行分析。检验水准α=0.05。
2 结果
2.13组受试者一般情况的比较3组受试者性别构成、年龄、体质指数差异均无统计学意义,见表1。
2.23组受试者血清IL-8、IL-6、TNF-α、CRP、SAA、IP-10水平的比较AECOPD组患者血清IL-8、IL-6、TNF-α和CRP、SAA、IP-10水平均高于COPD稳定期组和对照组,见表2。

表1 3组受试者一般情况比较
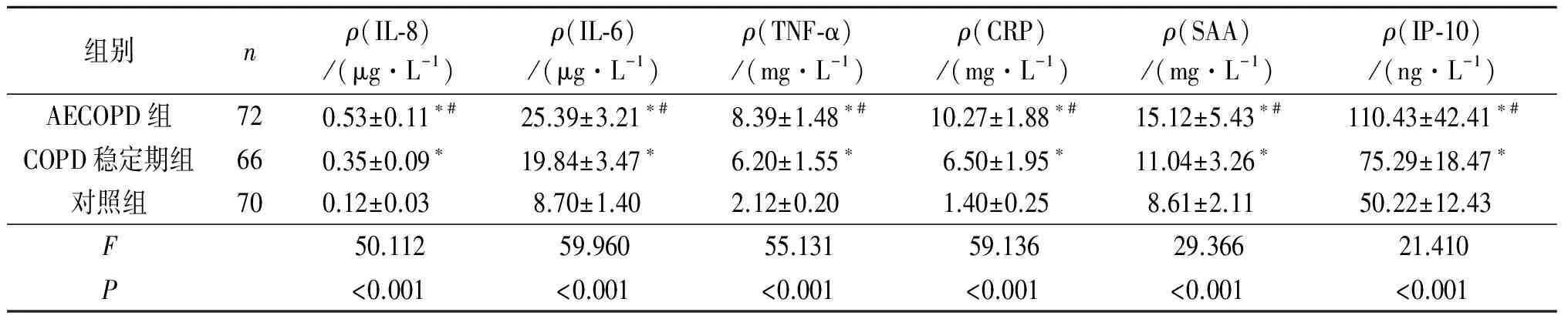
表2 3组受试者血清IL-8、IL-6、TNF-α、CRP、SAA、IP-10水平的比较
*:与对照组比较,P<0.05;#:与COPD稳定期组比较,P<0.05
2.33组受试者肺功能比较AECOPD组FEV1和FEV1/FVC明显低于COPD稳定期组和对照组,差异有统计学意义,见表3。

表3 3组受试者肺功能比较 %
*:与对照组比较,P<0.05;#:与COPD稳定期组比较,P<0.05
2.4AECOPD患者血清IL-8、IL-6、TNF-α、CRP、SAA、IP-10与FEV1、FEV1/FVC、CAT评分的关系AECOPD患者CAT为(18.41±2.55)分。AECOPD患者FEV1、FEV1/FVC、CAT评分与血清IL-8、IL-6、TNF-α、CRP、SAA和IP-10相关分析结果见表4。由表4可知,血清IL-8、IL-6、TNF-α、CRP、SAA和IP-10与FEV1、FEV1/FVC呈负相关,CAT评分与血清IL-8、IL-6、TNF-α和CRP呈正相关,而与SAA和IP-10无关。
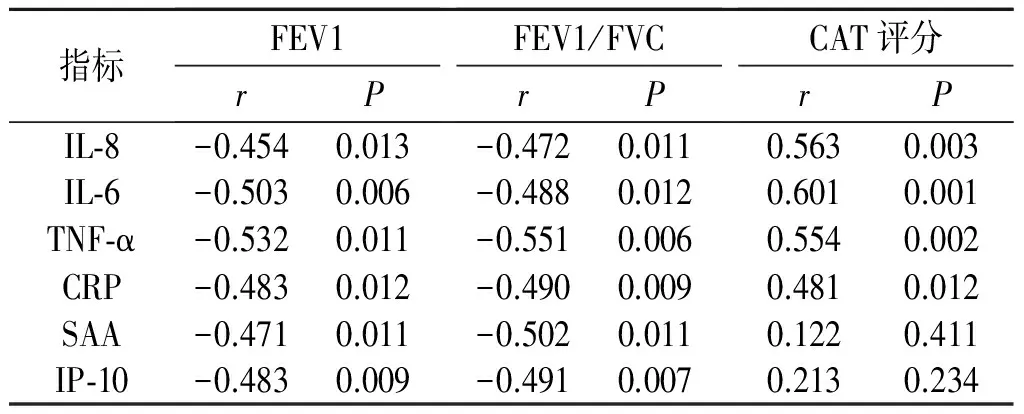
表4 AECOPD患者血清IL-8、IL-6、TNF-α、CRP、SAA、IP-10与FEV1、FEV1/FVC、CAT评分的相关系数列表
3 讨论
COPD的发生发展主要与长期的慢性支气管炎、肺气肿或者长期的肺泡上皮及平滑肌上皮细胞的重塑性改变等有关,特别是在具有吸烟史的人群中,COPD的发病率更高[6]。在COPD基础上发展而来的AECOPD,在短期内即可发生明显的肺功能恶化,病死率较高;患者合并肺心病或者肺动脉高压的风险较高,远期预后较差[7]。AECOPD治疗的总体有效率不高,远期肺心病等不良预后的发生率仍然较高[8]。对AECOPD发病过程中相关生物学机制的研究,可以为其药物治疗提供理论基础,并为病情严重程度的评估提供新的实验室指标。
IL-8、IL-6是重要的细胞炎症因子,二者的异常表达可诱导单核细胞、嗜酸性粒细胞、巨噬细胞或中性粒细胞等的浸润,导致支气管平滑肌细胞痉挛,加剧小气道阻塞,加重阻塞性通气功能障碍[2]。同时IL-8、IL-6的高表达还可导致呼吸道的高反应性,促进病情进展;TNF-α和CRP等因子可加剧肺泡及小气道平滑肌细胞完整性的破坏,促进支气管的组织重塑,影响气道气流的稳定性[9-10]。
本次研究中作者发现,在AECOPD患者血清中IL-8、IL-6、SAA、IP-10等细胞炎症因子的表达明显上升,提示IL-8、IL-6及CRP等可能参与了AECOPD患者的病情进展。IL-8、IL-6等的异常表达,可以通过下列几个方面影响AECOPD患者的病情[11-12]:①IL-8、IL-6的高表达,能够在激活单核细胞及中性粒细胞对于肺泡上皮的浸润过程中,加剧氧化应激损伤及氧自由基传递障碍。②CRP及TNF-α的高表达,在促进肺泡重塑的过程中,促进持续性的平滑肌痉挛,导致通气功能障碍。③SAA、IP-10的异常表达,可以通过加剧局部上皮细胞的呼吸电子链传递的异常,导致下游相关信号通路的异常激活,加剧炎症反应。研究[13-14]发现,AECOPD患者血清中TNF-α的浓度越高,则患者的肺功能越差、病情越为严重、病程越长,本次研究结果与之较为一致。FEV1和FEV1/FVC是反映AECOPD患者阻塞性通气功能障碍的指标,FEV1和FEV1/FVC等指标越低,患者的通气功能障碍越为明显,小气道的阻塞越为严重。本次研究中AECOPD患者的FEV1和FEV1/FVC等肺功能指标明显恶化,提示AECOPD患者的病情较为严重。而相关分析结果显示,IL-8、IL-6、TNF-α和CRP与患者的肺功能指标有关。从机制上分析IL-8、IL-6、TNF-α和CRP等指标与肺功能的关系,主要考虑与不同的炎症因子对于小气道的狭窄、小气道上皮组织重塑性改变等有关。张杰根等[14]并不认为IL-8、IL-6、TNF-α等指标与患者的肺功能具有密切的关系,这主要与COPD的发作病程长短不一、相关血清学指标的检测时机不同及基础性的治疗措施的差别等有关。本次研究中并未发现CAT评分与患者血清SAA、IP-10有关,考虑可能与样本量不足及临床资料的收集偏倚等有关。
综上所述,AECOPD患者血清IL-8、IL-6、TNF-α及CRP明显升高,且与患者肺功能呈负相关,提示这些因子在疾病发生发展中起着一定作用。
[1] MOHAN A,ARORA S,UNIYAL A,et al.Evaluation of plasma leptin, tumor necrosis factor-α, and prealbumin as prognostic biomarkers during clinical recovery from acute exacerbations of chronic obstructive pulmonary disease[J].Lung India,2017,34(1):3
[2] LIU XJ,BAO HR,ZENG XL,et al.Effects of resveratrol and genistein on nuclear factor-κB, tumor necrosis factor-α and matrix metalloproteinase-9 in patients with chronic obstructive pulmonary disease[J].Mol Med Rep,2016,13(5):4266
[3] 蔡蓉,郭雪君.AECOPD患者炎症相关指标检测及临床意义[J].临床肺科杂志,2013,18(11):1948
[4] 蔡蓉,宋琳,郭雪君.慢性阻塞性肺疾病急性加重期患者炎症因子的变化及意义[J].广西医学,2015,37(2):258
[5] 金梅,季志宇,范丽芳,等.血清IL-5、TNF-α检测对慢性阻塞性肺疾病急性加重期的临床意义[J].临床军医杂志,2013,41(2):130
[6] HAW TJ,STARKEY MR,NAIR PM,et al.A pathogenic role for tumor necrosis factor-related apoptosis-inducing ligand in chronic obstructive pulmonary disease[J].Mucosal Immunol,2016,9(4):859
[7] KARGIANNAKIS M,FITZSIMMONS DA,BENTLEY CL,et al.Does telehealth monitoring identify exacerbations of chronic obstructive pulmonary disease and reduce hospitalisations: an analysis of system data[J].JMIR Med Inform,2017,5(1):e8
[8] 景璇,郭洁,张嘉,等.加味麻杏石甘汤配合穴位贴敷治疗老年慢性阻塞性肺病急性加重期患者的效果及对肺功能和肿瘤坏死因子-α、白细胞介素-8表达的影响[J].中国老年学杂志,2017,37(1):132
[9] 龙仕居,陈忠仁.慢性阻塞性肺疾病患者急性加重期与缓解期痰液及血清IL-6、IL-8、TNF-α表达水平的差异及其临床意义[J].重庆医学,2012,41(19):1970
[10]潘云虎,季志宇,李发根,等.血清IL-8、TNF-α及IGF-Ⅰ检测在慢性阻塞性肺疾病急性加重期的临床意义[J].福建医药杂志,2013,35(1):74
[11]张连东,裴新军,谭美春,等.慢性阻塞性肺疾病急性加重期血清瘦素与肺功能关系的临床研究[J].中国急救医学,2014,34(8):708
[12]朱峥,周奇兴,张云凤,等.老年阻塞性肺疾病急性加重期患者诱导痰及血清中IL-8和IL-10的比较[J].临床肺科杂志,2012,17(5):784
[13]余苏云,高习文,颜志军.肿瘤坏死因子-α-308基因多态性与慢性阻塞性肺疾病急性加重表型的相关性研究[J].中华结核和呼吸杂志,2016,39(3):203
[14]张杰根,戴富林,武凡,等.慢性阻塞性肺疾病急性加重患者血清CRP、TNF-α和PLA2水平变化及意义[J].中华肺部疾病杂志:电子版,2014,7(3):72