胃食管反流病的胃镜检查要点
2018-04-02胡志伟吴继敏田书瑞汪忠镐
胡志伟 吴继敏 田书瑞 汪忠镐
胃食管反流病(gastroesophageal reflux disease,GERD)为胃内容物反流至食管、口腔(包括咽喉)和/或肺导致的一系列症状、终末器官效应和(或)并发症的一种疾病。GERD已成为一种常见的,甚至是危害极大的慢性疾病[1]。就GERD的典型症状(如反流、烧心等)而言,GERD影响约20%的欧美人群,约10%的亚太人群[2-3]。GERD的临床表现非常多样可表现为反流性咽喉炎、反流性咳嗽乃至反流性哮喘,涵盖了多数慢性耳鼻喉科和呼吸科的常见症状,症状可为偶发,也可频繁或持续[4]。众所周知,胃食管反流发生的主要原因是胃食管接合部的抗反流屏障功能削弱,包括食管下括约肌压力降低和/或食管裂孔功能不全,食管裂孔疝(hiatal hernia,HH)破坏了贲门的抗反流解剖学结构。
胃镜已经成为上消化道的常规检查,多数社区单位即可开展。胃镜不但可观察到反流相关并发症,如人们熟知的反流性食管炎以及更为复杂的消化性狭窄、食管溃疡、或Barrett食管(Barrett esophagus,BE)等,而且还可以显示贲门区域的解剖学形态,如贲门松弛、食管裂孔增大、乃至HH等解剖学改变。这些解剖学或形态学改变对于胃食管反流病的诊断、预后判断依据及治疗方法的选择至关重要[5]。一般的区县单位胃镜已经普及,而胃镜检查是反流性疾病评估的基本检查,胃镜检查通常被认为用来发现胃炎、胃十二指肠溃疡、息肉、癌前病变和肿瘤等,而GERD患者的胃镜检查除了用于排除上述问题外更应该注重食管黏膜和贲门形态的观察。我们的专科门诊常常会遇到GERD患者的胃镜下HH被漏诊的情况,其中一些HH非常明显但被忽略,另外一些胃镜报告单没有把贲门部位的照片打印出来,造成其他医师无法进一步判断贲门的形态,表明目前人们更注重GERD后果的观察,而忽略GERD病因的观察。由于质子泵抑制剂(proton pump inhibitor,PPI)等药物的广泛使用,胃食管反流造成的食管炎等黏膜病变往往可逆,胃镜检查时往往食管黏膜正常。而贲门部位的解剖学变化不受药物的影响,检查的重复性好,故从某种意义上说贲门形态更能反映GERD的疾病状态,从而更准确的指导临床。
一、胃镜评估相关定义
对于GERD患者多推荐用于症状顽固、症状加重、PPI治疗效果不佳、出现吞咽困难的患者,或用于有GERD并发症(如糜烂性食管炎、狭窄、柱状上皮化生和肿瘤等)风险的患者,或用于发现GERD病因(如贲门明显松弛和食管裂孔疝)。对GERD患者进行胃镜检查需要熟知下列概念,普通白光胃镜下,以管状食管与囊状胃的交界为胃食管交界处(gastroesophageal junction,GEJ),其镜下的定位标志为食管下端纵行栅栏样血管末梢处或最小充气状态下胃黏膜皱襞的近侧缘。反流性食管炎采用洛杉矶分级标准(LA):正常为食管黏膜无破损(non-erosive GERD,NERD);LA-A为1个或1个以上黏膜破损,长径≤5 mm;LA-B为1个或1个以上黏膜破损,长径>5 mm,但无融合性病变;LA-C为黏膜破损有融合,但<75%食管周径;LA-D为黏膜破损有融合,至少达到75%的食管周径。BE:最小充气状态下橘红色黏膜(相对于灰白色的正常食管黏膜)相对GEJ上移(活检证实为肠上皮化生),按病变长度可分为可疑BE(<1 cm)、短段BE(1~3 cm)和长段BE(≥3 cm)。内镜下滑动型HH诊断:患者左侧卧位平静呼吸,避免嗳气,适量充气状态,清晰显示GEJ,测量GEJ与膈肌脚(crural diaphragm,CD)的压痕距离,当距离≤0.5 cm时称为大致正常贲门,当距离≥2.0 cm时可诊断为HH(传统的胃镜下HH诊断标准),然而当距离>0.5 cm,且<2.0 cm时,也就是微小HH往往被忽视,然而微小HH对于GERD患者而言很可能就是其主要病因,故GERD患者微小HH也应该高度重视。其他类型的HH还包括食管旁疝(仅胃底疝入纵膈)、混合疝(胃食管连接部以及胃底均疝入纵膈)、巨大疝或胸腔胃(近全胃或全胃疝入胸腔)。另外需要强调的是,胃镜下所见的裂孔疝95%为滑动型食管裂孔疝,由于滑动型HH可随体位、胸腹腔压力变化、呕吐动作及胃镜的充气状态而上下滑动,故有一定的假阴性率,多次检查中如有一次被明确检出则可确诊。
由于贲门形态对于GERD患者的重要性,Hill等[6]提出了贲门“阀瓣”学说,即在食管与胃底之间有一块脊状组织看起来可以起到“阀瓣”的作用。Hill等进一步提出了一个胃镜下GEJ形态的Hill分级系统(图1)。Ⅰ和Ⅱ级阀瓣在正常对照中较为常见,而Ⅲ和Ⅳ级阀瓣在GERD患者中较为常见。目前该分级方法描述贲门的松弛程度较细致和准确,可准确预测GERD患者的状态[7]。
二、食管炎与GERD
食管炎洛杉矶分级(the Los Angeles classification,LA)对于GERD的诊断有良好的特异性,如果患者为LA-B及以上食管炎,则可以确诊为GERD,而NERD和LA-A级食管炎则有必要进行食管内反流监测等进一步检查[8]。胃欧美国家GERD患者食管炎检出率约为35%[9],其中LA-A、LA-B、LA-C和LA-D食管炎的比例分别为45%~55%、25%~30%、10%~15%、<5%[10]。本中心4 086例慢性GARD患者胃镜检查NERD的检出率为78.7%,食管炎为21.3%(其中LA-A为8.9%、LA-B为8.7%、LA-C为2.4%、LA-D为1.2%)[11]。发生食管炎的危险因素包括有GERD病史、超重、男性、吸烟习惯、无幽门螺杆菌感染、以及合并HH。其中GERD症状严重、烧心症状超过5年、肥胖、男性、白种人和HH者发生重度食管炎的危险性更高。而PPI和H2受体阻断剂等抑酸药为保护因素[12]。GERD人群中合并Barrett食管、炎性狭窄、食管溃疡的复杂型GERD约为5%[9]。
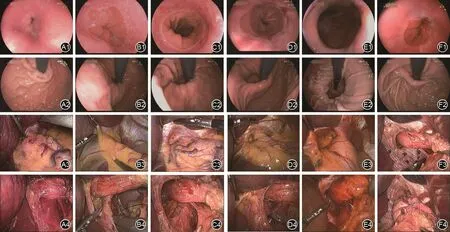
图1 Hill分级和抗反流术后对应的胃镜下和腹腔镜下胃食管交界区的解剖学形态。
对于食管外症状而言,哮喘患者中GERD症状、pH检查异常、食管炎和HH在分别占59.2%、50.9%、37.3%和51.2%[13]。食管pH监测证实为咽喉反流性疾病的患者中60%合并慢性烧心症状,12%合并食管炎,7%合并BE[14]。而胃镜证实有食管炎的GERD患者中23.9%合并有咽喉反流,其中HH被发现与咽喉反流明显相关[15]。另有研究表明食管炎患者较非糜烂性胃食管反流病(non-erosive gastrooesophageal reflux disease,NERD)患者的咽喉反流的合并率更高,且对PPI等抗反流药物治疗更敏感[16]。
三、BE与GERD
BE被认为是源于反流性食管炎的异常修复[17],我国将BE定义为食管下段复层鳞状上皮被化生的单层柱状上皮所替代的一种病理现象,可伴有或不伴有肠化生,伴有肠化生者易演变至食管腺癌[18],目前国际上达成广泛共识的BE分类方法为布拉格C&M分类法,布拉格C&M法对于≥1 cm的Barret食管可靠性系数为0.72,而<1 cm时,则只为0.22[19-20],故对于<1 cm的Barret食管应谨慎诊断,如果需要确诊则应该对所怀疑的部位进行活检,并对患者做好解释工作,消除患者对“癌前病变”的焦虑,以免给患者造成不必要的心理负担。随着消化内镜的广泛应用,BE检出率不断提高,西方国家普通人群BE发病率约为0.9%~4.5%,而GERD患者中BE检出率高达10%~15%[21]。本中心BE的检出率大致与西方GERD人群相似,其中<1 cm的可疑BE为8.3%,1~3 cm的短段BE为3.7%,而≥3 cm长段BE仅为0.2%。我国BE以可疑BE为主(占68%),而且长段BE的比例明显较低(1.6%vs37.1%),这与西方国家明显不同[11,22],BE节段的长度是癌变倾向的最强预测因子之一[23],故可以认为我国患者BE的癌变倾向明显低于西方国家的BE,所有不能对BE不加区别的谈BE色变。
四、贲门形态与GERD
GERD患者较非GERD患者有更高的HH合并率,据估计高达50%~90%的GERD患者合并有HH。通常胃镜下GEJ-CD的分离距离>2 cm才被诊断为HH,而EGJ仅上移0.5~2 cm的微小HH(0.5~2 cm,短段HH)常被忽视。本中心对GERD患者的胃镜分析发现,微小HH的检查率为20.4%,而>2 cm的传统HH的检出率(18.2%),我们发现微小HH的食管炎和BE的发生率明显高于EGJ没有上移的患者,说明微小HH也可以明显加重GERD或导致GERD的慢性化。胃食管交界区的抗反流屏障有多个解剖学组成部分:下食管括约肌(产生的腔内压力)、CD(产生的腔外压力)、膈食管膜(将下食管固定于膈裂孔)、以及His角的“阀瓣”[6],EGJ向近端移位进入膈裂孔则产生了滑动型HH,从而破坏了上述抗反流结构,所以有HH患者较无HH患者有更多的GERD发生率、反流症状,食管炎和BE[24-26]。合并HH的患者可观察到更普遍的GER相关性食管外呼吸道症状(如,咳嗽或声嘶),并且可能更容易出现夜间症状[27-28],HH的患者需要更高的剂量以及维持治疗[29]。另外,HH是发生BE,BE发生不典型增生,乃至食管腺癌的危险因素,并且HH越大危险性越高[30-31]。
本对中心GERD患者的胃镜分析发现随食管炎加重HH的合并率逐渐增高,其中重度食管炎(LA-C和LA-D)的HH合并率可高达86.9%,说明严重食管炎背后的根本问题可能是解剖学异常(食管裂孔疝)[11]。所以对于合并HH以及重度食管炎的内科治疗往往不是针对病因的治疗,这就不难理解HH患者的PPI剂量通常需要加倍,停药后容易复发,而且需要长程乃至终生维持治疗。故明显GERD症状和疝相关症状的HH需要通过抗反流手术纠正抗反流结构才能达到最佳疗效[32]。本中心一组476例HH患者抗反流术后平均随访4.4年,手术总有效率为95.5%,胃食管反流典型症状和哮喘样症状明显缓解,并且安全性良好[28]。由于内镜观察者往往太注重消化道黏膜的病变而忽略对贲门形态的细微改变的观察,然而贲门形态的细微改变(如功能或形态学松弛,乃至微小HH)都可能是HH形成的早期表现,到成为符合目前内镜标准的HH(GEJ-CD的分离距离>2 cm)往往是一个渐进和连续的自然过程,故HH的检出无论大小对于GERD患者很有意义,故对GERD患者贲门形态的着重详细描述和评估是非常必要的。还应该强调的是,95%的HH为滑动型HH,为可复性疝,并非每次胃镜检查都能检出,所以对贲门的观察应给于足够多的角度和时间则可能有助于提高滑动型HH的检出率。另外还可以结合食管测压检查和钡餐造影提高HH的诊出率。
五、年龄与GERD
大部分GERD可被视为一种常见的老年病,50岁之后的中老年是GERD的发病高峰,老年患者的抗反流药的使用率、反流性食管炎、BE乃至食管肿瘤均的发病率均明显高于非老年患者。另外,老年GERD的表现更不典型,症状严重程度更低,但黏膜病理更为严重。与非老年患者相比,老年患者的食管动力和解剖学障碍(如HH等)更严重。老年人唾液分泌减少,肥胖率更高,合并症(如糖尿病、帕金森病等)及合并症用药(如减压药等)更多,这些均是老年患者GERD发病率高且病情较重的影响因素[35]。
综上,胃镜是胃食管反流病评估最要的基础检查。对于胃食管反流病患者的胃镜检查应重点强调贲门的详细观察和描述。食管炎等胃食管反流并发症的检出对胃食管反流病的诊断有重要的参考价值,而贲门松弛程度及食管裂孔疝的评估对患者预后的判定及治疗手段的选择有更重要的意义。
