链霉蛋白酶在根除幽门螺杆菌中的效果观察
2018-03-30董浩金世禄朱凤鸣路敏敏
董浩,金世禄,朱凤鸣,路敏敏
(滨州医学院附属滨州市人民医院消化内科,山东 滨州 256610)
幽门螺杆菌(Hp)是一种寄生在为上皮黏膜的革兰氏阴性杆菌,可引起上消化道疾病的发生。在我国,自然人群Hp感染率为54.76%,其感染率与生活环境、生活习惯密切相关[1]。由于抗生素的耐药较高,诸多根除方案的根除率一直较低,需寻找一种根除率更高的治疗措施。链霉蛋白酶是由灰色链霉菌产生的蛋白分解酶制剂,主要通过切断胃粘液中粘蛋白的肽键起到清除黏液的作用,提高内镜下清晰度。研究[2]表明Hp不仅定植于胃小凹,而且定植于粘液表明凝胶层。链霉蛋白酶可明显破坏胃粘液表面凝胶层。基于这一研究,提出链霉蛋白酶可以破坏粘液层,冲刷幽门螺杆菌,有利于减少细菌数量,加强与抗生素局部接触。链霉蛋白酶作为一种根除Hp的新思路,期望今后应用提高根除率。
1 对象与方法
1.1 研究对象
选取2017年7月至2017年10月于滨州市人民医院行手术治疗的胃恶性肿瘤患者32例。其中男性22例,平均(58.00±4.70)岁;女性10例,平均(57.50±8.64)岁。病理学结果显示9例印戒细胞癌,23例低分化腺癌。入选患者未常规根除Hp或两周内未服用质子泵抑制剂(PPI),术前行14碳尿素呼气试验(14C-UBT)呈阳性。
1.2 方法
选取胃癌术后新鲜的胃窦癌旁组织标本1块,分成3组,分别浸泡于50 mL生理盐水、50 mL链霉蛋白酶颗粒+碳酸氢钠(20 000单位,30 min)溶液、50 mL乙酰半胱氨酸泡腾片(1片,30 min)溶液中,为模拟胃内环境,加入1 mL 10%稀盐酸,每4 min震荡1次。
取出上述3份标本置入甲醛溶液中包埋。石蜡切片脱蜡、水化、自来水冲洗。对组织进行相应的抗原修复。切片滴加过氧化物酶阻断试剂,室温孵育10 min,磷酸缓冲盐溶液(PBS)冲洗3次,每次3 min。去除PBS滴加第一抗体,室温下孵育60 min,PBS冲洗3次,每次3 min。去除PBS滴加辣根过氧化物酶(HRP)试剂,室温下孵育15 min,PBS冲洗3次,每次3 min。去除PBS滴加新鲜配制的二氨基联苯胺(DAB)显色剂显色;自来水冲洗终止显色,苏木素复染,PBS返蓝,经梯度乙醇脱水,二甲苯透明,中性树胶封固制作成切片。制成的切片每组随机选取5张。每张切片随机选取5个含胃黏膜的高倍(30X)视野,由两位病理科医师统计每个视野下Hp个数,并统计粘液层的厚度。
1.3 统计学分析
所得数据采用 SPSS 19.0软件进行统计学分析。组间比较采用成组设计资料的F检验,组内比较采用t检验法,均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组Hp个数比较
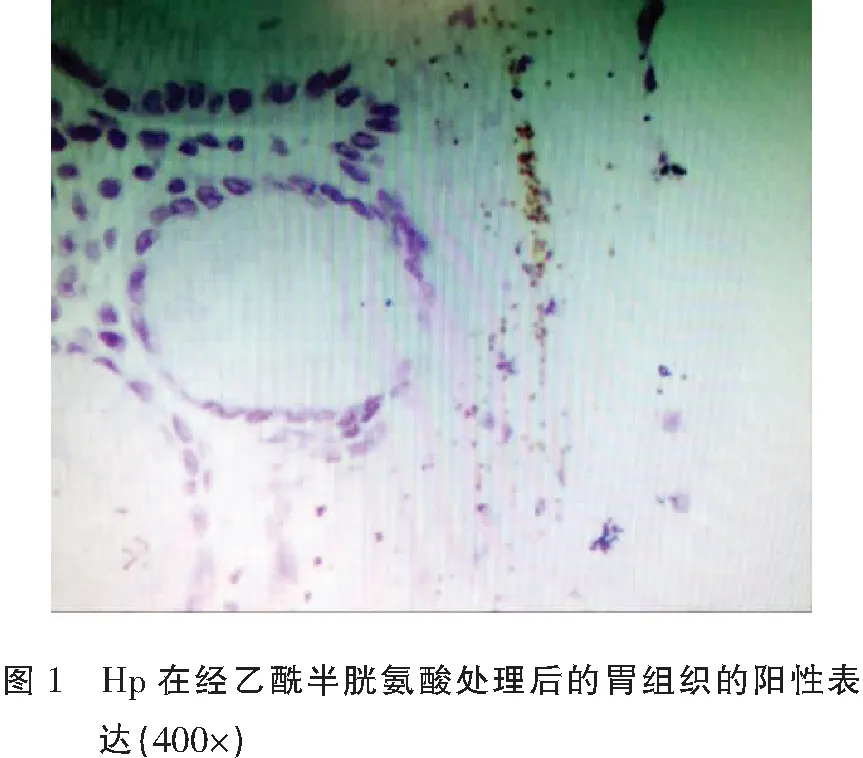
乙酰半胱氨酸组Hp个数为(16.67±6.05),链霉蛋白酶组Hp个数为(13.11±6.02),生理盐水组Hp个数为(17.95±7.30)。乙酰半胱氨酸组与链霉蛋白酶组比较、链霉蛋白酶组与生理盐水组比较差异均具有统计学意义(P<0.05)。见图1-图3。
2.2 各组Hp个数与各因素间的关系
不同性别、病理类型患者的Hp个数差异无统计学差异(P>0.05)。见表1。
2.3 各组粘液层厚度比较
乙酰半胱氨酸组粘液层厚度为(1.59±0.73)cm,链霉蛋白酶组粘液层厚度为(1.13±0.65)cm,生理盐水组粘液层厚度为(1.88±0.71)cm。乙酰半胱氨酸组、链霉蛋白酶组粘液层厚度均明显小于生理盐水组(P<0.05),乙酰半胱氨酸组粘液层厚度明显小于链霉蛋白酶组(P<0.05)。

表1 不同溶液浸泡后Hp个数与各因素间的关系±s,个)


2.4 各组粘液层厚度与各因素间的关系
不同性别、病理类型患者的粘液层厚度差异无统计学意义(P>0.05)。见表2。

表2 各组粘液层厚度与各因素间的关系±s,cm)
3 讨论
Hp是一种微厌氧菌,1983年首次由Marshall和Warren从慢性活动性胃炎患者的胃黏膜活检组织中分离成功[3]。流行病学研究表明,世界各国Hp的感染率不同,甚至同一国家不同地区的感染率不同。Hp感染引起的消化系统疾病有消化性溃疡、萎缩性胃炎、胃恶性肿瘤、胃粘膜相关淋巴样组织淋巴瘤。此外,Hp感染还能引起神经及精神系统、循环系统等诸多相关疾病[4-5]。链霉蛋白酶是由灰色链霉菌产生的蛋白分解酶制剂,主要通过切断胃粘液的主成分粘蛋白的肽键发挥作用。胃镜操作前口服或镜下直接喷洒,可以溶去除胃部粘液,使得镜下视野更清晰,提高早期胃癌检出率[6-8]。巫织娥等[9]人探讨小鼠模型研究链霉蛋白酶对于阿莫西林及甲硝唑浓度的影响,结果表明链霉蛋白酶可明显增加抗生素从胃腔到胃黏膜方向的弥散量,使得局部胃组织及血浆浓度升高,且以局部胃组织升高为主,持续时间长。这会导致黏液层变稀,减少抗菌药物弥散的距离。黏度降低可防止因表面黏蛋白结合抗菌物质而使其不能到达Hp定植位置。此外,链霉蛋白酶与抗Hp药物联合后,提高了局部感染组织的抗菌药物浓度,并有充分的持续作用时间,破坏Hp赖以结合的黏蛋白,使得细菌充分暴露。实验证实应用链霉蛋白酶并不会明显破坏胃粘膜上皮。实验同样证明阿莫西林和甲硝唑等药物根除Hp的胃腔直接弥散入胃黏膜和肠道吸入血再分布的双途径,且直接弥散入胃黏膜起到了很重要的作用。同样有研究[10]表明,阿莫西林与甲硝唑主要通过胃酸转移,而链霉蛋白酶还可以通过影响两种抗生素的转移起到根除Hp的作用。这就为口服根除Hp药物的给药方式及链霉蛋白酶的应用对根除率的影响提供了依据。
乙酰半胱氨酸是含有羟自由基清除剂的抗氧化剂,可以减少细胞膜脂质过于氧化,防止活化的核因子NFkB,是胃上皮细胞中促炎性因子的重要转录因子。国外实验[11]证明,乙酰半胱氨酸也能改变粘膜表面疏水性,导致胃粘液凝胶层厚度减少。文献报道乙酰半胱氨酸可以有效抑制Hp在体内、外的生长,故本研究选取乙酰半胱氨酸作为对照组,观察链霉蛋白酶与乙酰半胱氨酸对Hp的作用。
本研究通过将Hp的胃组织标本在不同溶液中浸泡,观察链霉蛋白酶是否起到冲刷Hp的作用,从而减少Hp在胃内定植的数量。本研究结果表明链霉蛋白酶与乙酰半胱氨酸降低幽门螺杆菌数量的效果均优于生理盐水;同时,链霉蛋白酶组的胃粘液层厚度较生理盐水组与乙酰半胱氨酸组相对更薄。可见链霉蛋白酶可破坏胃粘膜粘液层,冲刷Hp,减少Hp的定植。虽然经链霉蛋白酶及乙酰半胱氨酸溶液浸泡后Hp细菌数量差异无统计学意义(P>0.05),但链霉蛋白酶组的粘液层厚度薄于乙酰半胱氨酸组,这为链霉蛋白酶辅助根除幽门螺杆菌提供了切实依据。链霉蛋白酶主要通过降低胃粘液层厚度起到作用。胃粘液层中的粘液糖蛋白可保持粘液的弹性及粘性,起到保护、润滑的作用,粘液糖蛋白还是上皮细胞和管腔之间的屏障,提供营养物质、相关酶类及各类介质[12-14],有利于Hp定植,Hp可增强糖蛋白的产生,粘液的合成分泌及蛋白的基因表达。因此,粘液越少,Hp暴露越多,其根除率越高。
本项研究纳入样本量较小,将来应用链霉蛋白酶辅助根除Hp实验时仍需探讨其作用机制,且结论需大样本、多中心研究进一步证实。
[1] 刘新平,李鹏,白桦,等.链蛋白酶在胃镜检查中的应用价值[J].广西医学,2016,38(2):221-222.
[2] 杨静,徐凯,徐萍,等.链蛋白酶用于胃镜检查前胃内黏液清洗的效果观察[J].上海护理,2015(5):43-45.
[3] 项利娟,朱新建,黄德富,等.幽门螺杆菌感染调查与耐药性分析[J].中华医院感染学杂志,2015,25(8):1710-1711.
[4] 葛小金,姚刚,满玉红,等.幽门螺杆菌感染与神经系统疾病的研究进展[J].中国老年学杂志,2017,37(2):515-517.
[5] 程灿,李昌平.幽门螺杆菌感染对胃外疾病的影响[J].世界华人消化杂志,2016,24(13):2010-2018.
[6] 李练, 刘倩雯, 黎建军, 等. 超声胃镜检查前口服链霉蛋白酶对检查清晰度的影响及护理鄢[J]. 现代临床护理, 2016, 15(9): 36-39.
[7] Wang GX,Liu X,Wang S,etal.Effects of premedication with Pronase for endoscopic ultrasound of the stomach:A randomized controlled trial[J].世界胃肠病学杂志:英文版,2016,22(48):10673-10679.
[8] Kim GH,Cho YK,Cha JM,etal.Efforts to increase image quality during endoscopy:The role of pronase[J].World J Gastrointest Endosc,2016,8(5):267-272.
[9] 巫织娥,顾华英,梁艳娉,等.链霉蛋白酶稀释浓度与服用时间对胃镜检查质量的影响[J].中华消化内镜杂志,2015,32(10):673-677.
[10] Sherwood PV,Wibawa JI,Atherton JC,etal.Impact of acid secretion,gastritis, and mucus thickness on gastric transfer of antibiotics in rats[J].Gut,2002,51(4):490-495.
[11] Huynh HQ,Couper RTL,Tran CD,etal.NAcetylcysteine,a Novel Treatment for Helicobacter pylori infection.Digestive Diseases and Sciences.2004,49(11):1853-1861.
[12] Gurbuz AK,Ozel AM,Ozturk R,etal.Effect of N-acetyl cysteine on Helicobacter pylori[J].Southern Medical Journal.2005,98(11):1095-1097.
[13] 王波玲,高峰.标准三联与四联方案根除幽门螺杆菌感染成本-效果分析[J].中国全科医学,2016,19(11):1237-1241.
[14] Wang RQ,Fang DC.Effects of Helicobacter pylori infection on mucin expression in gastric carcinoma and pericancerous tissues.Journal of Gastroenterologyand Hepatol,2006,21(2):425-431.
