人胎盘间充质干细胞复合多孔羟基磷灰石支架的体内异位成骨效果
2018-03-30赵倩陈争晖青薇黄丽娟牟雁东任小华
赵倩,陈争晖,青薇,黄丽娟,牟雁东,,任小华
(1.西南医科大学口腔医学院,四川 泸州 646000;2.四川省人民医院,四川 成都 610000)
颌骨骨量不足或缺损是口腔种植中最常见的问题,特别是对于因肿瘤、外伤等造成大面积颌骨缺损的患者,目前的骨修复方式主要为自体骨移植、异体骨移植、人工骨移植等。其中人工骨移植可避免患者自身取材的痛苦和并发症,以及同种异体骨免疫排斥的危险。故近年来骨组织工程的研究发展迅速,其具有良好的组织相容性及可重复性,有望成为骨缺损修复的良好替代物[1-3]。
本研究,应用人胎盘来源的间充质干细胞复合多孔HA支架在比格犬的背肌内异位成骨,探讨多孔HA支架作为人工骨替代材料的异位成骨效果。
1 材料与方法
1.1 材料
动物:12月龄比格犬3只,体重10~12 kg,雄性,四川省人民医院动物实验室提供。细胞:人胎盘来源的间充质干细胞(hPMSCs),四川大学生物治疗国家重点实验室提供。主要试剂及仪器:DMEM培养基、胎牛血清、消化用胰酶、青-链霉素(Gibco公司);CO2培养箱(SANYO公司);JSM-7500F扫描电镜(日本日立公司)等。
1.2 细胞培养及传代、三系诱导分化、鉴定及生物相容性
方法见文献[4]。
1.3 多孔HA支架的制备与消毒灭菌
多孔HA支架由西南交通大学材料与生命工程学院制备:直径6 mm,高3 mm,孔隙率80%,孔径750~900 μm规格的多孔HA支架,材料的宏孔孔壁表面具有条纹样微渠结构(图1B)。环氧乙烷消毒,分装备用。
1.4 构建细胞支架复合体
取出多孔HA支架放于6孔板中,用DMEM培养基预先浸泡48 h。取第5代处于指数增长期的hPMSCs,用PBS洗涤两次后加入胰酶+EDTA消化3~5 min,再用含10%胎牛血清的DMEM培养基洗涤后,调整细胞悬液密度至终为2×105/mL,接种到已经处理好的多孔HA支架材料上,使材料刚好被细胞悬液浸润,3 h后将多孔HA支架翻面,将细胞悬液接种在材料的另一面,3 h后加入含10%的胎牛血清的DMEM培养基至刚好没过材料的顶面,构建好的组织工程骨在6孔板中共培养7 d,隔1~2 d换液1次。
1.5 扫描电镜观察人胎盘来源间充质干细胞在支架表面的黏附形态
细胞支架共培养2 d后取出,PBS清洗3次,2.5%戊二醛4 ℃固定24 h,体积分数为30%,50%,75%,85%,95%,100%梯度乙醇脱水,各15 min,临界点干燥,喷金,扫描电镜观察细胞在支架表面的形态。
1.6 多孔HA支架与细胞支架复合体植入比格犬背部
麻醉:犬禁食禁饮12 h,称重后用戊巴比妥钠3 mg/kg浓度行静脉注射麻醉,俯卧位固定于手术台,背部常规备皮,碘伏消毒,铺无菌巾。切开、植入、缝合:分别于3只犬的背部脊柱两侧分各作1个长约4 cm纵行切口,以血管钳钝性分离皮下组织及浅筋膜,深达脂肪深层,直至显露肌肉浅筋膜,再于暴露的肌层表面做3个长约1 cm纵行切口,分别以血管钳探入切口扩大腔隙在肌肉之间形成约10 mm×10 mm的肌袋,将多孔HA支架和细胞支架复合体以生理盐水或血液润湿后,置入上述肌袋中,背肌左侧3个肌袋中各放置1个多孔HA支架共9个为对照组,右侧3个肌袋中各放置1个细胞支架复合体共9个为实验组,再缝合该切口,使材料完全被肌肉包裹。稀释碘伏、生理盐水冲洗术野后,逐层缝合切口(图2)。术后处理:术后用青霉素160万单位肌注,2次/d,预防感染2 d。分笼饲养,给足量的食物、饮水。

1.7 取材及检测
术后12周,以上述方法麻醉后,从比格犬背部皮下肌层取材,取出后剔除材料周围肌肉组织并以生理盐水冲洗植入物表面后放入10%中性甲醛固定液,再进行下一步HE、Masson、免疫组织化学染色实验。
2 结果
2.1 术后组织愈合情况
术后3 d,所有犬只术后恢复良好,无感染等情况发生。
2.2 人胎盘来源间充质干细胞的形态
细胞呈典型的长梭形,大小均匀一致,集簇状生长,螺旋状排列,类似成纤维细胞样形态,生长状况良好,平均3~5 d传代1次(图1A)。
2.3 扫描电镜观察hPMSCs在支架表面黏附形态
hPMSCs在多孔HA支架中培养24 h后细胞的黏附情况佳,细胞倾向于沿着孔壁表面的条纹样微渠结构排列生长(图1C、D)。
2.4 HE染色组织学观察结果
第12周时,两组均有大量骨基质形成,但实验组已经可见成熟骨板结构(图3)。

2.5 Masson染色组织学观察结果
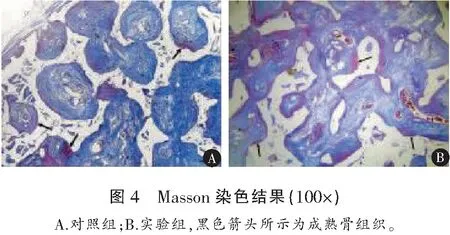
植入12周时,组织切片中的红染部分为成熟骨,实验组明显较对照组成熟骨的形成面积大(图4)。
2.6 免疫组化染色组织学观察结果
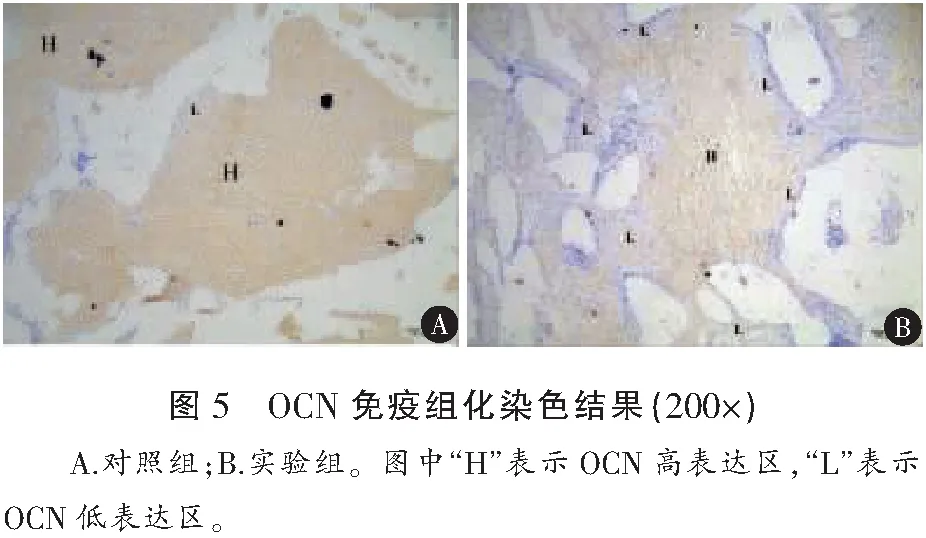
植入12周时,对照组OCN表达量强于实验组,而实验组的OCN在支架周围基本无表达,表达主要集中于支架的孔洞中心(图5)。
3 讨论
组织工程骨主要由种子细胞、支架材料、生长因子三部分组成[5]。其中种子细胞研究较多的为骨髓间充质干细胞,但其在骨髓中含量仅有0.001%~0.01%[6],且有研究表明,体外培养其传代最大值为24~40代,以后细胞则会出现衰老和生长抑制现象[7];脂肪干细胞属于成体干细胞,不具备无限增殖和分化潜能,在体外长时间培养还有自发向恶性转化的倾向[8];胚胎干细胞来源广泛、取材方便、具有全能分化能力,是胚胎发育早期囊胚内细胞团中尚未分化的细胞,能够长期保持未分化性增殖,充分保持干细胞的多能性,与骨髓间充质干细胞有相似的生物学特性[9]。因此本研究所用种子细胞为人胎盘来源的间充质干细胞,为较理想的种子细胞来源。对于支架材料而言,应需具备的关键性能为良好的生物相容性、骨传导及骨诱导作用。本研究所用多孔HA支架具体具备以下特性:(1)良好的生物相容性。(2)三维立体多孔结构。骨是一种新陈代谢率很高的组织,它需要大量的血管供应体内结构的平衡、生长和重建。本材料的多孔结构及适宜的孔隙率有利于种子细胞同外周环境进行物质交换,孔与孔间的贯通性既可为种子细胞的生长、增殖和分化提供充足的三维空间,又能促进新生血管和神经的长入[10]。(3)良好的材料-细胞界面。多孔HA支架表面的微沟槽结构使细胞倾向于沿着支架孔壁表面的条纹样微渠结构排列生长,且保持长梭形,部分细胞伸出伪足,有利于细胞更加紧密的粘附于支架表面,为细胞的黏附和增殖提供了良好的界面[11]。(4)支架材料易于消毒、保存,消毒后支架材料的内部结构完整无破坏。
本实验选取的异位成骨是指在非骨组织内成骨,一般可选择植入肌袋内或皮下,与原位植骨比能够排除在原位骨组织内植入时由于受体骨、骨膜本身成骨的假阳性结果,从而准确判断植入物的成骨能力仅来自植入的组织工程骨,使研究结果更为真实可信。而肌肉组织中具有丰富的血液供应,移植后能够提供良好的血供给组织工程骨,促进其成骨。故本实验选择异位成骨来研究多孔HA支架的成骨能力[12-13]。
从实验结果来看,hPMSCs与骨髓间充质干细胞形态极其相似,在多孔HA支架中沿着支架表面的微沟槽结构排列,粘附情况佳,提示支架为细胞的黏附和增殖提供了很好的三维空间结构,为组织工程骨的良好支架材料。HE及Masson染色结果显示,实验组与对照组在比格犬背肌内异位成骨情况均较好,支架孔隙中均可见大量血管结构,证明支架材料结构非常有利于血管的长入,能够为骨形成提供丰富的营养,以利于骨的形成[14-15]。实验组骨基质面积与成熟骨板面积大于对照组,说明前者成骨效率可能大于后者,提示hPMSCs细胞可能在成骨过程中持续发挥重要作用,在多孔HA陶瓷支架的诱导下向着成骨细胞、骨细胞方向分化,从而成骨效果更佳。免疫组织化学染色的OCN的表达情况显示,在12周时对照组成骨活跃,而实验组可见支架表面基本没有OCN的表达,提示此时支架表面已经成骨,仅在支架的孔洞中心还存在活跃的成骨行为,表明实验组成骨性能优于对照组。
综上实验初步探讨了人胎盘间充质干细胞复合多孔HA支架体内的异位成骨效果,实验结果显示两组在比格犬背肌内异位成骨效果均佳,实验组成骨效果优于对照组,提示体外培养的人胎盘来源间充质干细胞能够促进新骨的形成。
[1] Abdel Meguid E,Ke Y,Ji J,etal.Stem cells applications in bone and tooth repair and regeneration:New insights,tools,and hopes[J].J Cell Physiol,2017,9999:1-11.
[2] Arrabal PM,Visser R,Santos-Ruiz L,etal.Osteogenic molecules for clinical applications:improving the BMPcollagen System[J].Biol Res,2013,46(4):421-429.
[3] Sierra-Garcíal GD,Castro-Ríos R,Gónzalez-Hortal A,etal.Proteínas morfogenéticas óseas (BMP):aplicación clínica para reconstrucción de defectos en hueso[J].Gac Med Mex,2016,152(3):381-385.
[4] 伍佳,温永梅,吕欣荣等.人胎盘来源间充质干细胞的生物学性能及体外生物相容性[J].中国组织工程研究,2017,21(5):755-759.
[5〗 Zhang HF,Mao XY,Zhao DY,etal.Three dimensional printed polylactic acid-hydroxyapatite composite scaffolds for prefabricating vascularized tissue engineered bone:An in vivo bioreactor model[J].Sci Rep,2017,7(1):15255.
[6] Caplan AI.New era of cell-based or thopedic therapies[J].Tissue Eng Part b Rev,2009,15(2):195-200.
[7] Banfi A,Muraglia A,Dozin B,etal.Proliferation kinetics anddifferentiation potential of ex vivo expanded human bone marrow stromal cells:Implications for their use in cell therapy[J].Exp Hematol,2001,28(6):707-715.
[8] Kern S,Eichler H,Stoeve J,etal.Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood,or adipose tissue[J].Stem Cells, 2006,24(5):1294-1301.
[9] Kokubo T,and Takadama H.How useful is SBF in predicting in vivo bone bioactivity?[J].Biomaterials,2006,27(15):2907-2915.
[10] Vacanti C, Pietrzak WS.Musculoskeletal Tissue Regeneration:Biological Materials and Methods.New Jersey:Springer Science and Business Media,2008.
[11] Vacanti C,Pietrzak WS.Musculoskeletal Tissue Regeneration:Biological Materials and Methods[M].New Jersey: Springer Science and Business Media,2008.
[12] Miron RJ, Zhang YF.Osteoinduction: A review of old concepts with new standards[J].J Dent Res,2012,91(8):736-744.
[13] Rao RR,Stegemann JP.Cell-Based Approaches to the Engineering of Vascularized Bone Tissue[J].Cytotherapy,2013,15(11):1309-1322.
[14] Kaigler D,Krebsbach PH,Polverini PJ,etal.Transplanted endothelial cells enhance orthotopic bone regeneration[J].J Dent Res,2006,85(7):633-637.
[15] Kale S,Biermann S,Edwards C,etal.Three-dimensional cellular development is essential for ex vivo formation of human bone[J].Nat Biotechnol,2000,18(9):954-958.
